陕西扶风某生猪养殖场肠球菌分型与毒力基因检测
2021-05-06廉鲁昕牛沁雅曹晨阳盛焕精施春雷史贤明杨保伟
廉鲁昕,牛沁雅,曹晨阳,盛焕精,李 伟,施春雷,史贤明,杨保伟
(1 西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100;2 上海交通大学 农业与生物学院,上海200240)
肠球菌(Enterococcus)是存在于人和其他动物肠道中的一类常见条件致病菌,普遍存在于畜、禽生长环境及以畜禽产品为原材料的食品生产和加工环境中[1]。以前,人们普遍认为该菌对人和动物无害而被作为益生菌添加到动物饲料中,有研究表明,在仔猪饲粮中添加屎肠球菌可以改善生长性能, 维持肠道菌群平衡, 有效增强免疫力[2]。鸡饲粮中添加粪肠球菌能提高蛋鸡的产蛋量、鸡蛋蛋白高度和蛋黄颜色,降低血清和蛋黄总胆固醇含量,调节肠道微生物数量[3]。也有研究表明,粪肠球菌生长繁殖速度快,能耐受胃肠道环境,对O1和O78型大肠杆菌具有抑制作用,适合制作微生态制剂[4]。然而,2017年CHINET细菌耐药性的监测结果显示,肠球菌在医院分离的革兰氏阳性临床致病菌株中位列第二[5],表明分布广泛的肠球菌可能会引发人及动物的多种感染,对食品安全和公共卫生安全均存在严重威胁。
为评估肠球菌可能引起的猪肉食品安全性问题,段志刚等[6]和黄奕雯等[7]先后对郑州市零售鲜猪肉源肠球菌的亚型及江西省健康和腹泻猪仔粪便中粪肠球菌携带的毒力基因进行了研究,结果表明粪肠球菌、屎肠球菌及其所携带的毒力基因可能是引起猪肉食品安全问题的重要因素。陈秀恋等[8]对泉州市熟肉制品中血溶性肠球菌的检测结果也表明,肠球菌在猪肉食品中广泛存在,并可引发潜在食物中毒风险。相对而言,目前针对生猪养殖场中肠球菌的流行、分布和毒力基因携带情况研究较少,使猪肉生产链中对肠球菌可能引起的安全性把控缺少理论数据支撑。为此,本研究以陕西省扶风县某生猪养殖场为研究对象,对分离于该养殖场不同环境及相关生物样品的肠球菌进一步进行分型,并检测了其携带的部分毒力基因,以期为评估由此可能带来的猪肉食品安全问题提供依据。
1 材料与方法
1.1 试验材料
2015年12月和2016年4月,从陕西省扶风县某生猪养殖场采集同批生猪育肥前期和育肥后期的猪粪、猪鼻拭子、猪舍墙壁、猪舍地面、猪舍污水、猪舍土壤、猪槽、猪饲料、猪场空气沉降物和猪场工作人员粪便样品,用缓冲蛋白胨水(buffered peptone water,BPW)将样品进行1∶10稀释后,在肠球菌增菌肉汤中进行选择性增菌,将培养后的增菌液划线接种于mEI平板培养,挑取平板上带有蓝黑色晕轮的疑似菌落进行验证,共分离鉴定出87株肠球菌。将分离菌株保存于西北农林科技大学食品科学与工程学院微生物食品安全研究室。
琼脂糖(Agarose)购自美国Sigma公司,TaqDNA聚合酶、10×PCR Buffer、dNTPs、Mg2+、100 bp DNA Marker和DL2000 DNA Marker均购自宝生物工程(大连)有限公司,引物由杨凌天润奥科生物科技有限公司合成。
1.2 仪器与设备
SW-CJ-1CU超净工作台,苏州安泰空气技术有限公司;微量移液枪、5415D小型台式高速离心机,德国Eppendorf;MyCircle PCR基因扩增仪(Bio-Rad)、GEL DOC XR凝胶成像系统(Bio-Rad)、LAC-5080S高压灭菌锅,上海博迅实业有限公司;HH-4数显恒温水浴锅,北京科伟永兴仪器有限公司;GNP-9080隔水式恒温培养箱,上海精宏实验设备有限公司。
1.3 试验方法
1.3.1 肠球菌亚型分型 将保存于-80 ℃冰箱的菌株划线接种于MHA平板进行活化培养[9],挑取单菌落制备DNA模板。使用PCR技术,基于粪肠球菌、屎肠球菌、鸡肠球菌的特异性基因对87株肠球菌进行分型,试验所用引物见表1。

表1 肠球菌分型所用引物信息Table 1 Primer information for Enterococci subtyping
PCR反应体系为25 μL,其中10×Buffer 2.50 μL、Mg2+1.50 μL、dNTP Mixture(2.5 mmol/L)2.00 μL、TaqDNA聚合酶(5 U/μL)0.25 μL、上下游引物(10 μmol/mL)各0.30 μL、ddH2O 13.15 μL、DNA模板5 μL。反应程序为:94 ℃预变性5 min;94 ℃ 30 s,退火(退火温度见表1)30 s,72 ℃ 30 s,30个循环;72 ℃延伸5 min。PCR产物经1%琼脂糖凝胶电泳后,低温送至杨凌天润奥科生物科技有限公司进行测序,测序结果通过GenBank数据库Blast(https://blast.ncbi.nlm.nih.gov/ Blast.cgi)进行在线比对验证[6,10]。
1.3.2 毒力基因检测 采用PCR方法,对ace、cylA、cylB、cylM、cylL1、efaA、esp、gelE、AS、asal和hyl等11种肠球菌中常见的毒力基因进行筛查,引物序列[6,11-15]见表2。PCR反应体系及反应程序同1.3.1,退火温度如表2所示。

表2 肠球菌携带毒力基因检测所用引物信息Table 2 Primer information for virulence gene detection carried by Enterococci
1.4 数据分析
采用Excel 2010和Canoco 5软件对试验数据和图像进行处理,用SPSS 20.0和MINITAB 16软件对数据进行卡方检验、蒙特尔检验等统计学分析(P<0.05,表示差异显著;P<0.01,表示差异极显著)。
2 结果与分析
2.1 肠球菌分型
2.1.1 亚型检测结果 由图1可知,从陕西省扶风县生猪养殖场采集样品中分离出的87株肠球菌可被分为3种确定的亚型和1种其他类亚型,其中粪肠球菌检出率最高,为57.5%,极显著(P<0.01)高于屎肠球菌(10.3%)和鸡肠球菌(4.6%);其他亚型肠球菌的检出率为27.6%。

**表示检出率间差异极显著(P<0.01)** indicates significant difference among detection rates (P<0.01)
2.1.2 各亚型肠球菌在不同采样点分离株中的检出率 由于未在猪槽、猪饲料和猪场空气沉降物中检出肠球菌,所以仅对其他来源菌株进行分析,结果见图2。由图2可以看出,鸡肠球菌(n=4)仅在猪舍墙壁源菌株(75.0%)和土壤源菌株(25.0%)中有检出,检出率间无显著差异。粪肠球菌、屎肠球菌和其他类型肠球菌在6个采样点分离的菌株中均有检出。粪肠球菌(n=50)在猪粪源菌株中检出率最高(40.0%),且显著(P<0.05)高于猪鼻拭子和猪舍墙壁源菌株(均为14.0%)、猪场工作人员粪便(以下简称为人粪)源菌株(4.0%)和猪舍污水源菌株(2.0%)中的检出率,与猪舍地面源菌株中的检出率(26.0%)无显著差异(P>0.05)。屎肠球菌(n=9)在各采样点分离菌株中的检出率均无显著差异(P>0.05),其中在猪舍地面源菌株中的检出率最高(33.3%),其次是人粪源菌株(22.2%),猪粪、拭子、污水和土壤源菌株中的检出率均为11.1%。其他类型肠球菌(n=24)在各采样点分离株中的检出率间无显著差异(P>0.05),其中猪鼻拭子源菌株中的检出率最高(25.0%),其他依次为猪粪(20.8%)和猪舍墙壁、地面(16.7%)、土壤(12.5%)及人粪(8.3%)。
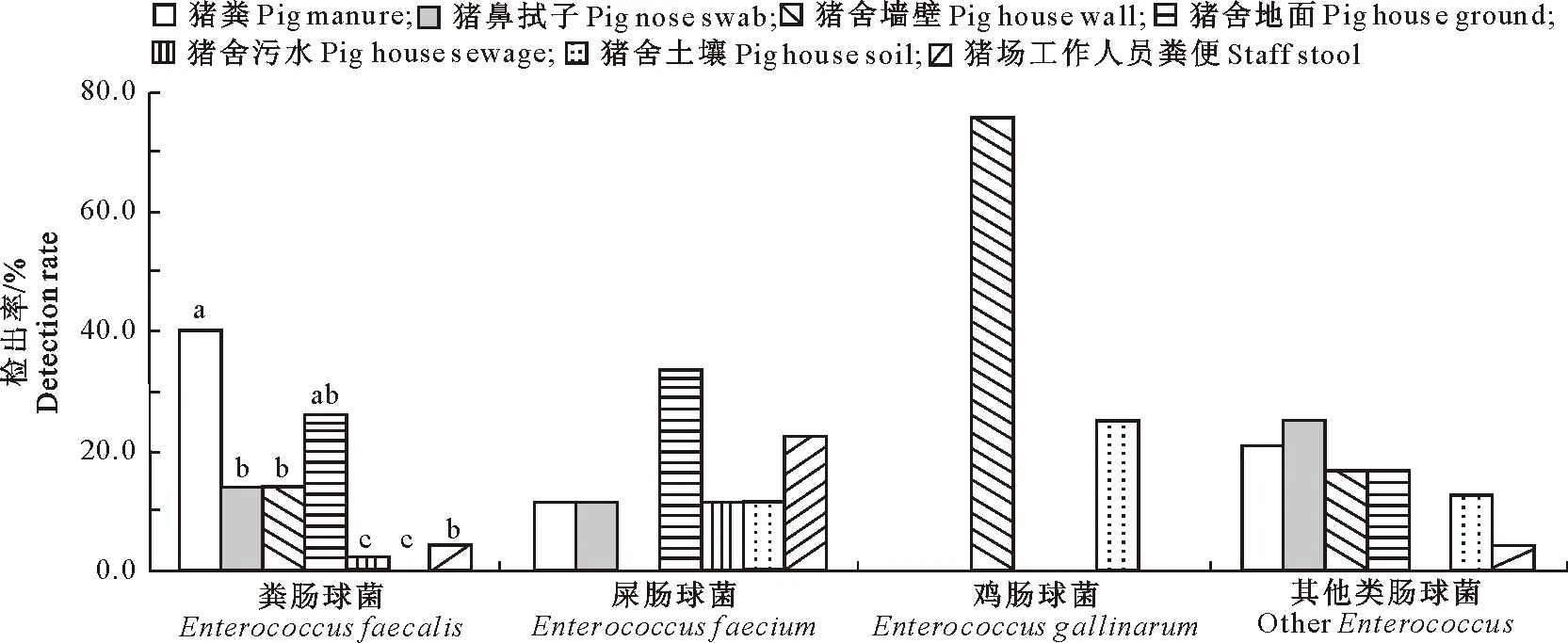
图柱上标不同小写字母表示不同采样点间差异显著(P<0.05)。下图同Different lowercase letters indicate significant difference among different sampling sites (P<0.05).The same as below图2 各亚型肠球菌在不同采样点的检出率Fig.2 Detection rates of Enterococci subtypes at different sampling sites
2.1.3 不同采样点菌株中各亚型肠球菌的组成 由表3可以看出,不同采样点源菌株中各亚型肠球菌的组成和比例不同。猪粪源菌株中,粪肠球菌检出率(76.9%)显著(P<0.05)高于其他类型肠球菌(19.2%)和屎肠球菌(3.9%)。猪鼻拭子源菌株中,屎肠球菌检出率(7.1%)显著(P<0.05)低于粪肠球菌(50.0%)和其他类型肠球菌(42.9%)。猪舍墙壁源菌株中,粪肠球菌(50.0%)、鸡肠球菌(21.4%)和其他类型肠球菌(28.6%)检出率间无显著差异(P>0.05)。猪舍地面源菌株中,粪肠球菌检出率(65.0%)显著(P<0.05)高于其他类型肠球菌(20.0%)和屎肠球菌(15.0%)。猪舍污水源菌株中只检出屎肠球菌和粪肠球菌(均为50.0%)。猪舍土壤源菌株中,屎肠球菌、鸡肠球菌和其他类型肠球菌检出率分别为20.0%,20.0%,60.0%,三者间无显著性差异(P>0.05)。猪场工作人员粪便中,粪肠球菌、屎肠球菌、其他类型肠球菌检出率均为33.3%。
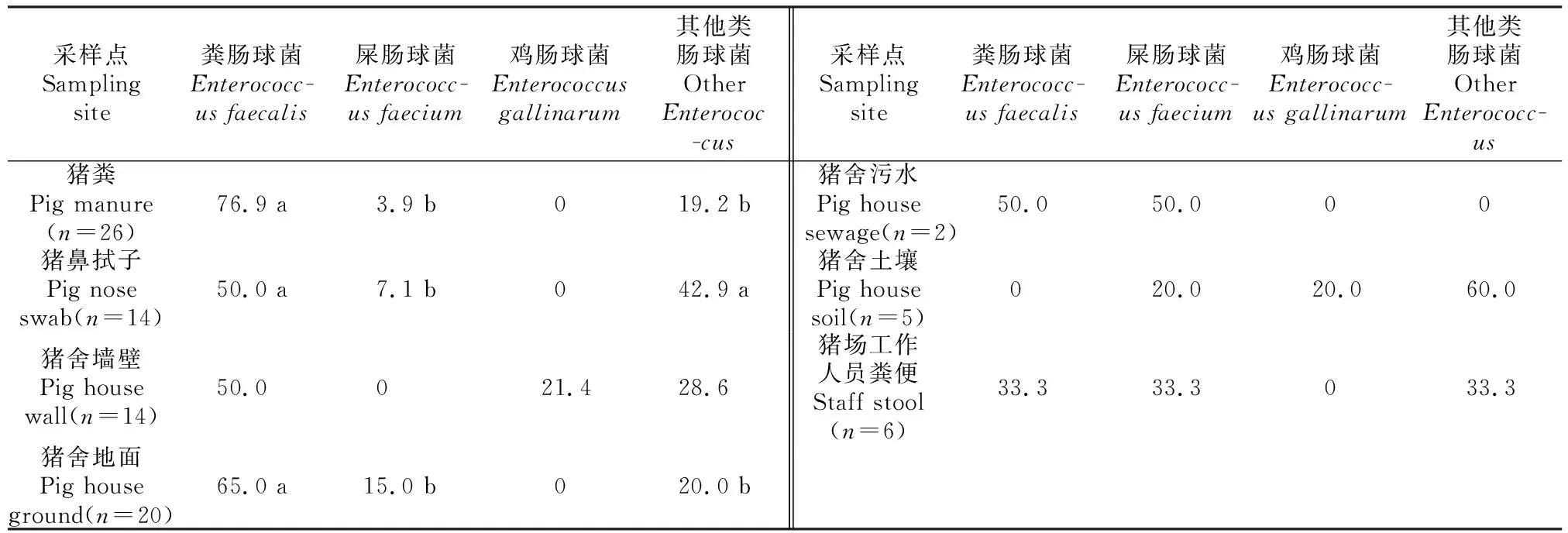
表3 不同采样点菌株中各亚型肠球菌的检出率Table 3 Detection rates of each subtype of Enterococci at different sampling sites %
2.2 毒力基因检测
2.2.1 肠球菌中毒力基因检测 由表4可以看出,在供试的11种毒力基因中,87株肠球菌中共检出5种毒力基因,其中asal的检出率最高(50.6%,其他依次为gelE(27.6%)、cylL1(19.5%)、ace(18.4%)和esp(1.2%)。asal的检出率显著(P<0.05)高于esp基因,其他基因检出率间差异不显著。

表4 肠球菌中毒力基因的检测结果(n=87)Table 4 Detection of virulence genes in Enterococci isolates (n=87)
由图3可以看出,5种毒力基因在各亚型肠球菌中的检出情况不同。粪肠球菌(n=50)中,asal的检出率(66.0%)显著(P<0.05)高于gelE(34.0%)、cylL1(26.0%)和ace(22.0%)。屎肠球菌(n=9)中,asal、cylL1、esp、gelE、ace的检出率分别为55.6%,44.4%,11.1%,66.7%和22.2%,相互间并无显著差异(P>0.05)。鸡肠球菌(n=4)中,asal、gelE和ace的检出率分别为75.0%,25.0%,75.0%,三者之间无显著差异(P>0.05)。其他类型肠球菌(n=24)中,只有asal被检出,检出率为12.5%。
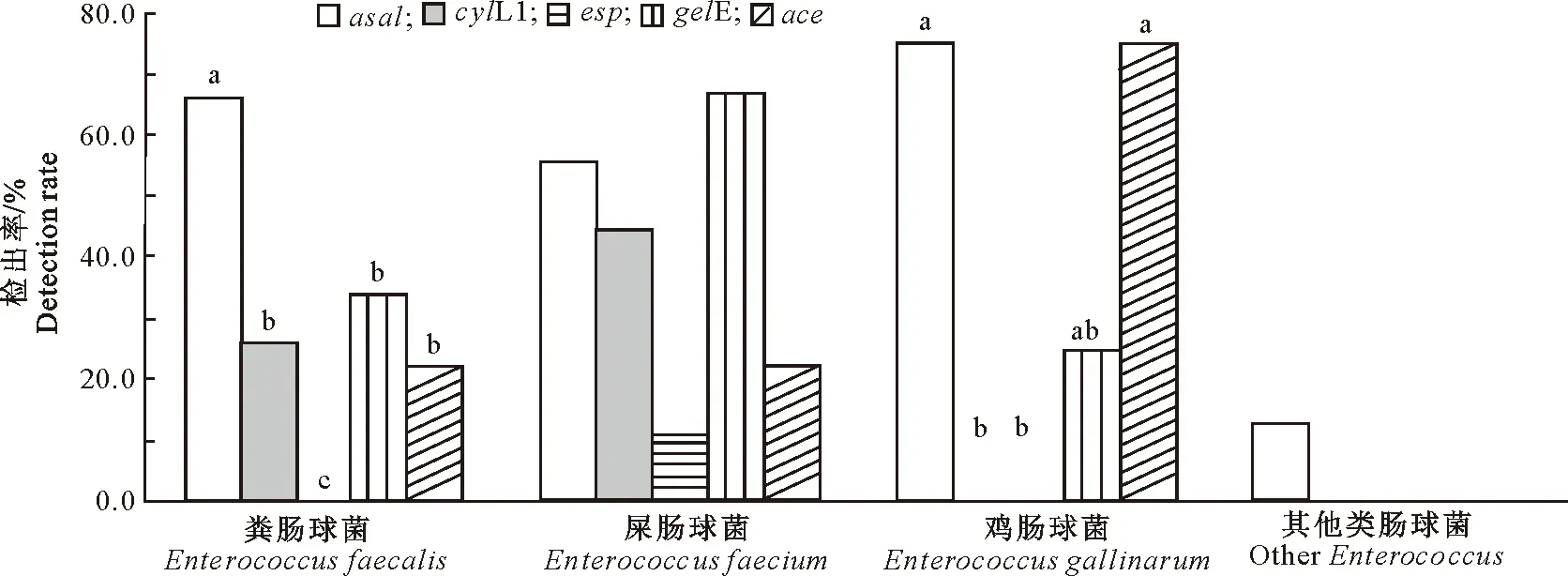
图3 不同毒力基因在各亚型肠球菌中的检出率Fig.3 Detection rate of virulence gene among isolates of different Enterococci subtypes
2.2.2 不同采样点肠球菌分离株中毒力基因的检测 由图4可以看出,5种毒力基因在不同采样点分离菌中的检出率具有一定差异。asal基因(n=44)在猪粪源菌株中的检出率(36.4%)显著(P<0.05)高于猪鼻拭子、猪舍污水和人粪源菌株中的检出率(后者分别为9.1%,2.3%和4.5%),而与猪舍墙壁源菌株、猪舍地面源菌株中的检出率(20.5%,27.3%)间无显著差异(P>0.05)。cylL1基因(n=17)在猪舍地面源菌株中的检出率(41.2%)显著(P<0.05)高于污水和人粪源菌株中的检出率(均为5.9%),与猪粪和猪鼻拭子源菌株中的检出率(35.3%,11.8%)间无显著差异(P>0.05)。esp基因(n=1)仅在猪舍地面源菌株中有检出。gelE基因(n=24)在猪舍地面源菌株中的检出率(37.5%)显著(P<0.05)高于猪鼻拭子、墙壁、污水、土壤源菌株中的检出率(8.3%,4.2%,8.3%,8.3%),而与猪粪源菌株中的检出率(33.3%)间无显著差异(P>0.05)。ace基因(n=16)在猪粪(25.0%)、猪鼻拭子(18.8%)、猪舍墙壁(25.0%)、猪舍地面(25.0%)和猪舍土壤源菌株中的检出率(6.3%)间无显著差异(P>0.05)。
2.2.3 生猪育肥前后期菌株中毒力基因的检测 表5显示,在育肥前期和后期,ace、cylL1、esp、gelE和asal在所有源菌株中总检出率分别为93.7%和6.3%,82.3%和17.7%,100%和0%,75.0%和25.0%及84.1%和15.9%。其中猪舍墙壁源菌株中gelE检出率在育肥后期高于育肥前期,猪场工作人员粪便asal检出率育肥前后相当,其他均表现为育肥前期高于育肥后期。
2.2.4 毒力基因的分布 毒力基因的分布在一定程度上受到采样时间、采样地点和菌株亚型的影响。由图5可知,从陕西扶风某生猪养殖场分离的87株肠球菌毒力基因的分布受采样地点的影响较小;但是受采样时间和菌株亚型的影响较大(P<0.01),其对ace、esp和asal分布的影响尤其明显。另外,菌株亚型对gelE、cylL1的分布也存在较为明显的影响。

*标记的因素对肠球菌毒力分布基因影响极显著(P<0.01)Factors marked by * have significant effects on distribution of Enterococci virulence genes(P<0.01)图5 肠球菌毒力基因与各影响因素间关系的冗余分析Fig.5 Redundancy analysis of relationship between virulence genes of Enterococci and various influencing factors
3 讨 论
肠球菌是一种革兰氏阳性菌,其对外界环境的抵抗力较一般细菌强,可在水、土壤及动物肠道内生存。肠球菌是人类和动物肠道正常菌群的一部分,通常在引起腹腔和盆腔感染所分离的混合菌中被发现。肠球菌既往被认为是人肠道的共栖菌,但近年来的研究证实肠球菌具有一定的致病力[16-17]。
李鹏[18]研究表明,在84株藏猪源肠球菌中,粪肠球菌和屎肠球菌高达76株,在肠球菌中的占比高达90.47%。段志刚等[6]在郑州市多个市场中采集的零售鲜猪肉样品中分离得到30株肠球菌,其中67%为粪肠球菌和屎肠球菌。本研究以从陕西省扶风县某猪场育肥前期和育肥后期猪生物样品、猪场水体样品、猪舍环境涂抹样品、养殖工作人员粪便等样品中分离到的肠球菌为材料,采用PCR方法对肠球菌进行了亚型分型和常见毒力基因检测,结果表明,粪肠球菌和屎肠球菌2种亚型在肠球菌中占比较高,与李鹏[18]、段志刚等[6]的研究结果相一致,由此可以发现,生猪养殖环境中流行的肠球菌亚型与生猪、市售猪肉中流行的肠球菌亚型较为一致,表明生猪养殖环境中流行的肠球菌可能就是市售猪肉肠球菌的重要来源之一,成为影响市售猪肉安全的重要因素。本研究中,猪生物样品和猪舍环境涂抹样品中各亚型肠球菌的检出率较高,可能与该猪场对猪粪便或猪舍清理方式及效率有关。为了防止生猪携带的肠球菌污染猪肉,导致食品安全事件发生,猪场应加强猪粪处理与猪场地面清洁,避免肠球菌在猪场内大范围传播。
在先前的研究中,刘利等[19]认为细菌感染过程十分复杂,毒力基因特异性表达及其协调作用是致病菌侵袭宿主、导致宿主致病的主要机制;也有研究表明,肠球菌致病是由多种毒力基因表达产物协同作用的结果[20-21]。因此,肠球菌携带的毒力基因对生猪养殖、猪肉及其产品安全至关重要。本研究对肠球菌中毒力基因的检测结果表明,asal的检出率最高,其次分别为gelE、cylL1、ace和esp,未检出cylA、cylB和efaA等6种毒力基因。朱宏等[22]对感染尿路的肠球菌毒力基因分析发现,粪肠球菌毒力基因携带量显著高于屎肠球菌,且粪肠球菌中asal的检出率最高。本研究中毒力基因asal的检出率最高,可能与粪肠球菌在供试菌株中占比最大有关。而该结果与黄奕雯等[7]对江西省猪源粪肠球菌中部分毒力基因的检测结果(毒力基因检出率由高到低依次为efaA、ace、gelE、agg、esp和cylA)略有不同,这可能与毒力基因传播的地域性以及猪场主要流行的菌株特性有关。但本研究与朱宏等[22]、黄奕雯等[7]的研究及其他研究[23]相比,gelE、ace和esp基因的检出率均比较高,表明其可能是肠球菌经常携带的主要毒力基因。
本研究针对不同采样点样品源菌株毒力基因的检测结果表明,多种毒力基因在猪粪源肠球菌中的检出率均比较高,这可能与肠道是肠球菌存在的主要环境有关。在生猪育肥前、后期采集到的样品中,育肥后期肠球菌毒力基因的携带率较育肥前期均有不同程度降低,推测可能随着生猪的不断生长,猪自身的免疫力逐渐提高,猪体及养殖环境中肠球菌的种类趋于一致,其携带的毒力基因种类和数量逐渐减少。刘桂华等[24]对吉林省某生猪养殖场不同采样点育肥前、后期采集的样品进行肠球菌分离,结果显示育肥前期肠球菌的检出率显著高于育肥后期,育肥后猪龄增大,其本身对肠球菌感染的抵抗力有所增强,与本研究结果相同。比较亚型、采样地点和采样时间对毒力基因分布的影响,可知采样时间和肠球菌亚型对其毒力基因分布的影响较大,与同类研究相比,本研究中采样点对于毒力基因分布的影响明显较小,此结果也可能与该生猪养殖场的卫生管控情况相关。
大量研究结果证实,肠球菌会引发禽畜的多种疾病,严重时甚至会导致死亡[25-26]。对肠球菌进行有效的亚型分型和毒力基因检测,为肠球菌致病机理等的进一步研究奠定了良好基础。依据本研究结果,可对猪场卫生条件做出合理的判断,进而优化卫生及质量管控措施,为临床治疗和食品卫生安全提供有力的保障。
