下调肝癌细胞中c-Met 抑制细胞增殖和迁移的实验研究*
2021-05-03顾王露周家名
顾王露,陈 莉,2**,周家名
(南通大学1 杏林学院医学部,2 医学院病理学系,南通 226000)
肝细胞癌(hepatocellular carcinoma,HCC)是世界上第六大最常见的癌症和第四大癌症相关死亡原因[1]。只有40%的早期或局部HCC 患者适合手术切除、肝移植、局部射频消融,20%适合经导管动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)等治疗。因为缺乏有效早期诊断方法,约80%的患者在进展晚期才被诊断。晚期肝癌预后差,中位总生存期仅为1~2 个月[2],主要的死亡原因是肿瘤的过度增殖、浸润、转移同时又缺乏有效的干预手段。因此探索能调控肿瘤增殖和迁移的关键基因作为干预靶点,对改善肝癌患者的预后具有重要意义。
肝细胞生长因子(hepatocyte growth factor,HGF)是目前已知生物活性最广泛的生长因子之一,能刺激多种上皮和内皮细胞进行有丝分裂、运动及促进肾小管形态发生,在组织器官损伤修复、形态发生和肿瘤转移过程中发挥重要作用。HGF 可由间质细胞产生,通过旁分泌作用于靶细胞上的肝细胞生长因子受体(hepatocyte growth factor receptor,HGFR)引起靶细胞的功能变化。高亲和性的HGF 的特异性受体是间充质上皮转换因子(mesenchymal epithelial transition factor,c-Met),这是一种由c-Met 原癌基因编码的蛋白产物,由二硫化物连接的异二聚体复合物组成,该复合物是一种跨膜单体,具有受体酪氨酸激酶(receptor tyrosine kinase,RTK)活性,与多种癌基因产物和调节蛋白相关,参与细胞信息传导、细胞骨架重排的调控,是影响细胞增殖、分化和运动的重要因素。HGF 与其特定受体c-Met 结合,后者位于肝细胞以旁分泌或自分泌的方式发挥作用。正由于HGF/c-Met 轴参与细胞增殖、运动、分化、侵袭、血管生成和凋亡[3],因此HGF/c-Met 轴在正常肝脏生长、再生和保护中起着关键作用[4]。由于HGF/c-Met 轴在细胞增殖、迁移、存活、形态发生和上皮-间充质转换(epithelial-mesenchymal transition,EMT)等细胞行为中起着重要作用,所以在一些恶性肿瘤细胞中存在持续激活的c-Met 信号转导通路[5-6],可促进肿瘤增殖转移,与肿瘤的恶性进展和不良预后有密切关系[7]。
本文采用小核酸干扰技术(small RNA interference,siRNA)下调肝癌细胞株(HepG2、Huh7)中c-Met 的表达,观察敲除c-Met 基因对癌细胞的干预作用。
1 材料与方法
1.1 细胞及试剂 肝癌细胞株(HepG2、Huh7)及正常肝细胞(LO2)购自上海中山医院肝癌研究所,保存于南通百奥迈科生物技术有限公司。DMEM 培养基及胎牛血清(fatal bovine serum,FBS)购自Gibco 公司;Trizol、RNA 逆转录试剂盒及LipofectamineTM2000 购自Invitrogen 公司;SYBR Green 实时定量试剂盒购自罗氏公司;抗c-Met 抗体和羊抗鼠IgG-HRP 购自Abcam 公司。羊抗鼠IgG-TRITC 购自BOSTER 公司。3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-Htetrazolium bromide,MTT]染色液购自南京生兴生物公司;Transwell 小室购自Corning 公司;siRNA 质粒和实时定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR) 引物由百奥迈科生物技术有限公司合成。
1.2 方法
1.2.1 细胞培养 实验细胞保存于南通百奥迈科生物技术有限公司。细胞生长于含10% FBS 的DMEM培养基中,37 ℃、5%CO2加湿培养箱中常规培养。
1.2.2 构建靶向c-Met 基因的siRNA 用PGPU6/GFP/Neo 质粒构建靶向c-Met 基因的siRNA(si-c-Met)及阴性对照非特异性序列的siRNA(si-NC)(表1)。筛选下调靶基因的有效si-c-Met 用于后续实验。以si-NC 和未处理细胞作为实验对照组。

表1 siRNA 序列
1.2.3 细胞转染 取对数生长期细胞,调整其细胞密度为1×106个/mL,以1 mL/孔接种24 孔板中。参照LipofectamineTM2000 说明书进行siRNA(各吸取适量的siRNA 于50 μL Opti-MEM 中,轻轻混匀,保证siRNA 终浓度为100 nmoL/L)转染至HepG2 和Huh7肝癌细胞。
1.2.4 RT-qPCR 检测靶基因mRNA 水平 离心收集对数生长期的转染细胞和未处理细胞,分别使用Trizol 试剂提取细胞总RNA;将2 μg 总RNA 逆转录形成cDNA,根据SYBR Green 实时定量试剂盒说明书进行RT-qPCR 扩增。PCR 反应参数为:95 ℃20 s,55 ℃30 s,72 ℃30 s,共45 个循环;同时以GAPDH为内参。进行目的基因相对表达量的计算时使用2-△△Ct值法。c-Met 引物扩增长度101 bp:上游引物为5′-GACAAGCATCT-TCAGTTAC-3′,下游引物为5′-TGACAATGTTGAG-AGGTT-3′;GAPDH 引物扩增长度226 bp:上游引物为5′-GAAGGTGAAGGTCGGAGTC-3′,下游引物为5′-GAAGATGGTGATGGGATTTC-3′。
1.2.5 Western Blot 检测靶蛋白表达 将细胞接种于6 孔板中,置于37 ℃、5%CO2培养箱中培养24 h,细胞融合度达70%~80%时收集各组细胞,用SDS 蛋白裂解液裂解细胞,提取总蛋白,使用BCA 法测定蛋白浓度,并将蛋白裂解液进行SDS-PAGE(5%积层胶,8%分离胶)电泳后,采用湿转印仪以200 mA 恒流转印2 h,将凝胶中蛋白质转移到PVDF 膜上,用含5%脱脂奶粉的TBS 封闭液室温封闭2 h,加入一抗(1∶1 000)37 ℃孵育2 h,再加入二抗(1∶2 000)37 ℃孵育2 h,使用增强化学发光(enhanced chemiluminescence,ECL)法显影。结果分析:以内参基因作为内对照,使用ImageJ 软件分析目的条带的灰度值,计算目的基因相对表达量=目的条带灰度值/同一样本内参灰度值。
1.2.6 免疫荧光检测靶蛋白的原位表达 收集对数生长期细胞铺板24 h 后当细胞融合度达50%~60%时用4%多聚甲醛固定30 min,0.5% Triton 透膜处理15 min,1% BSA 液封闭30 min,用稀释好比例的一抗(1∶50)孵育,4 ℃过夜。加羊抗鼠IgG-TRITC 二抗(1∶100)室温30 min。用1 μg/mL 的Hoechst 避光复染细胞,室温孵育10 min,用抗荧光淬灭封片液封片,荧光显微镜下观察,采集图像。
1.2.7 MTT 法检测细胞增殖能力 离心收集对数生长期的各组细胞,铺96 孔板,细胞密度为5×104个/mL,每组4 个平行,100 μL/孔。每孔加入10 μL MTT,37 ℃避光放置4 h。加入150 μL/孔二甲基亚砜(dimethyl sulfoxide,DMSO),37 ℃放置10 min。吹打混匀后取120 μL 于另一干净96 孔板中,并取120 μL DMSO 作为空白对照调零,酶标仪上测吸光度(optical density,OD),波长为490 nm。以时间为横坐标、吸光度为纵坐标绘制细胞增殖曲线。
1.2.8 电镜样品制备 将灭菌后的小圆玻片放入24 孔板中,分别接种细胞,待细胞爬片密度约60%进行转染。加入2.5%的戊二醛4 ℃固定24 h。电镜样本自备由南通大学电镜室协助完成。
1.2.9 Transwell 实验检测细胞侵袭能力 取对数生长期细胞接种于24 孔板,并且在Transwell 小室的上室和下室中分别加入100 μL 和600 μL DMEM完全培养基,37 ℃5%CO2孵育过夜。转染48 h 后用DMEM 基础培养液将细胞重悬,调整细胞密度至1×106/mL。24 h 后吸弃上下室的培养基,用棉签轻轻擦拭上室的细胞,磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗后10%甲醇固定细30 s,将下室浸没于0.2%的结晶紫溶液中,染色5 min,用锋利刀片沿边缘将小室的膜切下,并在倒置显微镜下计数穿膜移到下室的细胞,每张膜计数5 个不同视野(×250)并拍照。
1.2.10 统计学方法 每组实验至少重复3 次。所有数据以表示,使用GraphPad Prism 5 软件进行统计学分析。各组样品间的比较采用t 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 肝癌细胞中c-Met 的表达 用RT-qPCR、Western Blot 和免疫荧光染色检测HepG2、Huh7 中c-Met 的表达,用正常肝细胞LO2 作为对照(图1)。图1 结果显示,与LO2 相比,HepG2 和Huh7 细胞中c-Met mRNA 和蛋白表达水平均显著上调(P<0.01)。免疫荧光染色显示该基因蛋白表达位于细胞质或细胞边缘。该结果提示肝癌HepG2、Huh7 细胞中该基因明显过表达。

图1 c-Met 在肝癌细胞(HepG2 和Huh7)和肝细胞(LO2)中的表达
2.2 siRNA 有效下调癌细胞中c-Met 基因mRNA的表达 si-c-Met 转染HepG2 和Huh7 细胞后用RT-qPCR 的方法检测筛选有效si-c-Met 敲降靶基因的效果。如图2 所示,在HepG2 和Huh7 细胞中与转染si-NC 组相比,转染si-c-Met 后靶蛋白mRNA表达被siRNA 显著下调(P<0.05),尤其是c-Met-siR3和c-Met-siR4 抑制效率达到85%。故在后续实验中均选用c-Met-siR4。

图2 c-Met-siR 下调HepG2(A)和Huh7(B)细胞靶基因mRNA的表达
2.3 下调c-Met 的表达能抑制HepG2、Huh7 细胞增殖 HepG2、Huh7 细胞转染si-c-Met 后经MTT法检测显示细胞增殖水平下降(图3)。与转染si-NC组细胞的增殖能力比较,转染si-c-Met 后HepG2 细胞增殖能力从24 h 开始下降(t=3.244,P=0.031 6)。转染si-c-Met 后Huh7 增殖能力从48 h 开始下降(t=3.879,P=0.017 9)。
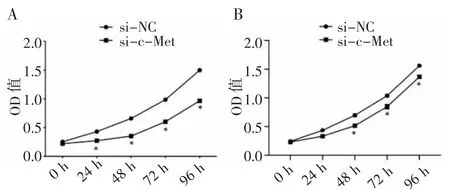
图3 c-Met-siR 转染HepG2(A)和Huh7(B)细胞后,细胞增殖能力下降(MTT 检测)
2.4 扫描电镜显示HepG2、Huh7 细胞转染si-c-Met 后细胞表面形态的改变 扫描电镜显示HepG2、Huh7 细胞转染si-c-Met 后细胞体积缩小,表面皱缩,与邻近细胞联系减少,显示发生凋亡趋势。进一步放大(×2 500)显示在细胞表面伪足减少、细而短,细胞间黏附减弱。相反转染si-NC 组细胞体积较大,无明显的凋亡趋势;细胞伪足粗而丰富,细胞黏附(图4)。
2.5 HepG2、Huh7 细胞转染si-c-Met 后细胞迁移能力下降 Transwell 迁移实验结果显示转染si-c-Met 后HepG2 细胞迁移均数(101.3±27.06)显著低于si-NC 组(323.7±5.132)。Huh7 细胞细胞迁移均数(115.0±21.66)显著低于si-NC 组(282.0±15.72)(均P<0.001)。提示敲降c-Met 后癌细胞迁移能力减弱(图5)。

图4 c-Met-siR 转染HepG2(A)和Huh7(B)细胞后,细胞表面形态变化
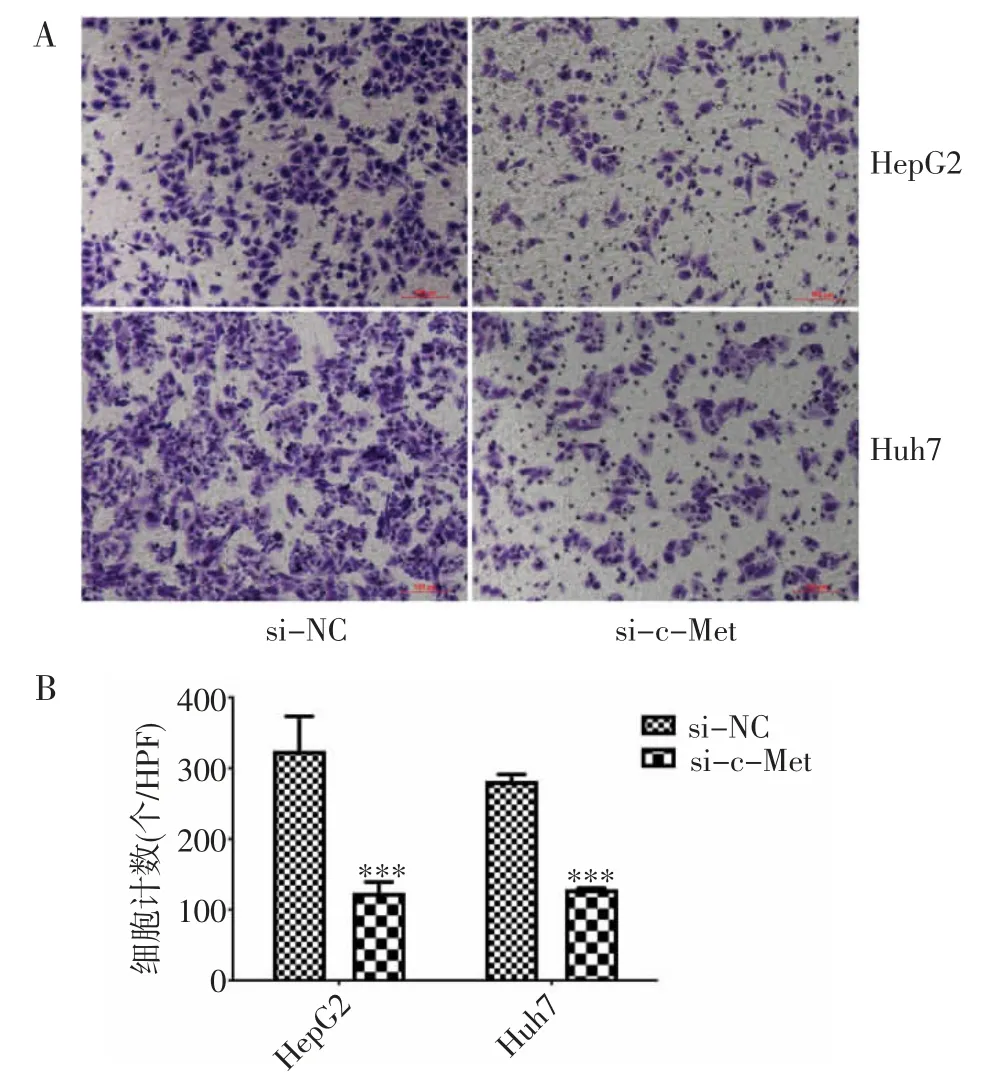
图5 c-Met-siR 转染HepG2(A)和Huh7(B)细胞后,癌细胞的侵袭能力减弱(Transwell 迁移实验)
3 讨论
HGF 最早在1984 年由日本的中村敏从大鼠血浆中得到,其结构是全部728 个氨基酸的肝素结合糖蛋白,由间质细胞产生,通过旁分泌作用于邻近细胞,并与细胞表面受体结合激活RTK 活性,作为较强的肝细胞有丝分裂原[8]促进上皮细胞的细胞运动。研究[3-7]还揭示其具有运动、损伤修复、凋亡等其他的功能。
c-Met 是一种极为重要的原癌基因,最早是C.S.COOPER 等[9]在研究应用化学致癌物(诱导)的人骨肉瘤Hos 细胞系时,克隆出的一个具有转化活性的片段,并将其鉴定为TRP 位点的一个融合基因,其融合产生了一个活跃的编码配体HGFR,定名为c-Met,作为一种跨膜蛋白,具有RTK 活性。被其配体激活后可产生广泛的细胞反应,包括增殖、存活、血管生成、创伤愈合、扩射、游走、浸润和器官发生[9]。c-Met原癌基因的RNA 存在于人类几种细胞中,如消化道上皮、神经元、肝细胞和造血细胞[10]。完整和正常的HGF/c-Met 信号是维持细胞正常氧化还原稳态的基础,并能抑制N-亚硝基二甲胺诱导的肝癌[11]。c-Met的二聚化和自体磷酸化是HGF/c-Met 信号通路的关键因素。已知在多种人类癌症(肾、肺、肝、乳腺癌、结肠、甲状腺、卵巢和胰腺)中存在HGF/c-Met 信号通路的异常激活,如c-Met 过度表达、扩增、与其他配体结合或异常高的HGF 水平,导致肿瘤的启动和进展[12]。c-Met 在前列腺、结直肠、乳房、恶性黑色素瘤、肝细胞和子宫颈上的过度表达与分期、转移潜能和预后不良有相关性。在结直肠癌中c-Met 的mRNA 拷贝数的增加与肿瘤的侵袭程度相关。在乳腺癌中c-Met 的表达增加与生存时间短相关,而且相对于人表皮生长因子受体-2、表皮生长因子受体和激素受体状态是独立的预后指标。c-Met 在癌耐药性中起着关键作用[13]。此外c-Met 可诱导血管内皮生长因子A 表达能促进肿瘤血管形成[14-15]。总之,c-Met 的异常表达参与转移和侵袭并与较差的临床转归相关。由于c-Met 在肿瘤的发展和转移中起一定的作用,现在已成为药物治疗很有潜力的研究靶标。
S.TAKEO 等[16]研究表明HCC 中c-Met 扩增频率很低(1/20),但D.TAVIAN 等[17]发现在20%~48%HCC 标本中有c-Met 的扩增或过表达,而且癌中c-Met 水平高于癌周肝组织中。在HCC 中过度表达c-Met 比突变和扩增更常见,虽然并非所有的HCC 都与HGF 或c-Met 过表达有关[18],但高表达c-Met 的HCC 患者比低表达或无表达c-Met 的患者生存时间更短[19];因此HGF/c-Met 轴被认为是HCC 患者肿瘤侵袭性和预后的生物标志物[3]。本文采用RT-qPCR、Western Blot 检测发现在HCC 细胞中c-Met 基因mRNA 和蛋白明显高表达,免疫荧光染色显示该基因蛋白表达位于细胞质或细胞边缘。肿瘤细胞通常产生生长因子和受体的自主分泌。已发现与癌形成和发展有关的不同细胞类型之间出现异型信号(非自主分泌)。已有关于c-Met 蛋白的相关信号通过非自分泌机制促进肿瘤转移的报道。在体内非自分泌信号与自主分泌信号进行的是条件不均衡的竞争,恶性肿瘤的非内部生长因子对转移产生重大影响。正常细胞有能力通过减少c-Met 的表达来抵消HGF 的作用。而肿瘤细胞中c-Met 过表达,并呈现高水平的自体磷酸化,c-Met 过表达的肿瘤细胞对HGF 更敏感、更强烈,更具侵袭性,促进肿瘤进展。本文构建的siRNA 能有效下调HepG2、Huh7 细胞中c-Met 基因mRNA 和蛋白的表达。其中si-c-Met4 的抑制效率最佳,敲降靶基因c-Met 达到85%,以此用于后续实验。下调c-Met 基因后经MTT 法检测显示细胞增殖水平下降。扫描电镜显示HepG2、Huh7 细胞转染si-c-Met 后细胞体积缩小,表面皱褶,显示发生凋亡趋势。细胞表面丝状伪足形成减少。已知在肿瘤侵袭中瘤细胞向转移器官表面靠拢→肿瘤细胞用伪足贴在表面与内皮细胞黏连→肿瘤细胞借伪足从细胞间隙而移动到达基底层。伪足运动的本质是胞内细胞骨架微丝迅速重组装使细胞的形状轮廓随伪足的伸缩而变形,即微丝的变化牵引细胞运动。细胞伪足密度的差异,可能是细胞微丝组装的差异造成的,这一差异决定了细胞运动的能力和细胞移动的方向。正如Transwell 侵袭实验显示癌细胞转染si-c-Met 后迁移能力减弱。因此敲降癌细胞中c-Met 可使其恶性的生物学行为得到遏制。
本研究结果提示HCC 细胞(HepG2、Huh7)中c-Met 高表达与癌细胞增殖、迁移和伪足形成有关。下调c-Met 可抑制细胞的增殖、迁移,增加细胞发生凋亡,减少细胞伪足形成,干预肿瘤进展[20]。因此,靶向HGF/c-Met 轴是干预HCC 最有前途的探索之一[21]。通过研究将更深入地了解HCC 的侵袭的机制及关键信号通路,以利于阻断HCC 恶性进程,为临床寻找更有效的和新的靶向治疗位点,将改善HCC 患者的临床疗效和预后。
