黄酒生物酸化浸米与浸米浆水的利用
2021-04-27张波谢广发李国龙孙国昌金建明朱炜俊刘菊
张波,谢广发,李国龙,孙国昌,金建明,朱炜俊,刘菊
1(浙江经贸职业技术学院,浙江 杭州,310018)2(浙江树人大学 生物与环境工程学院,浙江 绍兴,312028) 3(绍兴黄酒学院,浙江 绍兴,312028)4(绍兴鉴湖酿酒有限公司,浙江 绍兴,312000) 5(会稽山绍兴酒股份有限公司,浙江 绍兴,312000)
黄酒是我国独有的、历史最悠久酒种之一,千百年来深受人们的喜爱并流传至今[1]。浸米是黄酒酿造过程中的重要环节,不仅使大米充分吸水膨胀以便于蒸煮,更能使米酸化,来调节发酵醪液的酸度,保障黄酒发酵安全进行[2-3]。传统浸米工艺时间长,所酿黄酒生物胺含量高[4]。浸米过程中会产生大量米浆水,含有大量的氮磷等有机质,直接作废水处理会给黄酒企业以及环境带来较大的压力[5-6]。生产过程中,因杂菌污染,经长时间浸米后得到的米浆水往往会产生“白花”和异嗅味[7]。这种米浆水直接回用会给黄酒带来不良风味,且易引起发酵醪液酸败。
近年来,针对黄酒浸米浆水中微生物群落结构以及米浆水的利用开展了大量的研究。由于黄酒自然浸米,米浆水中微生物群落结构复杂,毛青钟等[8]通过传统微生物培养方法,发现浸米浆水中含有细菌、霉菌、酵母等微生物。通过现代分子生物学技术研究黄酒浸米浆水中的细菌群落结构,发现乳酸菌是浸米浆水中的优势细菌,种类繁多且数量占据优势[9-12]。其大量产酸为发酵提供酸性环境,抑制杂菌生长,保证酵母正常代谢[13],而乳酸菌也是产生物胺的主要微生物之一[14-15]。因此如何在满足浸米产酸需求的同时减少生物胺的生成是亟需解决的问题。目前对米浆水利用主要是将其作为黄酒生产投料用水,通常会将米浆水经加热杀菌并冷却后再使用[16]。然而加热杀菌和冷却均会消耗大量的能源,用量较大时会使酿制黄酒中的高级醇、乙醛等微量有害组分增加[17],且氨基酸态氮和总酸含量大幅提高,对产品的安全性和口感造成不利影响。李海霞等[18]将米浆水用于循环浸米,使米浆水得到部分回用。在实际生产中,米浆水中乳酸菌多而有害杂菌少时,将老浆用于接种浸米,有利于浸米生酸。但由于自然浸米杂菌易生长繁殖,用老浆接种浸米很容易产生异嗅味。
本研究模拟自然浸米过程中乳酸菌发酵产酸过程,从浸米浆水中筛选出合适的乳酸菌进行生物酸化浸米,以消除米浆水异嗅味并降低生物胺含量,进一步将米浆水用于循环浸米和代替部分投料水使用。在保证黄酒品质和安全前提下的米浆水循环利用,对于减少废水排放,实现清洁化生产具有重要的现实意义,同时也具有良好的经济效益、社会效益和生态效益。
1 材料和方法
1.1 材料
1.1.1 实验材料
糯米、生麦曲、熟麦曲,取自绍兴某黄酒厂;安琪活性干酵母。
1.1.2 试剂与仪器
NaOH、NaCl、MgSO4、FeSO4、K2HPO4、CaCO3、CuSO4、柠檬酸铵、邻苯二甲酸氢钾、酚酞、次甲基蓝、酒石酸钾钠、5-磷酸吡哆醛,L-组氨酸,L-酪氨酸,L-鸟氨酸等,均为分析纯,中国国药化学试剂有限公司。
LBI-250恒温培养箱,上海龙跃仪器设备有限公司;G180DS灭菌锅,致微(厦门)仪器有限公司;E200MV电子显微镜,南京尼康江南光学仪器有限公司;Agilent 1200高效液相色谱仪,美国安捷伦公司;UV—5500紫外分光光度计,上海元析仪器有限公司;KA-1000离心机,上海安亭科学仪器厂;FE28型pH计,梅特勒-托利多仪器有限公司。
1.1.3 培养基
MRS培养基、GYP培养基,按参考文献[19]配制;米饭糖化液培养基:糖化液取自绍兴某酒厂,用0.1 mol/L NaOH溶液调至pH为6.2左右,加水稀释糖度为7~8°Brix,加1%柠檬酸铵;液体脱羧酶培养基,按参考文献[20]配制。
1.2 实验方法
1.2.1 浸米浆水中乳酸菌的分离筛选
称取100 g糯米加150 mL水于28 ℃浸米3~5 d,过滤得到米浆水,用无菌水梯度稀释到不同浓度(10-1~10-3)并涂布于平板底部,GYP培养基覆盖,33 ℃条件下培养3 d,根据有无透明圈来初步判断是否为乳酸菌[21]。挑取透明圈较大的菌落在MRS培养基上进行划线纯化,并进行革兰氏染色[22]。
1.2.2 乳酸菌生长和产酸能力测定
将纯化后的菌株用MRS培养基于33 ℃活化48 h,取活化菌液以5%接种量接种到米饭糖化液培养基中,于33 ℃静置培养48 h,分别测定发酵液OD600值和总酸含量。
1.2.3 低产生物胺乳酸菌的筛选
将浸米浆水中分离出的乳酸菌接种于液体脱羧酶培养基,33 ℃培养96 h观察颜色变化。然后离心取上清液,采用HPLC法检测生物胺含量[20,23],同时做空白对照。
1.2.4 乳酸菌的分子鉴定
提取DNA后,进行16S rDNA扩增,PCR产物经琼脂糖凝胶电泳分析,由上海生物工程有限公司进行序列测定,美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)数据库进行比对,使用MEGA7.0构建生物系统进化树[3, 13]。
1.2.5 生物酸化浸米浆水循环回用浸米
生物酸化浸米:称取100 g糯米以料液比1∶1.5(g∶mL)加入水,接种体积分数为5%的乳酸菌种子液,于28 ℃浸米3 d。以自然浸米为对照,观察浸米浆水的形态和品质,测定总酸、pH、OD600值。
生物酸化浸米浆水循环回用浸米:称取100 g糯米于250 mL三角瓶中(4份),按照料液比1∶1.5(g∶mL),使用生物酸化浸米结束后,过滤静置澄清的米浆水按照体积分数为20%、30%、40%、50%的比例代替自来水开始浸米3 d。完成第1次循环后,将第1次浸米结束后的浸米浆水经纱布过滤静置澄清后,按照回用比例用于第2次循环浸米,以此类推进行生物酸化浸米浆水的循环回用实验,浸米结束后测定pH、总酸、OD600值等理化指标。
1.2.6 生物酸化浸米米浆水回用酿酒实验
称取1 kg糯米,按照料液比1∶1.5(g∶mL)加水,接种体积分数为5%乳酸菌种子液并搅拌均匀,于28 ℃浸米3 d。回用的浸米浆水70 ℃保温30 min。采用常压蒸煮方式蒸熟米饭后摊开冷却,按米水比1∶1.15(g∶mL)的比例向酒坛中加入投料水(浸米浆水回用比例为20%),加入冷却的米饭,依次投入生麦曲130 g、熟麦曲30 g、1.5 g活性干酵母(需先活化20 min),均匀搅拌。在29 ℃条件下发酵,前3 d每天调低3~4 ℃,到第4天时温度调至15 ℃,保持此温度直至后酵结束。前酵阶段定时开耙,后酵阶段静置培养。以自然浸米酿酒为对照,跟踪发酵过程中第4、7、14、21 天的总酸、还原糖、酒精度的变化,黄酒理化指标分析参考GB/T 13662—2018《黄酒》[24]。感官品评邀请国家黄酒评酒委员进行品评打分。
2 结果与分析
2.1 适合生物酸化浸米的乳酸菌的筛选
2.1.1 浸米浆水中乳酸菌的分离筛选
将黄酒自然浸米过程中第3~5天浸米浆水通过稀释分离培养的方法涂布于GYP培养基上,在33 ℃恒温培养72 h,挑选出透明圈较大的菌株进行划线分离纯化,并经革兰氏染色为阳性的菌株,如图1所示,共得到65株菌株。
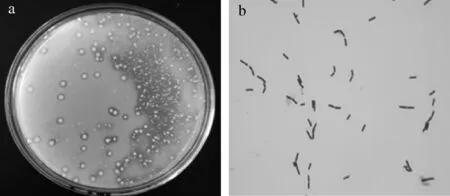
a-菌株透明圈;b-革兰氏染色图1 GYP培养基中的菌株透明圈及革兰氏染色情况Fig.1 Transparent circle and gram staining of the strain in GYP medium
2.1.2 菌株的生长和产酸实验
将上述65株菌接种于米饭糖化液培养基中,33 ℃培养48 h,分别测定其OD600值和总酸,观察其生长和产酸情况。选取总酸>4 g/L,OD600值>0.500的菌株,共得到20株菌,这部分菌株的总酸和OD600值如图2所示。在相同培养条件下,B1、C6、D3、F4、F6菌株OD600≥1.0,且总酸≥5.5 g/L,为生物酸化浸米初筛菌株。

图2 部分菌株培养48 h后的OD600值和总酸Fig.2 OD600 and total acid of some strains cultured for 48 h
2.1.3 菌株产生物胺实验
将挑选出的20株菌接种于液体脱羧酶培养基中于33 ℃培养96 h,以未接种乳酸菌的培养基为空白对照。菌株产生物胺能力越强,培养基颜色越深,观察液体脱羧酶培养基颜色变化,以“+”表示培养基颜色深浅,结果如表1所示。剔除液体脱羧酶培养基颜色较深的6株菌株B1、B4、E2、F6、G2、G5,剩余14株菌体培养液离心后使用反相HPLC上机检测生物胺(腐胺、组胺、酪胺)含量进行进一步确认,其结果如图3所示。不同菌株产生物胺能力不同,其中产生腐胺含量为21.30~114.20 mg/L,产生酪胺含量为10.46~30.81 mg/L,产生组胺含量为1.18~4.58 mg/L。生物胺总量在33.23~146.74 mg/L。产生物胺量较低菌株有A7、D3、F3。
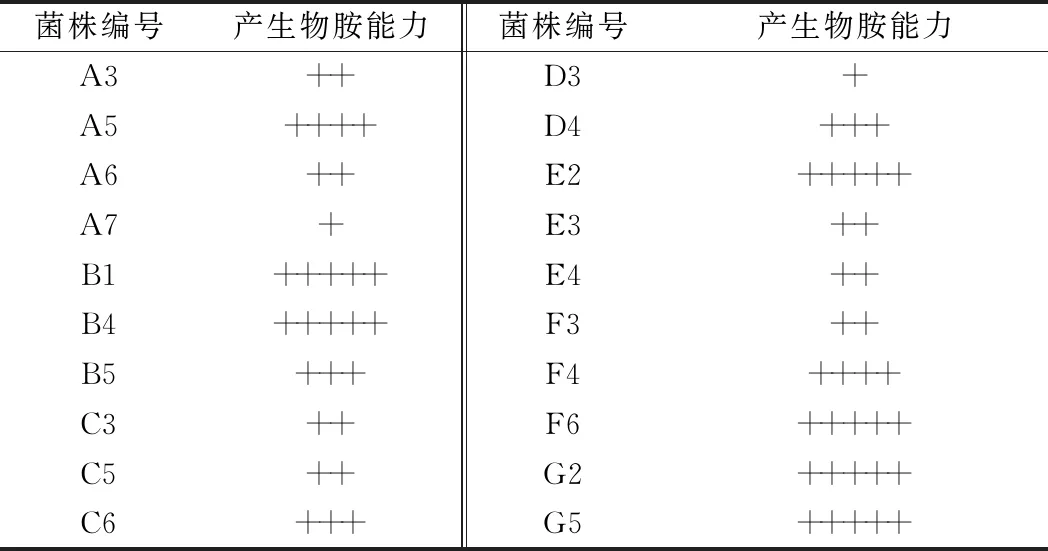
表1 分离筛选出的菌株产生物胺能力对比(液体脱羧酶培养基)Table 1 Comparison of biogenic amine production capacity of isolated and screened strains

图3 分离筛选出的菌株产生物胺能力对比Fig.3 Comparison of biogenic amine production capacity of isolated and screened strains
2.1.4 16S rDNA的分子生物学鉴定
根据图2和图3综合分析,D3的OD600值和总酸较高,且产生物胺能力较低,适合成为黄酒生物酸化浸米的目标菌株。目标菌株经16S rDNA扩增,琼脂糖凝胶电泳后得到约1 500 bp扩增产物。菌种测序后经过Blast序列比对,MEGA7.0构建系统进化树,结果如图4所示。菌株D3与LactobacillusplantarumNRPL B—14768亲缘关系最近,可以确定D3菌株为植物乳杆菌(Lactobacillusplantarum)。
2.2 生物酸化浸米浆水的循环回用浸米
2.2.1 生物酸化浸米浆水的品质及形态观察
接种乳酸菌D3种子液进行生物酸化浸米培养3 d,以自然浸米为对照,观察浸米浆水的品质和形态。自然浸米的浸米浆水气味不宜,有异嗅味和“白花”状物质。而生物酸化浸米浆水气味良好,表面无“白花”,品质比较均一。不同浸米方式米浆水的总酸和pH测定结果见表2。生物酸化浸米3 d已经使米浆水总酸达到了8.43 g/L,而自然浸米3 d时总酸只有4.55 g/L,直到5 d才达到8.50 g/L。说明生物酸化浸米能加快浸米进程,可有效缩短浸米时间2 d。
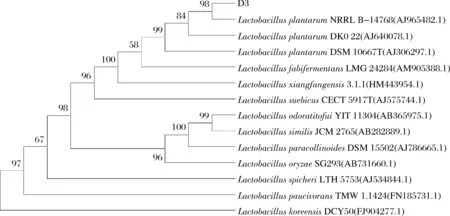
图4 基于16S rDNA序列构建的系统进化树Fig.4 Phylogenetic tree based on 16S rDNA sequence

表2 不同浸米方式的米浆水pH和总酸含量对比Table 2 pH and total acid content of rice water in different ways of soaking rice
2.2.2 生物酸化浸米浆水的循环回用浸米
生物酸化浸米3 d结束后的浸米浆水经纱布过滤静置澄清后,按照体积分数为20%、30%、40%、50%的比例替代自来水继续用于下一次生物酸化浸米,浸米结束后测定pH、总酸、OD600值。跟踪了9批次生物酸化浸米浆水循环回用过程,观察其指标的动态变化,其结果如图5所示。
由图5可知,随着生物酸化浸米浆水循环回用次数的增加,最初乳酸菌不断富集,所分泌的乳酸等使得总酸含量升高,浸米浆水的pH降低,同时米浆水中OD600值逐渐增加,第3次循环回用时总酸、pH和OD600已基本趋于稳定。对比自然浸米5 d的总酸为8.50 g/L,生物酸化浸米浆水回用比例为20%的总酸较低,达不到抑制杂菌的目的。而40%和50%的总酸则太高,不利于黄酒的酿造。循环3次后米浆水回用比例为30%时总酸为8.52 g/L,与自然浸米5 d的总酸基本相近,因此确定最适宜米浆水回用比例为30%。
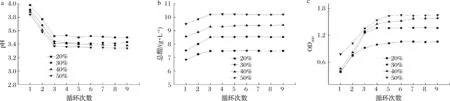
a-pH;b-总酸;c-OD600图5 黄酒生物酸化浸米浆水循环回用过程中pH、总酸和OD600值变化Fig.5 Changes of pH,total acid and OD600 in the water recycling process of rice soaked by biological acidification of Chinese rice wine
2.3 生物酸化浸米浆水回用酿酒实验
浸米是黄酒酿造的第一步,采用生物酸化浸米能够缩短浸米时间,提高浸米浆水酸度。黄酒是最终发酵产品,需通过黄酒酿造实验探讨生物酸化浸米对其影响,进一步探讨生物酸化浸米的可行性。称取1 kg糯米分别采用生物酸化浸米3 d和自然浸米5 d,然后进行黄酒酿造实验,其中生物酸化浸米在酿酒投料时以20%浸米浆水来代替自来水进行投料,分别测定发酵过程中第4、7、14、21天的总酸、酒精度、还原糖的变化,结果如图6所示。黄酒发酵过程中总酸呈现先快后慢上升趋势,生物酸化浸米的起始酸度高于自然浸米,但两者最终无明显差异,原因可能是投料时酸度增加抑制了产酸杂菌的生长。生物酸化浸米酿酒的酒精度较高,一方面由于浸米时间缩短减少了原料的淀粉损失,另一方面浸米水中较丰富的营养物质有利于酵母的生长和发酵。2种浸米方式对发酵过程和发酵结束后还原糖含量无明显影响。
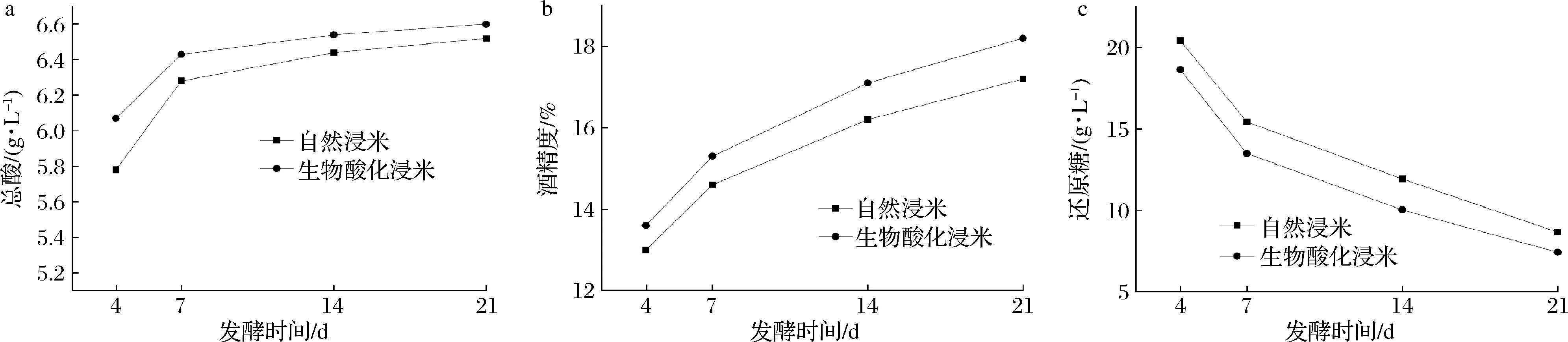
a-总酸;b-酒精度;c-还原糖图6 不同浸米方式酿酒过程中的总酸、酒精度、还原糖对比Fig.6 Total acid, alcohol content and reducing sugar during fermentation process in different ways of soaking rice
对后酵结束后压榨的黄酒进行理化指标测定和感官品评,结果如表3所示。对照GB/T 17946—2008《地理标志产品 绍兴酒(绍兴黄酒)》[25],所酿制的黄酒符合绍兴黄酒国家标准中优等品要求。生物酸化浸米酿制的黄酒总酸、总糖和非糖固形物与自然浸米酿造的黄酒无明显差异,酒精度和氨基酸态氮高于自然浸米酿造的黄酒。酒精度提高是由于浸米时间缩短、浸米过程淀粉损失降低及米浆水中带入有利于酵母生长的营养物质所致。氨基酸态氮提高是由于米浆水回用带入一定量的氨基酸所致,黄酒中氨基酸态氮含量适当提高有利于酒的醇厚性。经多名评酒委员品评认为,生物酸化浸米所酿黄酒与自然浸米所酿黄酒的感官质量无明显差异,且前者要略优于后者。同时,由于生物酸化浸米使用低产生物胺的菌株D3,能降低黄酒生物胺含量64.3%,对黄酒酿造的安全性有着积极意义。
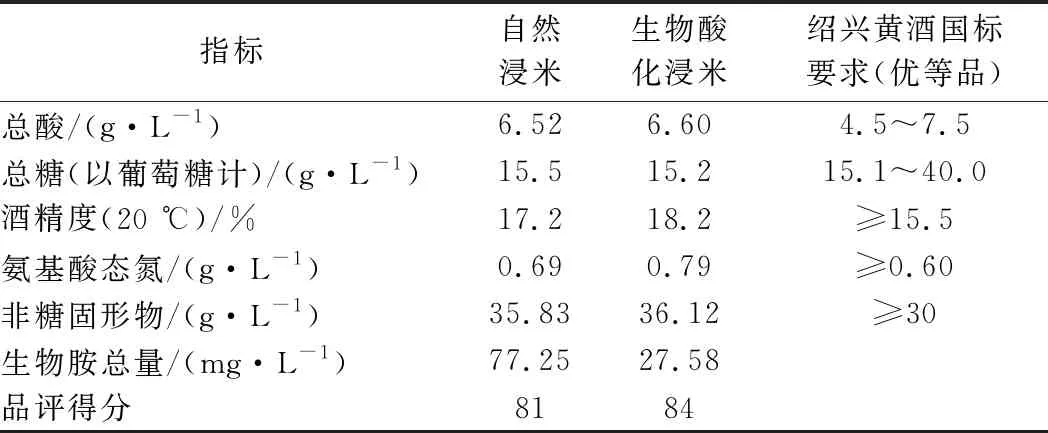
表3 不同浸米工艺黄酒后酵结束后指标测定Table 3 Indexes of Chinese rice wine after the fermentation by different ways of soaking rice
3 结论
传统的自然浸米时间长,浸米浆水处理成本高昂。本研究利用GYP透明圈和革兰氏染色从黄酒浸米浆水中分离出65株细菌,并研究其生长产酸以及产生物胺能力,获得了1株适合用于生物酸化浸米的乳酸菌D3,经过16S rDNA序列分析鉴定该菌株为植物乳杆菌(L.plantarum)。
将其应用于生物酸化浸米,对比自然浸米,生物酸化浸米浆水无不良气味,且缩短浸米时间2 d。将生物酸化浸米浆水静置澄清后循环回用,随着乳酸菌的不断积累,浸米浆水中的总酸升高,pH降低。循环回用3次后基本保持稳定,参照自然浸米的总酸,确定浸米浆水回用的比例为30%。
将生物酸化浸米(浸米浆水回用20%替代投料水)和自然浸米用于黄酒的酿造实验,跟踪发酵过程中第4、7、14、21天总酸、酒精度、还原糖的变化,发现生物酸化浸米酿酒的酒精度要高于自然浸米酿造的黄酒。对后酵结束后压榨的黄酒进行各项理化指标测定和感官品评,均符合GB/T 17946—2008《地理标志产品 绍兴酒(绍兴黄酒)》的标准。因此生物酸化浸米浆水回用于循环浸米和投料是可行的,且具有良好的经济效益和生态效益。
