肺鳞癌LC-42及腺癌SELS细胞中PDHA1及GBP1表达的测定
2021-04-23曾宪旭雷冬梅朱超亚张欢欢杜艳敏
曹 静,曾宪旭,雷冬梅,朱超亚,张欢欢,杜艳敏
郑州大学第三附属医院病理科 郑州 450052
正常细胞糖代谢是无氧糖酵解和有氧氧化磷酸化。肿瘤细胞在有氧情况下也选择糖酵解代谢,即使氧含量充足条件下,也偏于糖酵解代谢,这种现象称为Warburg效应[1]。丙酮酸脱氢酶E1α亚单位(pyruvate dehydrogenase E1α subunit,PDHA1)可以促使有氧糖酵解转变为氧化磷酸化,对肿瘤形成能起到抑制作用[2]。在糖代谢过程中,鸟苷酸结合蛋白1(guanylate-binding protein 1,GBP1)也起着一定调节作用,在炎性因子干扰素-γ诱导下产生,可发挥一定抗炎作用,尤其抗病毒、寄生虫效果明显[3]。目前,关于GBP1和肿瘤的相关性已经受到关注,不过已有的研究[4]集中在食管癌、结肠癌方面。PDHA1及GBP1在肺鳞癌及腺癌发生发展中的分子机制是当前此领域的研究重点。本课题组[5]以往对肺鳞癌及腺癌组织切片的免疫组化研究发现,PDHA1蛋白的低表达以及GBP1蛋白的高表达和肺鳞癌及腺癌患者的病情进展密切相关。本研究旨在明确肺鳞癌及腺癌细胞系中这两种基因表达的相互关系。
1 材料与方法
1.1细胞系肺鳞癌细胞株LC-42、肺腺癌细胞株SELS均为挪威奥斯陆大学肿瘤研究实验室冻存株。
1.2主要试剂siRNA及相应试剂选择Santa Cruz Biotechnology公司产品,包括GBP1 siRNA、PDHA1 siRNA、细胞转染培养液、转染试剂、转染对照siRNA(37007)。抗体:PDHA1(C54G1)系Cell Signaling Technology公司生产,GBP1(4D1O)系Novus Biologicals公司生产。
1.3细胞分组及处理两种细胞均6孔培养板培养至70%细胞融合后分为4组。空白对照(CT)组:不转染,用含胎牛血清的RPMI 1640培养48 h;siRNA对照(siRNA CT)组:转染对照siRNA 6 h,含胎牛血清的RPMI 1640再培养48 h;PDHA1 siRNA组:沉默PDHA1基因的转染混合液培养6 h,含胎牛血清的RPMI 1640再培养48 h;GBP1 siRNA组:沉默GBP1基因的转染混合液培养6 h,含胎牛血清的RPMI 1640再培养48 h。收集各组细胞用于后续实验。
1.4PDHA1与GBP1mRNA表达的RT-PCR检测两种细胞基因沉默后培养48 h,提取RNA,根据TaKaRa反转录试剂盒说明反转录合成cDNA。引物序列(表1)来源于NCBI数据库,经Primer Premier 5.0软件设计及BLAST检测其特异性,由TAG Copenhagen A/S公司合成。冰上配制反应体系:Template DNA/cDNA 2 μL,RNase-free ddH2O 10 μL,10×Buffer 3.0 μL,Taq 0.2 μL,dNTP 2.4 μL,上下游引物各1.0 μL。PCR反应条件: 94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,35个周期,最后72 ℃延伸10 min。采用2-ΔΔCt法计算mRNA相对表达量。实验重复6次。

表1 引物序列
1.5PDHA1与 GBP1蛋白免疫细胞化学染色检测采用EnVision二步法。分组培养48 h,胰蛋白酶消化细胞,体积分数4%中性甲醛固定,石蜡包埋细胞沉渣,包裹细胞团块加入到脱水盒内,然后按照次序梯度乙醇脱水、二甲苯透明、浸蜡、石蜡包埋、切片。白片经脱蜡水化,微波炉加热100 ℃10 min抗原修复,体积分数3%H2O2阻断非特异性染色10 min,滴加50 μL PDHA1及GBP1抗体(稀释度1∶100)室温孵育1 h,PBS洗涤5 min×3次,滴加50 μL EnVision/HRP二抗室温孵育30 min,PBS洗涤5 min×3次,DAB显色5 min,苏木精复染3 min,最后脱水透明及封片。设置阴性及阳性两种对照,即相同浓度且与相应抗体同源的非免疫性球蛋白作为阴性对照,已知的PDHA1阳性及GBP1阳性表达的食管鳞癌切片作为阳性对照。结果判读:PDHA1及GBP1蛋白阳性表达呈棕黄色,均定位于胞浆,计数10个高倍视野,计算阳性细胞所占百分比。实验重复6次。
1.6PDHA1与GBP1蛋白表达的Western blot检测转染细胞后培养48 h收集细胞,加入150 μL含蛋白酶抑制剂的RIPA裂解液,冰上裂解30 min,4 ℃15 000 r/min离心5 min,抽上清分装于1 mL离心管中。Bradford法测定蛋白浓度,酶标仪595 nm处测光密度值,计算上样缓冲液体积,配平各组蛋白量,100 ℃沸水变性5 min。聚丙烯酰胺凝胶电泳,上样体积20 μL,上样总蛋白30 μg,浓缩胶电压80 V,分离胶电压100 V,电泳时间约3 h。转膜电压60 V持续2 h,PVDF膜用含50 g/L脱脂奶粉的TBST溶液封闭1 h,PDHA1、GBP1抗体(稀释度1∶1 000)4 ℃过夜孵育,二抗室温孵育,洗膜及曝光。使用Image J软件进行灰度值分析,以目的蛋白与内参(GAPDH)条带灰度值的比值作为目的蛋白的相对表达量。实验重复6次。
1.7统计学处理采用SPSS 19.0进行数据分析。不同组间PDHA1及GBP1 mRNA、蛋白相对表达量及蛋白阳性细胞百分比的比较采用单因素方差分析,两两比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1各组PDHA1和GBP1mRNA表达的比较与CT组相比,PDHA1 siRNA组PDHA1 mRNA表达水平下降,而GBP1 mRNA表达水平升高;GBP1 siRNA组GBP1 mRNA表达水平下降,PDHA1 mRNA表达水平无变化。见图1、2,表2。
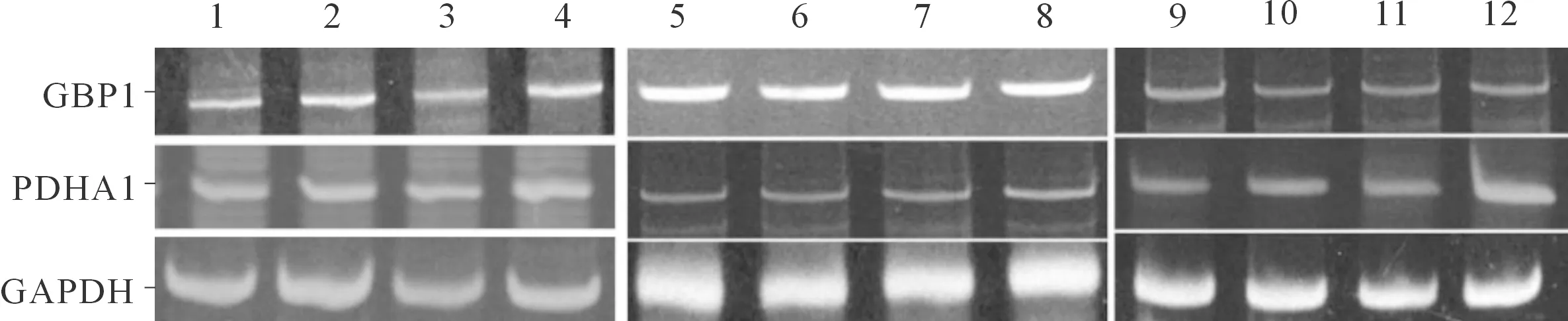
1、2:CT组;3、4:siRNA CT组;5~8:PDHA1 siRNA组;9~12:GBP1 siRNA组
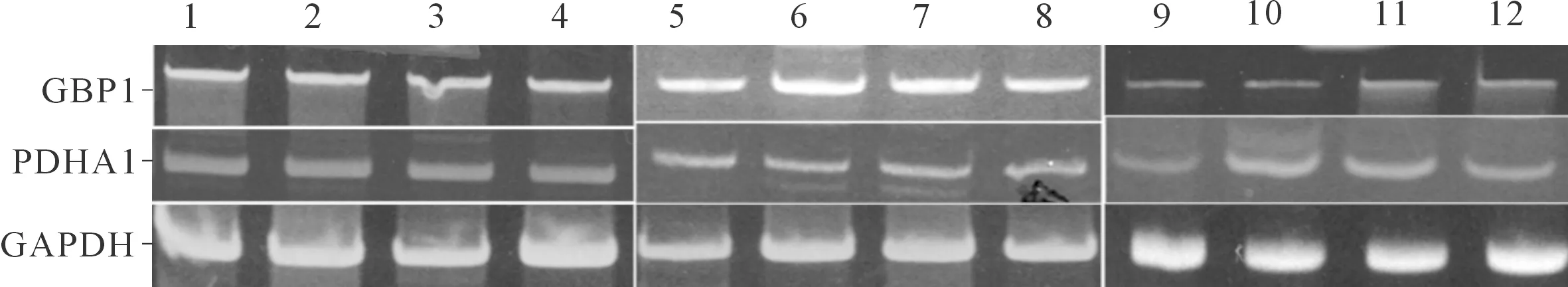
1、2:CT组;3、4:siRNA CT组;5~8:PDHA1 siRNA组;9~12:GBP1 siRNA组
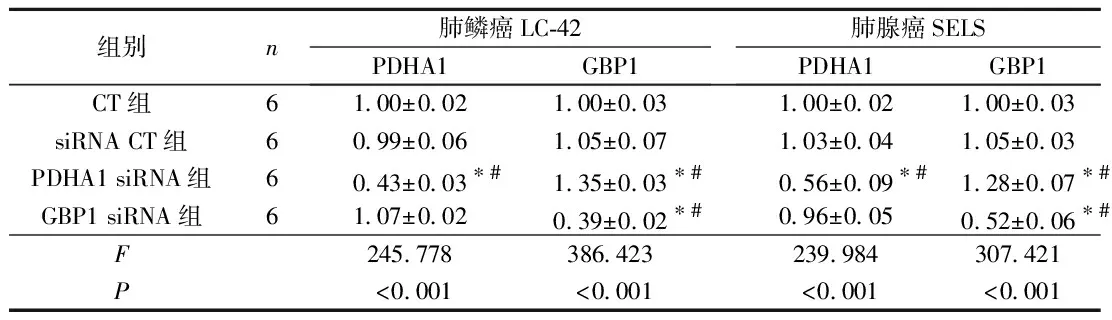
表2 各组PDHA1及GBP1 mRNA相对表达量比较
2.2各组PDHA1和GBP1蛋白表达的比较免疫细胞化学染色(表3)及Western blot检测(表4)结果表明,与CT组相比,PDHA1 siRNA组PDHA1蛋白表达水平下降,而GBP1蛋白表达水平增加;GBP1 siRNA组GBP1蛋白表达水平下降。
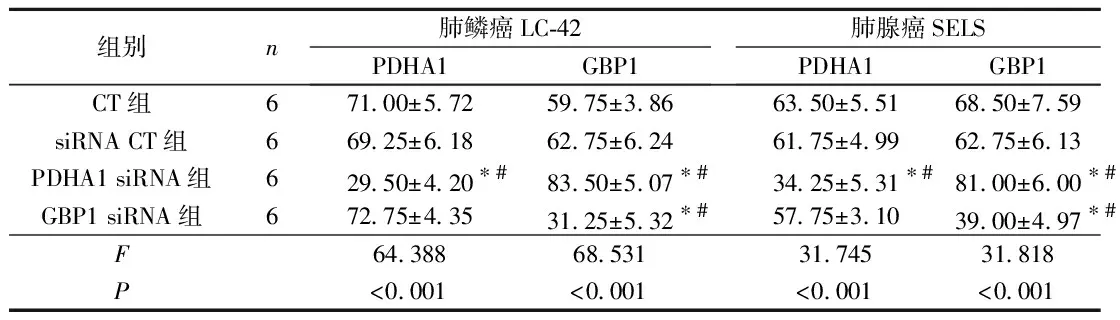
表3 各组PDHA1及GBP1蛋白阳性细胞百分比的比较 %
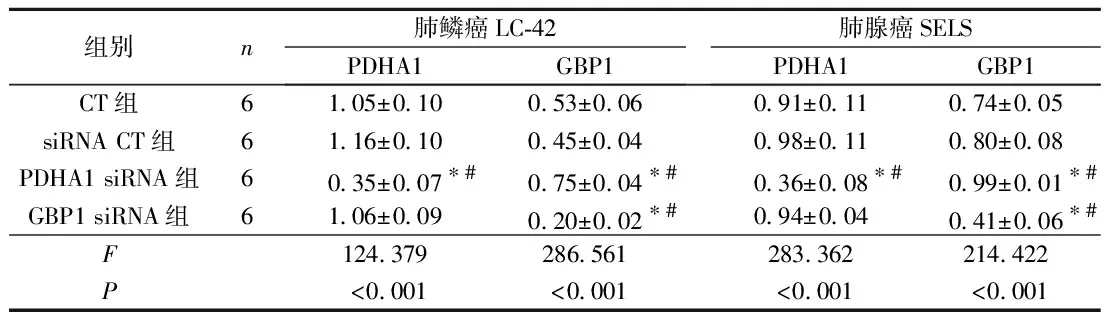
表4 各组PDHA1及GBP1蛋白相对表达量比较
3 讨论
本课题组前期研究[5]显示,在肺鳞癌及腺癌的临床病理组织标本中,PDHA1低表达及GBP1高表达显示出更具侵袭性的临床特征和较短的总体生存期,而且PDHA1及GBP1二者的表达存在负相关性,即PDHA1高表达伴随GBP1低表达。随即展开了PDHA1及GBP1相互关系的研究,应用瞬时转染方法分别沉默这两个基因,检测mRNA及蛋白表达。siRNA CT组与CT组比较,PDHA1和GBP1 mRNA表达水平无差异,据此判断siRNA对照试剂不会影响基因表达,目的基因siRNA实验结果可靠。和CT组相比,PDHA1 siRNA组肺鳞癌及腺癌细胞的PDHA1 mRNA表达水平明显降低,但是GBP1 mRNA表达水平升高;GBP1 siRNA组的GBP1 mRNA表达水平下降,而PDHA1 mRNA表达水平无
变化。免疫细胞化学染色及Western blot检测两个指标的蛋白表达水平,变化趋势与上述一致。由此可判断出PDHA1对GBP1的转录和蛋白表达起到一定下调作用,且是基于转录水平调节的。但是,GBP1基因却不影响PDHA1基因表达。
人体正常细胞通过线粒体氧化磷酸化和糖酵解产生能量,而癌细胞的显著特征之一就是主要以有氧糖酵解为主,称为Warburg效应[6]。PDHA1是Warburg效应的守门员,PDHA1表达及活性下降,则Warburg效应增强,肿瘤细胞快速分裂,更具有侵袭性[7]。
有研究[8]表明,在头颈部鳞癌中GBP1高表达与总生存期缩短相关。胶质瘤细胞中,GBP1高表达促进细胞增殖和迁徙[9]。本课题组[10-11]近年来始终围绕PDHA1及GBP1这两个基因和肿瘤的关系进行研究,建立了PDHA1敲除的前列腺癌细胞系及食管鳞癌细胞系,证明了PDHA1基因敲除能促进肿瘤细胞的糖酵解,增加肿瘤细胞增殖、迁移能力和对化疗的抵抗。而且,通过抗癌药物长期诱导而使PDHA1敲除的肿瘤细胞GBP1表达提高,说明GBP1升高可能和癌细胞耐受缺氧及化疗等极端环境有关。而GBP1基因敲除可以降低前列腺癌细胞的侵袭性、线粒体的氧化磷酸化及糖酵解水平[12]。今后,可用基因重组技术继续深入研究非小细胞肺癌中两种基因调控机制,寻找肿瘤治疗的新靶点。