miR-499-5p靶向调控钙通道电压依赖性β1蛋白在慢性心房颤动、心房重构中的作用研究
2021-04-21李世樱杨玲英张栋梅
李世樱,杨玲英 ,张栋梅,刘 勇
(1.简阳市人民医院超声科,四川 简阳 641400; 2.昆明医科大学附属心血管病医院,云南 昆明 650000)
心房颤动(Atrial fibrillation,AF)是多种因素造成的心房结构的改变,进而以快速无序的颤动波代替整齐有序的电传导致使心律失常的一种心血管疾病,简称房颤[1]。研究[2]表明房颤导致的心房电活动紊乱,促使患者出现血栓、心力衰竭、心房变性、外周血管栓塞、心动过速性心肌病,甚至缺血性脑卒中等严重危及生命的并发症。目前房颤的发病机制尚未完全阐明,现有的治疗手段和药物不能使所有患者受益。因此寻找预防和控制房颤的手段,开展个体化的靶向治疗,在临床上具有重大意义。小分子RNA(microRNA,miRNA)是一类具有调控功能的内源性非编码单链RNA。研究[3]表明,多种miRNA如miR-1、miR-133等因能调控心脏离子通道、钙离子结合蛋白、转运蛋白等相关基因的表达与心房颤动直接相关。近来miR-499-5p在心房颤动患者的表达异常引起关注。崔淯夏等[4]研究表明房颤患者在射频术后外周血中miR-499-5p的表达明显降低,推断miR-499-5p可能成为房颤诊断与治疗的靶点,但是就miR-499-5p对房颤影响的机制报道较少。L型钙通道是细胞进行钙离子交换的主要途径。研究[5]显示L型钙通道的异常直接导致心脏钙平衡受损,进而使心房结构发生改变,诱发心房电重构。钙通道电压依赖性β1蛋白(Calcium channel voltage-dependent β1protein,CACNβ1)是L型钙通道蛋白的β亚基。Kumfu等[6]报道提高CACNβ1的表达能明显改善地中海缺血小鼠的心血管障碍,阻止心房有效不应期(Atrial effective refractory period,AERP)的缩短,抑制心房结构的重构。本研究通过建立心房颤动的动物模型,从心房电重构的角度探讨miR-499-5p和 CACNβ1在房颤中的作用,希望为房颤的临床治疗提供一个新的靶向位点。
1 材料和方法
1.1 实验材料
1.1.1 实验动物:60只新西兰雄性大白兔,体重2.5~3.2 kg,由我院实验动物中心从四川大学实验动物中心采购,动物的使用许可证号:SYXK(川)2018-185。
1.1.2 主要试剂:rAAV9-miR-499-5p-inhibitors、阴性对照rAAV9-miR-499-5p-inhibitors-NC由上海吉玛生物有限公司设计完成。异氟烷、多聚甲醛采购自Sigma公司;HE试剂盒、JC-1试剂盒购自联科生物技术公司;苏木精-伊红染色(Hematoxylin-eosinstaining,HE)试剂盒购自南京建成生物技术公司;兔抗GAPDH、山羊抗兔IgG采购自美国abcam公司;Western blot试剂盒购自德国Rebstock公司。
1.1.3 主要仪器:Step One Plus荧光定量PCR仪,美国ABI公司产品; Nikon Eclipse Ti-SR荧光显微镜,日本尼康公司产品;Bio-rad凝胶成像系统,美国Bio-rad公司产品;TECNAI G2 20电镜,美国TWIN FEI公司产品。
1.2 实验方法
1.2.1 模型构建和分组处理:将新西兰大白兔用随机数字表法随机分成四组(n=15):假手术组(sham组)、模型组、miR-499-5p-inhibitors-NC组(对照组)和miR-499-5p-inhibitors组(实验组)。模型组、对照组、实验组参照文献方法[7],将实验兔以仰卧位固定在手术台上,常规备皮,沿第3、4肋间,备皮,开胸,逐层剥离,暴露心脏,采用结扎左心耳的方法,将动物心脏起搏器(起搏电压5 V,起搏频次600次/min)以及电生理刺激仪测试电极(保证电极导线与心房肌接触良好)固定在左心房上,引出电极,关胸,缝合伤口。用庆大霉素冲洗起搏器囊袋,并固定在动物背部脊柱旁。将起搏器和起搏电极连接固定,测试电极置于皮下,以测电生理指标。术后所有动物静脉滴注青霉素抗感染。sham组开胸后只是固定心房电极,不起搏。模型组、对照组、实验组心房持续起搏3周后(每日对实验动物进行心电图检测,以确保起搏器正常工作),常规喂养一周。术前48 h,对照组和实验组分别以30 mg/kg剂量心脏冠脉注射[8]rAAV9-miR-499-5p-inhibitors-NC和rAAV9-miR-499-5p-inhibitors,另外两组大白兔心脏冠脉注射等剂量的PBS缓冲液。实验过程中,sham组无死亡,模型组动物术中因气胸导致纵膈摆动死亡2只,对照组动物在复查心电图中,发现一只因起搏阈值过高未能诱发房颤,实验组1只术中死亡,2只因起搏器电极脱位未能诱发房颤,因此每组动物均以10只纳入实验观察。
1.2.2 心脏超声检査各组大白兔心脏结构和功能的变化:将实验动物以异氟烷腹腔注射麻醉,固定于手术台,心脏彩超检查心脏功能。记录左心房最大容积(Left atrial maximal volume,LAVmax),左心房最小容积(Left atrial minimal volume,LAVmin),左心房射血分数(Left atrial ejection fraction,LAEF),左心房内径(Left atrial diameter,LAD)等数据[9]。
1.2.3 各组实验大白兔电生理指标AERP和房颤诱发率的测定:实验兔起搏3周后的AERP以S1S2程序递减刺激法,输出电压的一半为起搏阈值通过电生理刺激仪进行测定150 ms基础周长时的AERP150,设置S1S2间隔递减扫描(S1S2=10∶1,步长=10 ms),重复测定3次。以40 ms 周长Brust刺激心房10 s,以2.5倍阈值起搏,房颤持续时间大于1 s为成功诱发房颤,每只实验动物诱发4次,间隔时长30 s,成功诱发房颤的动物只数与Brust刺激动物总只数的比值即为房颤诱发率[10]。
1.2.4 各组大白兔心肌组织病理学以及超微结构观察:测试完毕,处死动物,剥离心脏,取出10%心肌组织,常规固定,室温下,HE染色,上荧光显微镜进行观察。取出10%心肌组织,制成厚度约为2 mm的切片,TECNAI G2 20电镜下观察实验动物心肌细胞超微结构的改变。将余下动物的心脏组织转入深冷冰箱中待测。
1.2.5 JC-1染色法检测各组大白兔的心肌细胞线粒体膜电位的变化:从冰箱中分别取出各组动物10%的心肌组织,均浆,裂解,按线粒体提取试剂盒要求提取线粒体,JC-1工作液染色后,封片,镜检,Image-Pro Plus 6.0软件分析图像,以红色荧光与绿色荧光的比值来评定各组大白兔心脏组织线粒体膜电位变化。
1.2.6 qRT-PCR检测miR-499-5p和靶向钙通道电压依赖性β1蛋白(CACNβ1)的mRNA的表达:从冰箱中取出各组动物10%的心肌组织,采用常规方法提取心脏标本中组织细胞的总RNA,PCR仪测定目标序列的表达量。目的基因[11]miR-499-5p(上游引物为5’- GACAACATACTGCTAACCGACTC-3’,下游引物为5’- TCACTCTTCACCTGCTCCACTG-3’),CACNβ1的mRNA(上游引物为 5’- TCTACGCAGTGCTTCTTTGCC-3’,下游引物为 5’- AAGGGGGATCTTCAGCTTTAGTA-3’)。
1.2.7 Western blot检测各组大白兔心肌组织中CACNβ1蛋白的表达:从冰箱中取出各组动物10%的心肌组织,按照常规提取目标蛋白,裂解匀浆器后离心,测定浓度。电泳,转膜,封闭2 h,加入一抗(均为1∶1000),4 ℃孵育,过夜。次日,洗涤,加入二抗稀释液(均为1∶10000),显色,以GAPDH作为内参来表达目的蛋白的相对表达。
1.2.8 荧光素酶报告基因分析:以miR-499-5p mimic和mimic control转染人胚胎肾细胞(HEK293)细胞,待细胞培养24 h后,洗涤细胞,用含有目的蛋白CACNβ1的3’-非翻译区(3’-untranslated region,UTR)或突变重组(pGL3-CACNβ1-MUT)载体以及Renilla标准化对照pGL3再次转染,通过荧光素酶检测试剂盒(Dual-Glo luciferase assay system)检测在48 h后测量细胞的荧光强度,对应荧光素酶活性数值为求出萤火虫荧光素酶/海肾荧光素酶数据比值的平均数。
1.3 统计学方法 数据采用SPSS 16.0统计学软件进行,作图工具采用Graphpad 5.01软件,两两组间比较采用t检验,P<0.05表示差异具有统计学意义。
2 结 果
2.1 实验动物的心电图监测结果以及电生理参数比较 各组大白兔心电图监测如图1所示,与sham组相比,模型组的AERP150明显降低(P<0.05),与模型组相比,抑制miR-499-5p的表达后,实验组的AERP150明显升高(P<0.05)。模型组与对照组相比,差异不具有统计意义(P>0.05)。
sham组大白兔为窦性心律,经burst刺激未能诱发心房房颤,模型组以及对照组大白兔经burst刺激后成功诱发房颤(持续时间不短于30 min)房颤诱发率明显升高(P<0.05),与模型组相比,实验组的房颤诱发率明显下降(P<0.05)。模型组与对照组相比,差异不具有统计意义(P>0.05)。

A:sham组;B:模型组;C:对照组;D:实验组。与sham组相比,*P<0.05;与模型组相比,#P<0.05
2.2 心脏彩超检测各组大白兔的心功能变化 心脏彩超结果如图2所示,与sham组相比,模型组左心房的LAD,LAVmax,LAVmin明显升高(P<0.05),与模型组相比,实验组动物的LAD、LAVmax、LAVmin明显降低(P<0.05)。模型组与对照组相比,差异不具有统计学意义(P>0.05)。
2.3 实验大白兔的心脏损伤病理以及心肌细胞的超微结构观察 HE染色结果如图3所示,sham组心肌纤维呈带状分布,细胞结构完整,胞核性状规则的定位于肌纤维中央,间质无水肿情况,细胞连接紧密;模型组、对照组动物心肌纤维排列紊乱,心肌横纹消失,核质界限不清,核膜破裂,间质水肿明显;与模型组心肌纤维的排列相比,实验组明显规整,肌纤维变性较轻,间质水肿明显缓解。超微结构结果如图4所示:sham组心肌细胞结构完整,排列整齐,性状规整,核膜完整,胞核性状规整,胞质内线粒体以及肌浆网数量丰富,线粒体嵴结构清晰可辨,无肿胀,无异常;与sham组相比,模型组、对照组动物心肌纤维溶解明显,胞核明显扩张,变形明显,线粒体出现空泡样变性,嵴结构不规则,或融合、或缺失、或重叠严重,胞膜凹陷明显;实验组动物的心肌线粒体损伤明显缓解,嵴结构损伤程度较模型组明显减轻,心肌纤维排列较为规则,病变程度明显得到缓解。

A:sham组;B:模型组;C:对照组;D:实验组。与sham组相比,*P<0.05;与模型组相比,#P<0.05
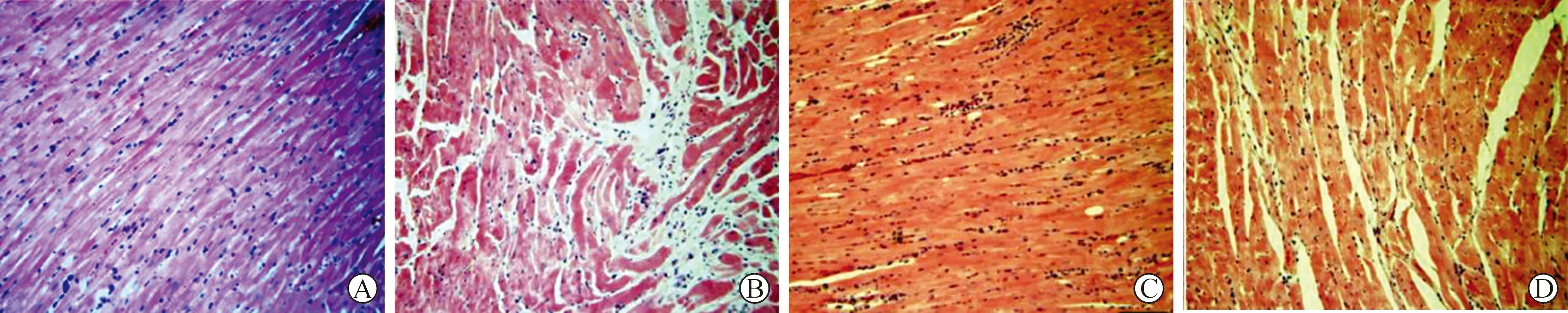
A:sham组;B:模型组;C:对照组;D:实验组
2.4 JC-1染色法检测各组大白兔的心肌细胞线粒体膜电位的变化 各组大白兔心肌线粒体膜电位的检测结果如图5所示,与sham组相比,模型组动物心肌细胞红色荧光与绿色荧光的比值明显降低,说明线粒体膜电位明显降低(P<0.05);与模型组相比,实验组大白兔心肌细胞红色荧光与绿色荧光的比值明显升高,说明线粒体膜电位明显升高(P<0.05)。模型组与对照组相比,差异不具有统计意义(P>0.05)。
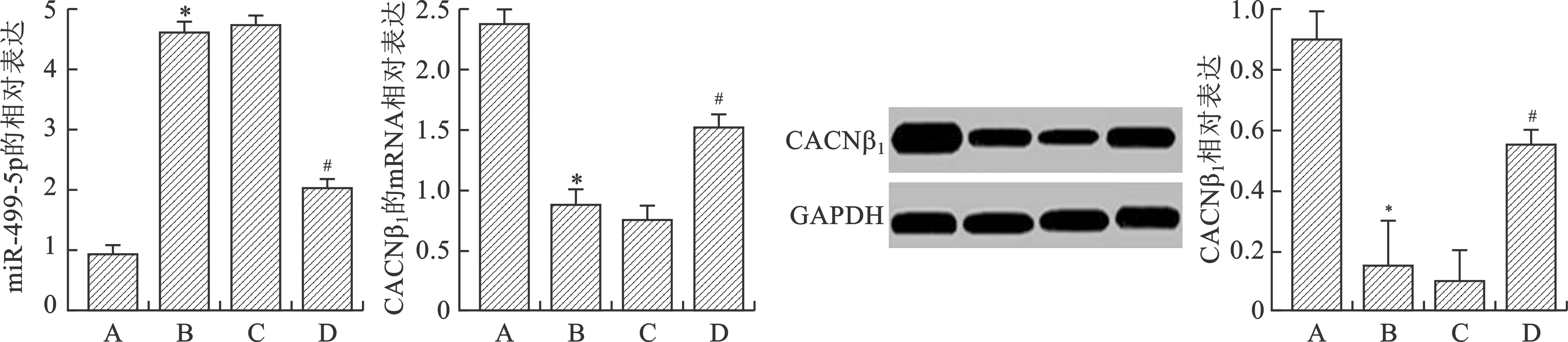
2.5 各组大白兔心肌中miR-499-5p和CACNβ1的mRNA和蛋白的表达情况 各组大白兔心肌中的miR-499-5p和CACNβ1的mRNA和蛋白的表达结果如图6所示,与正常组相比,模型组miR-499-5p的表达明显升高,CACNβ1的mRNA和蛋白的表达明显降低(P<0.05);和模型组相比,实验组和对照组miR-499-5p的表达明显降低,CACNβ1的mRNA和蛋白的表达明显升高(P<0.05)。实验组和对照组比较,蛋白表达差异无统计学意义(P>0.05)。
2.6 荧光素酶报告基因分析结果 miR-499-5p和CACNβ1的蛋白和mRNA的变化趋势具有明显的关联性,通过生物信息网站(www.microrna.org)上查询miR-499-5p和CACNβ1存在特异性结合位点。采用双荧光素酶报告基因分析来观察两者的关系结果如图7示,转染miR-499-5p后,野生型CACNβ1的荧光素酶活性被抑制(P<0.05),突变型CACNβ1的荧光素酶活性无明显变化(P>0.05),说明 miR-499-5p能靶向调控CACNβ1的表达。

A:sham组;B:模型组;C:对照组;D:实验组。与sham组相比,*P<0.05;与模型组相比,#P<0.05
A:sham组;B:模型组;C:对照组;D:实验组。与sham组相比,*P<0.05;与模型组相比,#P<0.05

图7 miR-499-5p靶向调控CACNβ1的表达
3 讨 论
目前随着人口老龄化的进程,发病率以及致残率逐年升高的房颤,成为威胁公众健康的重要疾病。随着将导管射频消融术的出现,房颤的治疗技术有了较为明显的提高,但是其费用昂贵、操作要求严格以及设备的限制,难以使所有的患者获益[12]。房颤的分子生物学机制,阐明其发展历程,寻求房颤治疗的新方案,改善患者的心脏功能,仍是临床医师面临的重大挑战。
最新的研究显示[13]心房重构主要是由病理损伤或者负荷改变导致的心脏大小、形状、组织以及功能等随之改变,是心房修复、继发以及代偿性疾病的生理病理进程。研究表明心房重构是心房颤动的基础病理改变。越来越多的实验证实[14]了miRNA直接参与心房重构的病理学进程。Lan等[15]研究表明作为内源性的调控基因,miR-101通过调控心肌细胞的离子通道蛋白的合成,干预跨膜离子流,影响心肌细胞的触发活性,进而影响心房的电重构;Yun等[16]研究证实miR-34a能影响胶原纤维的积聚,调控胶原蛋白的表达,影响心房的结构重构。miR-499-5p与心血管疾病的关系引起广泛关注。Xin等[17]研究表明作为肌球蛋白Myh7b基因家族中成员,miR-499-5p在急性心肌梗死患者的外周血中高表达,过表达的miR-499-5p影响钠离子通道蛋白的表达,诱发了心房电重构。Silva等[18]研究报道在心肌缺血再灌注损伤大白兔模型中抑制miR-499-5p的表达,能增强心肌细胞中线粒体膜的稳定性,改善动物在损伤中的心脏重构。本研究中冠脉注射rAAV9-miR-499-5p-inhibitors后,实验组动物的AERP150明显升高,房颤诱发率明显下降,动物的心房电重构明显受限。病理学以及超微结构观察结果显示,实验组动物的心肌损伤以及线粒体损伤明显缓解,线粒体膜电位有所恢复,证实抑制miR-499-5p的表达后,慢性房颤实验兔的心房重构有所改善。
L型钙通道是控制钙离子进出心肌细胞的电压依赖性的通道。该通道与心肌细胞的物质与能量代谢中的生理活动密切相关[19]。王增夏等[20]报道作为L型钙通道的关键结构成分,CACNβ1能够调控心肌细胞的L-钙电流,直接影响房颤进程。高杰等[21]通过表达谱芯片技术以及miRNA芯片分析显示与健康成人相比,CACNβ1基因在永久性房颤患者的左房组织中的表达明显降低。Ling等[22]研究证明CACNβ1和miR-499在对慢性房颤的中具有潜在的临床诊断价值。本研究从生物信息网站获知miR-499-5p和CACNβ1之间存在特异性结合位点,双荧光素酶报告基因分析结果显示miR-499-5p能靶向调控CACNβ1的表达,并且抑制miR-499-5p的表达后实验组动物心肌中CACNβ1的表达明显升高。
综上所述,miR-499-5p在慢性心房颤动动物模型动物中表达升高,抑制其表达能明显改善动物的心脏功能,抑制其心房重构,这可能与靶向调控CACNβ1的表达有关。但是如何将miR-499-5p的靶向作用应用到房颤的临床治疗中还需更深入的研究。
