白蚁菌圃中产纤维素酶菌株的鉴定与酶活研究
2021-04-20韦张其王洁慧刘国庆
韦张其 王洁慧 刘国庆
摘要 [目的]提高生物质秸秆降解速度,能够更加充分地利用微生物资源。[方法]以黑翅土白蚁菌圃为菌源,采用平板稀释法初筛分离得到降解纤维素的目标菌株,再复筛得到最优菌株FUN-ce4,然后对其进行ITS序列分析鉴定以及酶稳定性研究。[结果]菌株FUN-4归属于栓孔菌属(Trametes)。经对酶活性研究,菌株FUN-4在温度为60 ℃、pH为4、发酵时间为6 d时酶活相对较高;而温度为40 ℃、最适pH为5时酶活相对较稳定。[结论]白蚁菌圃中存在活性较高的纤维素降解菌株,可以成为高活性木质纤维素降解酶的重要来源。
关键词 白蚁菌圃;纖维素酶;分离;鉴定;酶活
Abstract [Objective]To improve the degradation rate of biomass straw and make full use of microbial resources.[Method]The target strains degrading cellulose from termite combsare was isolated by plate dilution method,and then the optimal strain FN-4 was rescreened from the target strains,and ITS sequence analysis was conducted combining with the research of the enzymatic activity.[Result]The strain FN-4 was identified as Trametes.The enzymatic activity research experiment showed that the enzymatic activity of strain FUN-4 was relatively high when the temperature was 60 ℃,the pH was 4,and the fermentation time was 6 days.When the temperature was 40 ℃ and the pH was 5,the enzyme activity was relatively stable.[Conclusion]There are high activity cellulose degrading strains in termites fungus gardens,which can be an important source of high activity lignocellulosic degrading enzymes.
Key words Termite combsare;Cellulase;Screening;Identification;Enzymatic activity
白蚁生物系统显示了高效生物转化木质纤维素的能力[1]。白蚁之所以能食木是因为它能靠其体内的微生物群将木材中纤维素和半纤维素消化成能够被机体吸收的物质[2]。在白蚁的蚁巢中存在“菌圃”这一特殊的结构,其主要组成成分是未被完全消化的植物,白蚁和菌圃真菌之间较好的协同作用能够高效利用木质纤维素[3]。
目前,关于白蚁共生微生物降解木质纤维素研究主要集中在白蚁肠道菌功能,并分离出其中的产酶基因进行基因组分析[4-8],而关于菌圃真菌降解纤维素的研究较少。该研究以黑翅土白蚁菌圃为研究对象,筛选出高产纤维素酶真菌并研究其纤维素酶活性及稳定性,从而发掘具有应用价值的纤维素降解真菌。
1 材料与方法
1.1 材料
1.1.1 供试菌株。黑翅土白蚁及其菌圃,购于江西省白蚁活体实验室。
1.1.2 培养基。
①羧甲基纤维素-刚果红培养基:CMC-Na 2.0 g,(NH4)2SO4 2.0 g,MgSO4·7H2O 0.5 g,K2HPO4 1.0 g,NaCl 0.5 g,刚果红 0.4 g,琼脂 20.0 g,蒸馏水1 000 mL,pH自然。②PDA培养基:200 g马铃薯,葡萄糖2 g,琼脂2 g。③发酵产酶培养基:秸秆粉 5.0 g,蛋白胨 2.0 g,KH2PO4 2.0 g,FeSO4·7H2O 0.4 g,NaCl 0.5 g,蒸馏水1 000 mL,pH自然。各培养基按配方配制后,加热搅匀,分装至锥形瓶中,加塞、包扎,121 ℃灭菌20 min左右后取出锥形瓶摇匀,冷却后贮存备用。
1.1.3 主要试剂及设备。
试剂:刚果红染色液、氯化钠脱色液、柠檬酸-磷酸氢二钠缓冲液、DNS试剂等。
主要设备:分析天平、高速离心机、立式压力蒸汽灭菌锅、紫外可见光分光光度计、电热恒温培养箱等。
1.2 方法
1.2.1 菌圃中降解纤维素的菌株筛选。
取0.5 g菌圃碾碎,放入50 mL无菌离心管中,加入适量无菌水,于8 000 r/min的转速下离心15 min。取 1 mL 静置后的上清液分别稀释至10-1、10-2、10-3、10-4和10-5倍,涂抹至羧甲基纤维素-刚果红培养基平板上,30 ℃培养7 d。选取生长良好且透明水解圈较大的菌株接种于PDA培养基上28 ℃培养5 d,至在每个平板上都可看到单一形态的菌落。选取单菌落打孔接种于羧甲基纤维素培养基中,30 ℃培养3 d后,量取1 mg/mL的刚果红染液15 mL染色15 min,用1 mol/L NaCl溶液脱色后,根据透明圈的大小,选出酶活最大的菌株(暂命名为FUN-4)进行分子鉴定和酶活性分析。
1.2.2 菌圃中降解纤维素的菌株鉴定。
1.2.2.1 形体观察。
将纯化菌株用黏片法,粘取菌丝于载玻片上,用显微镜和电镜观察其形态特征,鉴定参照文献[9-10]提供的方法进行。
1.2.2.2 ITS序列分析鉴定[11]。FUN-ce4菌株基因组DNA采用E.Z.N.A.Stool DNA Kit试剂盒提取。
PCR反应体系:PhusionHot Start Flex 2× Master Mixart Version 12.5 μL、Forward Primer(1 μmol/L)2.5 μL、Reverse Primer(1 μmol/L)2.5 μL、模板DNA 50 μL、加ddH2O 25 μL。
PCR反应程序:预变性98 ℃ 30 s;变性98 ℃10 s,退火54 ℃ 30 s,延伸72 ℃ 45 s,35个循环;最后延伸72 ℃ 10 min;保持4 ℃。
PCR扩增产物通过2%琼脂糖凝胶电泳进行检测,并对目标片段进行回收,回收采用AMPure XT beads回收试剂盒。将PCR产物送至杭州联川生物测序。将测序结果提交GenBank数据库进行Blast,从GenBank数据库中搜索相关菌株的ITS相应序列,采用MEGA 5.0邻接法建进化树,进行分离菌株菌种的鉴定。
1.2.3 菌株纤维素酶活研究。
1.2.3.1 粗酶液的制备。
将FUN-4菌株接种于液体PDA培养基中,30 ℃摇床180 r/min培养3 d。按10%接种量接入装有100 mL发酵产酶培养基的250 mL三角瓶中,30 ℃摇床180 r/min培养。分别在2、3、4、5、6、7 d取粗酶液测定纤维素酶活。纤维素酶是一组酶的总称,是一种复合酶,主要由外切β-葡聚糖酶、内切β-葡聚糖酶和β-葡萄糖苷酶等組成[12-13],因此纤维素酶活分别由微晶纤维素酶活、羧甲基纤维素酶活和滤纸条酶活反映。
1.2.3.2 纤维素酶活的测定。
(1)羧甲基纤维素酶活力[14]。取100 μL 粗酶液加入1% CMC溶液(溶于pH为4.5的柠檬酸-磷酸氢二钠缓冲液),50 ℃条件下反应30 min(以100 ℃条件下反应30 min的酶液作为灭活对照组),然后加入1 mL DNS试剂充分摇匀并沸水煮5 min,冷水冷却后在OD540下测定吸光度。
(2)滤纸酶活力[15]。取500 μL粗酶液加入1 500 μL缓冲液和1 cm×6 cm的滤纸(需卷成),在恒温水浴锅中预热5 min,50 ℃条件下反应60 min(以100 ℃条件下反应60 min的酶液作为灭活对照组),然后加入2 mL DNS试剂充分摇匀并沸水煮5 min,冷水冷却后在OD540下测定吸光度。
(3)微晶纤维素酶(Avicel)活力。取100 μL粗酶液加入400 μL缓冲液和1%微晶纤维素在恒温水浴锅中预热5 min,50 ℃条件下反应60 min(以100 ℃条件下反应60 min的酶液作为灭活对照组),然后加入1 mL DNS试剂,充分摇匀并沸水煮5 min,冷水冷却后在OD540下测定吸光度。
酶活力单位定义[16]:50 ℃恒温条件下,以水解反应中1 min 催化底物水解形成1 μmol还原糖的酶量为1个酶活单位(U)。
1.2.4 FUN-ce4菌株产纤维素酶稳定性研究。
在不同pH缓冲液体系和不同温度下测定酶活力和残余活力,分析其对酶促反应和酶稳定性的影响,以达到最佳产酶条件。
2 结果与分析
2.1 菌圃中降解纤维素的菌株筛选
2.1.1 纯化。
从5个梯度的羧甲基纤维素-刚果红培养基中选取6个生长良好且具有较大透明圈的菌株进行纯化,得到4株菌株,分别暂命名为FUN-1、FUN-2、FUN-3、FUN-4(图1)。
观察到这些菌落均生长较快且菌落较大,质地疏松,呈棉絮状和绒毛状,不透明,颜色有纯白、乳白、黄色、绿色。菌落与培养基连接比较紧密,不易挑取。
2.1.2 复筛。
挑取纯化后的菌株单菌落接种于羧甲基纤维素培养基,经刚果红染液染色后NaCl溶液脱色,得到FUN-1、FUN-2、FUN-3、FUN-4各菌株的刚果红水解圈(图2)。
测量各菌株的菌落直径和透明圈直径,比较菌株活性(表1)。通过分离纯化筛选最终得到酶活较强的菌种FUN-ce4,并进行分子学鉴定和酶稳定性分析。
2.2 菌种的分类鉴定
2.2.1 菌株形态鉴定。镜检图中可以看到有比较粗壮的菌丝,许多偏透明的孢子,长长的分生孢子梗头部有一个顶囊(图3),菌落形态和镜检结果可以初步确定为霉菌。
2.2.2 ITS分子鉴定。
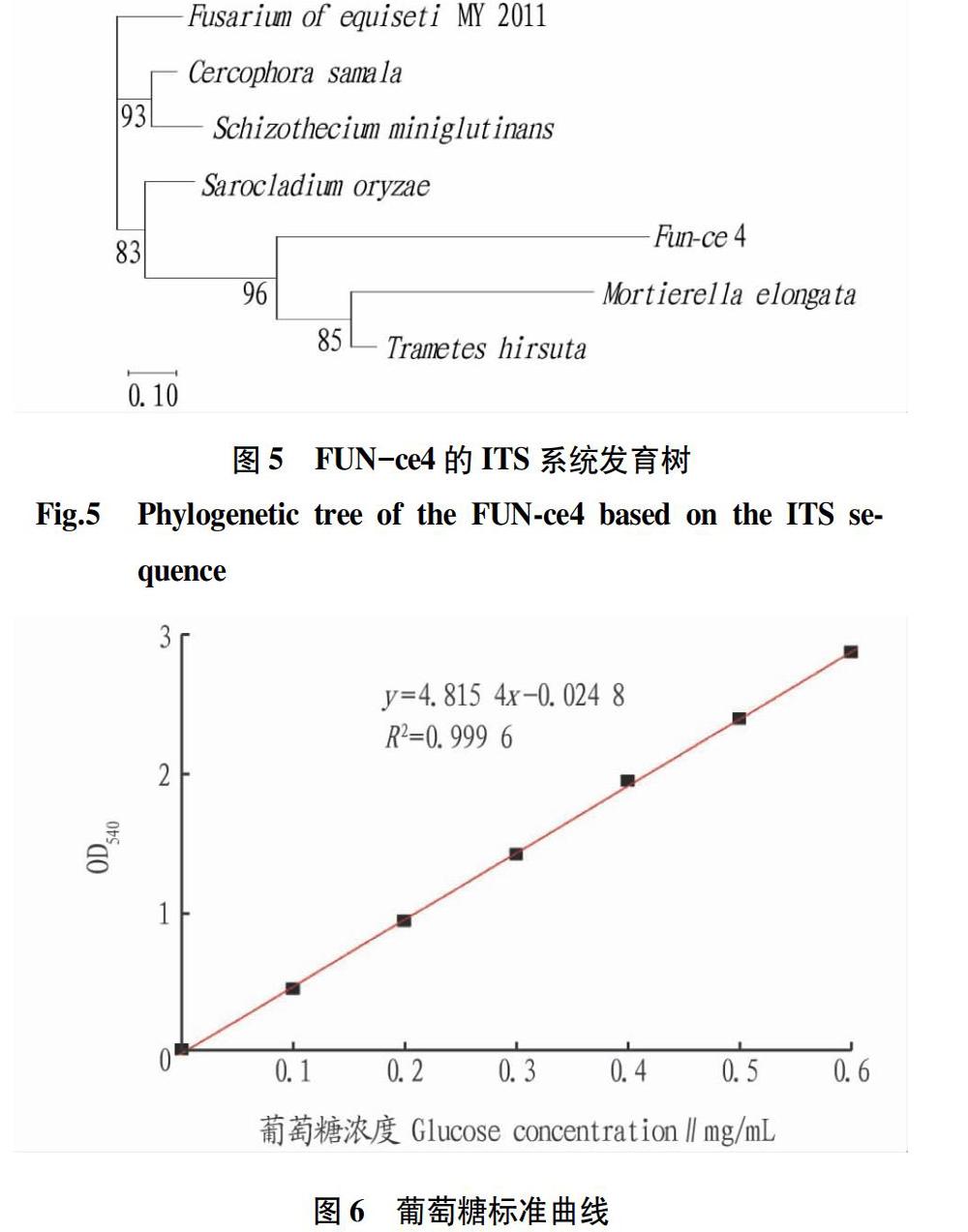
将扩增后的ITS进行凝胶电泳检测。由图4可知,序列2为所挑选菌株目的条带片段。由PCR扩增得到的目的片段长度约353 bp。在GenBank的Blast中对该序列进行同源性比较(图5),结果显示FUN-4菌株ITS基因序列与毛栓菌(Trametes hirsuta)同源性为96%,初步鉴定为栓菌属。
2.3 菌株纤维素酶活的测定及纤维素酶稳定性研究
2.3.1 葡萄糖标准曲线制作。
该葡萄糖标准曲线的R2=0.999 6,拟合程度较好,得到的回归方程为y=4.815 4x-0.024 8(图6)。可用该方程计算对应的葡萄糖含量,代入方程中计算酶活。
2.3.2 发酵时间对酶活力的影响。
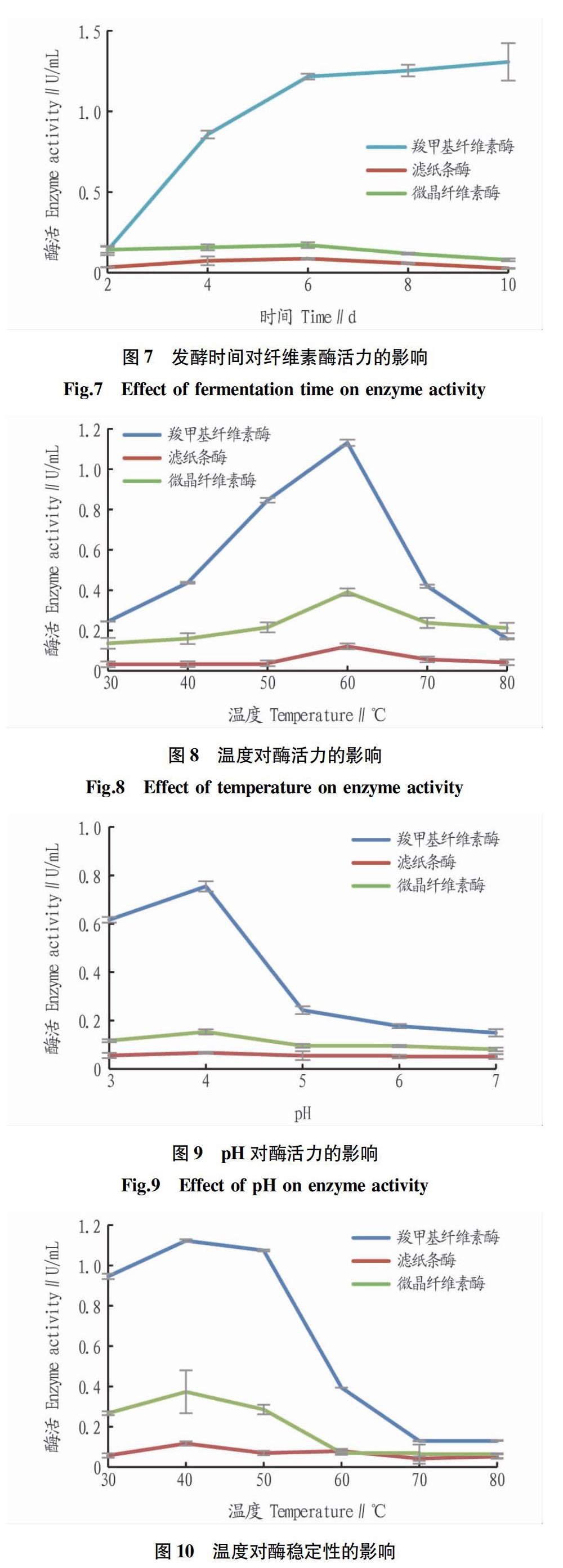
羧甲基纤维素酶活随着时间延长逐渐增大,但在第6天之后酶活升高不明显(图7),考虑到时间成本,选择第6天为最优发酵时间;滤纸条酶活和微晶纤维素酶活较低,两者相差较小,且在第6天达到最大值,可能是由于羧甲基纤维素酶抑制了两者的活性。因此,选择第6天为发酵时长。
2.3.3 温度和pH对酶活力的影响。羧甲基纤维素酶、滤纸条酶、微晶纤维素酶的酶活均在60 ℃时达到峰值,分别为1.020、0.094和0.246 U/mL。在30~50 ℃,滤纸条酶几乎不显示活性,80 ℃时微晶纤维素酶活有超过羧甲基纤维素酶活的趋势(图8)。羧甲基纤维素酶、滤纸条酶、微晶纤维素酶的酶活随缓冲液pH升高均先增大后减小,在pH为4时达到最高值,分别为0.755、0.067、0.153 U/mL,但滤纸条酶活随缓冲液pH升高变化不明显(图9)。
2.3.4 温度和pH对酶活稳定性的影响。
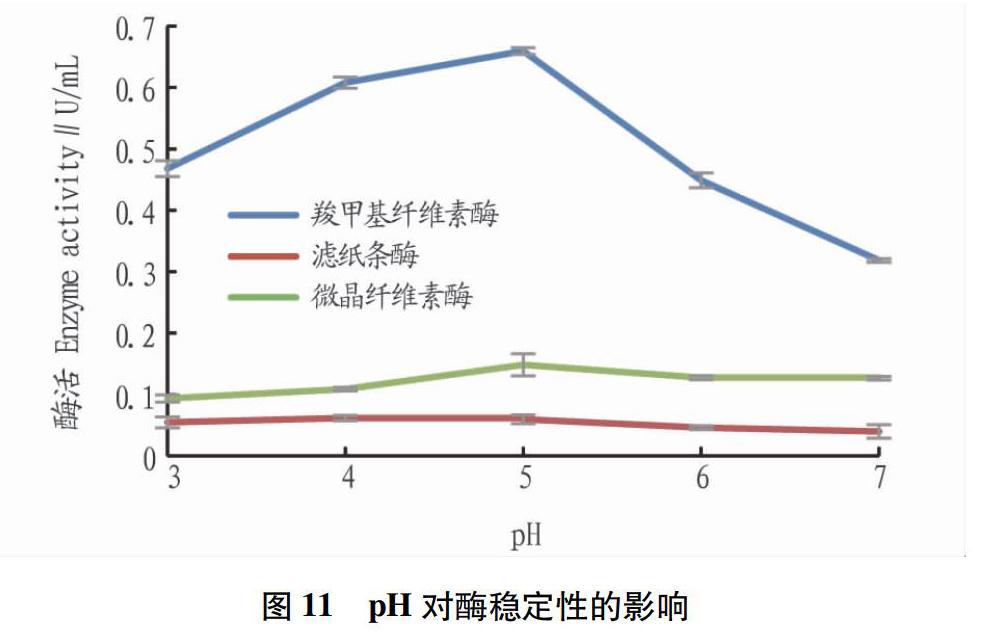
从图10可见,保存在较低温度下的酶稳定性较好,在40 ℃时酶活最稳定,羧甲基纤维素酶、滤纸条酶、微晶纤维素酶的酶活分别为1.123、0.117、0.373 U/mL,相对酶活力分别为93.89%、96.38%和95.64%。羧甲基纤维素酶稳定性随温度升高变化最大,超过50 ℃后酶活骤降。滤纸条酶活较低,但稳定性好。从图11可见,羧甲基纤维素酶、滤纸条酶、微晶纤维素酶的酶活pH为5时酶活最稳定,分别为0.660、0.060、0.148 U/mL,相对酶活力分别为87.4%、86.4%、96.7%。羧甲基纤维素酶对pH较为敏感,滤纸条酶活和微晶纤维素酶活均较低,但稳定性好,在不同pH缓冲液下保存酶活变化较小,pH为3~7时均能保持60%以上活性。
3 小结
该研究以白蚁菌圃为菌源,相比主流研究将菌源聚集在土壤、白蚁肠道、腐爛木材等更具有创新性。试验从菌圃中提取筛选出1株高产纤维素酶真菌,为后续白蚁菌圃混合菌群分离纯化提供参考。通过分子学初步鉴定其高产纤维素酶菌株为栓孔菌属,栓孔菌属隶属于担子菌门、伞菌亚门、伞菌纲、多孔菌目、多孔菌科,属于白腐菌的一大类,担子门白腐真菌近年来作为产漆酶的重要优质菌源而被广泛研究[17-20],从而为生物降解提供了重要途径与方法。后续可对所产纤维素酶的酶活及稳定性进行初步探索,以期为其开发利用提供理论依据。
参考文献
[1]
谢蓉蓉,孙建中,耿阿蕾,等.自然生物系统在生物质高效转化利用中的科学价值与应用前景[J].生物产业技术,2015(2):32-40.
[2]李栋,田伟金,黎明,等.谈谈白蚁与人类的密切关系[J].昆虫知识,2004,41(5):487-494.
[3]龙雁华.高等培菌白蚁高效利用木质纤维素的机理研究[D].合肥:安徽农业大学,2009.
[4]WARNECKE F,LUGINBHL P,IVANOVA N,et al.Metagenomic and functional analysis of hindgut microbiota of a wood-feeding higher termite[J].Nature,2007,450(7169):560-565.
[5]NIMCHUA T,THONGARAM T,UENGWETWANIT T,et al.Metagenomic analysis of novel lignocellulose-degrading enzymes from higher termite guts inhabiting microbes[J].J Microbiol Biotechnol,2012,22(4):462-469.
[6]LIU N,YAN X,ZHANG M L,et al.Microbiome of fungus-growing termites:A new reservoir for lignocellulase genes[J].Applied and environmental microbiology,2011,77(1):48-56.
[7]LIU N,ZHANG L,ZHOU H K,et al.Metagenomic insights into metabolic capacities of the gut microbiota in a fungus-cultivating termite (Odontotermes yunnanensis)[J].PLoS One,2013,8(7):1-10.
[8]POULSEN M,HU H F,LI C,et al.Complementary symbiont contributions to plant decomposition in a fungus-farming termite[J].Proceedings of the national academy of sciences,2014,111(40):14500-14505.
[9]戴芳澜.真菌的形态和分类[M].北京:科学出版社,1987.
[10]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
