表皮生长因子受体抑制剂相关皮疹动物模型的构建
2021-04-14薛崇祥张静怡谭可欣姜雪娇郑舒月董慧静俞仪萱胡紫馨崔慧娟
张 旭,薛崇祥,李 嘉,张静怡,谭可欣,姜雪娇,郑舒月,董慧静,俞仪萱,胡紫馨,崔慧娟
1北京中医药大学,北京100029;2中日友好医院//国家呼吸医学中心中西医结合肿瘤内科,北京100029
表皮生长因子受体抑制剂(EGFRIs)目前已成为EGFR突变阳性晚期肺腺癌[1]和KRAS野生型晚期结直肠癌[2]首选治疗方式。在提高临床获益的同时,EGFRIs也会引起较为明显的皮肤不良反应,其中以皮疹最为常见和高发[3-4],且已成为影响肿瘤患者生活质量的最重要因素[5]。关于靶向药相关皮疹的发生机制,大量研究都证实其与炎症反应有很大相关性[6-7]。
目前,已报道的EGFRIs相关皮疹动物模型建立方法复杂多样,主要有基因敲除[8-9]以及应用药物干预[10-14]等不同的方式;但目前的造模方式仍存在着一些问题,如基因敲除小鼠存活率低、寿命短[15-16]、造价高、周期长等不利于进行大规模实验。而在药物干预的造模方式中,应用厄洛替尼[11,13]建造的小鼠模型在皮肤表型等方面与临床实际有较大差别,可靠性和可复制性不高;Surguladze[10]建立的小鼠模型虽然在各方面的表现与虽临床极其相似,但该研究中应用的ME1为该实验室自制,外界尚不能购得,且尚未有研究者对此进行复制,故该模型的可靠性需进行进一步探讨。此外,万亮琴[12,14]虽然应用吉非替建立了动物模型,其在皮肤表型、病理、血清学表现方面与临床高度相似,但该研究尚未与吉非替尼药物过敏导致皮疹的可能性进行鉴别,故仍需进行进一步探索。
为了对既往文献报道的模型进行进一步优化,研究者在考虑到实验可行性、实验周期和经济性等方面,对潜在的动物模型进行了复制和探索,以期为日后研究提供更加完善和可靠的实验数据。
1 材料和方法
1.1 实验一
1.1.1 实验动物 雌性SCID小鼠,5周龄,体质量20~30 g,购于北京维通利华实验动物技术有限公司。饲养环境为中日友好医院临床研究所SPF动物房(SYXK(京)2016-0043)。该研究经中日友好医院临床医学研究所医学实验动物平台伦理委员会批准(伦理批号190112)。
1.1.2 药品 西妥昔单抗注射液(爱必妥),每瓶100 mg/20 mL,购于德国默克公司,储存于4 ℃恒温冰箱。使用时将西妥昔单抗配制成5、2.5、1.25 mg/mL溶液,分别按照80、40、20 mg/kg进行腹腔注射,现配现用。
1.1.3 主要仪器 BX51 正置光学显微镜(Olympus)、CRM440 切 片 机(Sakura)、TISSUE-TEK 脱 水 机(Sakura)、TISSUE-TEK 包埋机(Sakura)、台式高速冷冻离心机(湖南赫西仪器装备有限公司)。
1.1.4 分组及处理 将小鼠随机分为空白组、西妥昔单抗高剂量组、西妥昔单抗中剂量组、西妥昔单抗低剂量组、生理盐水组,空白组2只,其余各组每组4只,其中空白组不干预,西妥昔单抗组分别予以80、40、20 mg/kg剂量腹腔注射,生理盐水组予以等体积生理盐水注射,给药频次为每周一、三、五,共干预28 d。实验过程中持续观察小鼠皮肤形态表现。实验结束后麻醉小鼠,取心尖部血液0.5 mL,放入肝素抗凝管中保存待测。处死小鼠后将小鼠背部皮肤用备皮刀清理毛发,取适当大小的背部皮肤1块,面积约1 cm×1 cm,放入福尔马林溶液中保存待检测。
1.1.5 监测指标 每日观察小鼠皮肤形态学变化以及小鼠皮肤进行苏木素-伊红染色观察。
1.2 实验二
1.2.1 实验动物 雌性棕色挪威大鼠(Brown Norway,BN大鼠),10周龄,体质量140~160 g,购于北京维通利华实验动物技术有限公司。饲养环境为中日友好医院临床研究所SPF动物房(SYXK(京)2016-0043)。该研究经中日友好医院临床医学研究所医学实验动物平台伦理委员会批准(伦理批号为190113)。
1.2.2 药品 卵清蛋白:购于Solarbio,40 g/瓶。使用时将卵清蛋白溶于超纯水中,配制成1 mg/mL溶液,按照1 mg/只予大鼠灌胃,频次为1次/d。储存于4 ℃恒温冰箱中保存。吉非替尼片:商品名易瑞沙,购于阿斯利康投资(中国)有限公司。使用时将吉非替尼片研成细末,溶于超纯水中,配制成7.5 mg/mL的吉非替尼溶液,按照0.5 mL/100 g予大鼠灌胃。储存于4 ℃恒温冰箱中保存。厄洛替尼片:商品名特罗凯,购于上海罗氏制药有限公司。使用时将厄洛替尼片研成细末,溶于超纯水中,配制成4.7 mg/mL的溶液,按照0.5 mL/100 g予大鼠灌胃。储存于4 ℃的恒温冰箱中保存。
1.2.3 主要试剂 大鼠IgE抗体ELISA试剂盒(abcam)、大鼠TNF-α ELISA试剂盒(RayBio)、大鼠IL-6ELISA试剂盒(RayBio)。
1.2.4 分组及处理 将BN大鼠随机分为空白组、吉非替尼组、厄洛替尼组、卵清蛋白组,空白组不干预,3只/组,其余各组分别按照37.5 mg/kg、23.5 mg/kg、1 mg/只相应药物予大鼠灌胃,频次为1次/d,共干预45 d。实验过程中持续观察大鼠皮肤形态学表现。实验结束后麻醉大鼠,取心尖部血液约5 mL,放入肝素抗凝管中保存待测。处死后将大鼠皮肤用备皮刀清理备皮,取适当大小的背部皮肤1块,面积约2 cm×2 cm,用于制作石蜡切片;行苏木素-伊红染色,显微镜下观察。
1.2.5 监测指标 每日观察大鼠皮肤形态学变化并拍照保存。取大鼠血清,应用ELISA法检测血清中TNF-α、IL-6、IgE因子的水平。
1.3 统计学方法
采用SPSS 20数据统计软件进行数据统计分析。数据中计量资料以均数±标准差表示。若样本代表的总体资料均服从正态分布或近似正态分布,两组样本进行比较时运用t检验进行分析;单一组别前后比较运用配对t检验。组间比较时,若两组数据均方差齐,则应用两独立样本t检验,若方差不齐则应用校正t检验。多样本均数的比较采用方差分析。数据不符合正态分布则运用非参数检验。P<0.05为差异有统计学意义。
2 结果
2.1 实验一
2.1.1 小鼠形态学表现 在应用西妥昔单抗腹腔注射干预4周后,西妥昔单抗注射液组小鼠背部皮肤无明显的皮疹、结痂、脱屑等皮肤毒性表现;实验组背部皮肤表现与空白对照组无明显差异(图1)。
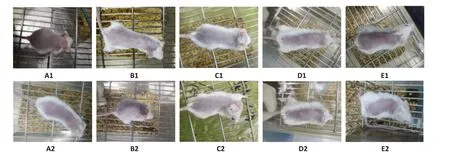
图1 各组小鼠在实验前后的皮肤表现Fig.1 Cutaneous manifestations of the mice before(A1-E1)and after 4 weeks of treatment(A2-E2). A1/A2:Control group.B1/B2:Highdose cetuximab group.C1/C2:Medium-dose cetuximab group.D1/D2:Low-dose cetuximab group.E1/E2:Saline group.
2.1.2 小鼠皮肤HE染色表现 本实验中,应用西妥昔单抗注射液干预SCID小鼠4周后,实验组小鼠背部皮肤HE染色无明显的中性粒细胞浸润、毛囊炎症等表现;另一方面,西妥昔单抗注射液组小鼠的表皮较空白组相比也没有明显的增厚表现(图2)。
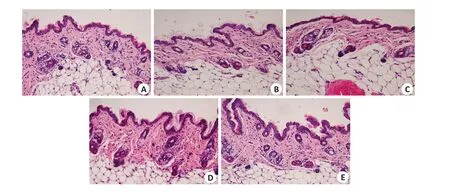
图2 用药4周后小鼠背部皮肤HE染色Fig.2 HE staining of dorsal skin tissue of the mice after 4 weeks of treatment(Original magnification: ×100).A: Control group. B: High-dose cetuximab group. C: Medium-dose cetuximab group. D: Low-dose cetuximab group.E:saline group.
2.2 实验二
2.2.1 大鼠皮肤形态学变化 从图3中可见空白对照组在用药前后皮肤表现无明显变化;卵清蛋白组在用药前后的皮肤表现无明显差别;吉非替尼组大鼠在用药后出现里明显的皮疹、结痂表现;厄洛替尼组大鼠在用药前后皮肤表现无明显差别。
2.2.2 皮肤HE染色表现 从图4中可见,空白组、卵清蛋白组、厄洛替尼组大鼠皮肤病理切片未见明显的炎症细胞聚集、棘层松解、角化不全等表现;而吉非替尼组大鼠皮肤切片可观察到大量炎症细胞聚集、角化不全等表现,并可看到皮疹部位皮肤表皮明显增厚。
2.2.3 血清学炎症因子水平 在IgE、TNF-α浓度方面,各组间均未见明显差异(P=0.061,P=0.057);而在IL-6方面,吉非替尼组较空白组明显升高,差异具有统计学意义(P=0.016),而厄洛替尼组较空白组未见明显差异(P=0.910,表1)。
3 讨论
由上述实验我们可以得出,在应用西妥昔单抗注射液腹腔注射后,SCID 小鼠皮肤未出现典型的皮疹表现。通过吉非替尼灌胃的方式,可以复制较为可靠的表皮生长因子受体抑制剂相关皮疹动物模型,其在皮肤大体表现、病理学表现、血清学指标的变化等方面与文献报道高度相符,且可初步排除过敏的可能性。此外,若应用厄洛替尼,则并不能在BN大鼠中成功建立动物模型。
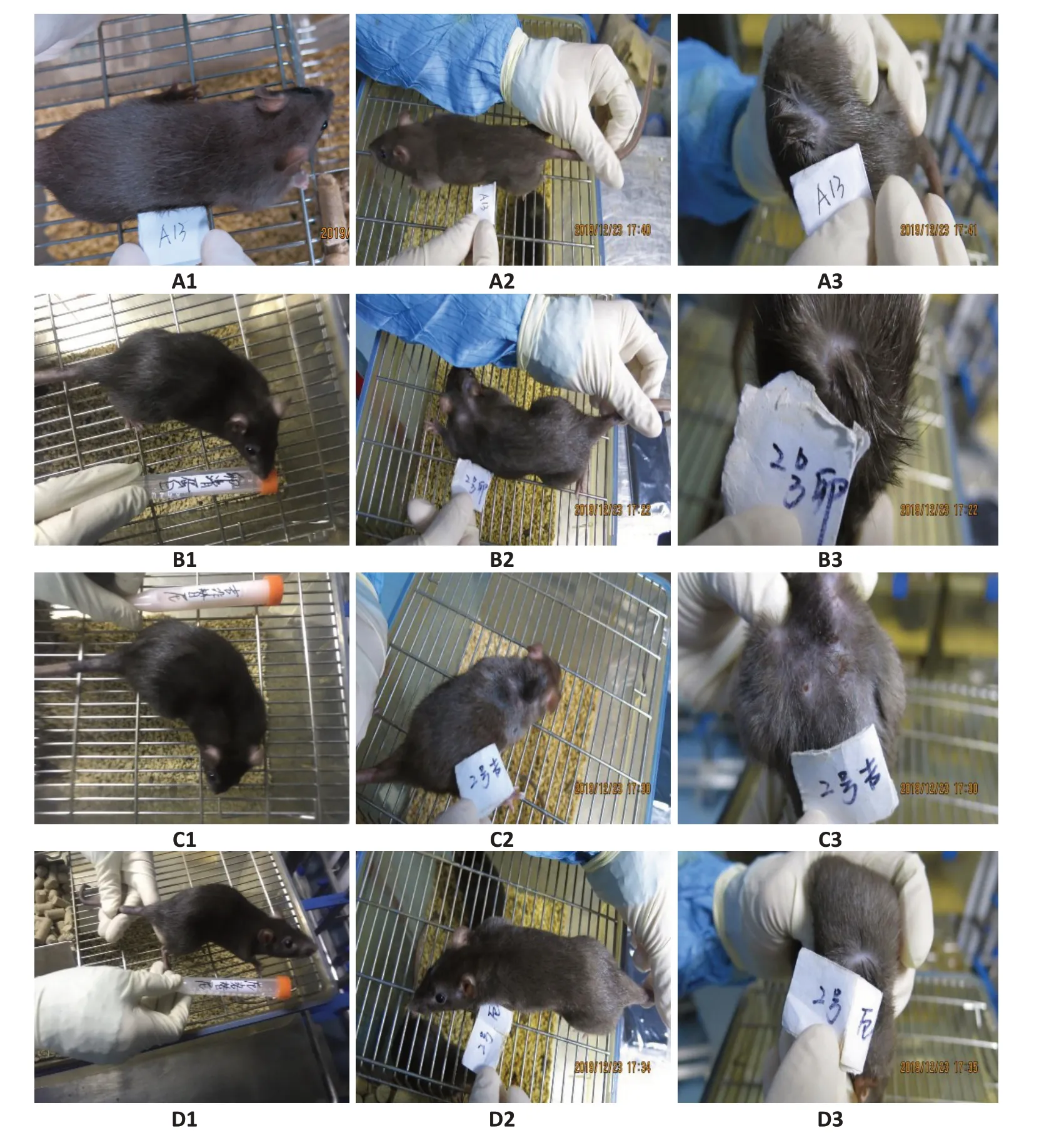
图3 用药前后大鼠背部皮肤表现Fig.3 Skin changes of the rats before (A1-D1) and after the 45-day treatment (A2-D2).A1-A3: Control group.B1-B3:Ovalbumin group.C1-C3:Gefitinib group.D1-D3:Erlotinib group.
文献中ME1为大鼠表皮生长因子受体单克隆抗体,能够与小鼠表皮生长因子受体特异性结合,阻断其信号转导通路,从而发挥与表皮生长因子受体抑制剂相似的作用[10];但由于此单抗为该实验室自制,获取困难,故本研究尚不能再次应用此单抗进行实验。西妥昔单抗注射液属于单抗类表皮生长因子受体抑制剂,在作用机制上与ME1类似,且皮疹等皮肤不良反应的发生率高[17-19],故实验一中我们选择应用西妥昔单抗建立动物模型;同时也更可以说明模型的可复制性和可靠性。
良好的动物模型需在皮肤表型、病理表现和血清学变化等方面与临床高度一致,但本实验结果显示,在应用西妥昔单抗4周后,小鼠皮肤并未出现典型的皮疹,病理未见明确的炎症表现。故本研究虽未进行血清学因子的检测,仍可初步考虑该模型建造不成功。追究本研究失败原因,最有可能与西妥昔单抗注射液为人鼠嵌合性IgG单克隆抗体,只能特异性识别人体抗原,并与人的表皮生长因子受体结合[20],而无法与小鼠表皮生长因子受体结合有关。再者,故放弃该造模方式作为进一步研究的模型基础。

图4 各组大鼠背部皮肤组织HE染色Fig.4 HE staining of the dorsal skin of the rats in different groups(1:×100.2:×200.3:×400).A1-A3:Control group.B1-B3:Ovalbumin group.C1-C3:Gefitinib group.D1-D3:Erlotinib group).

表1 各组间IgE/TNF-α/IL-6浓度水平Tab.1 IgE,TNF-α and IL-6 concentration levels in the groups(Mean±SD,pg/mL)
实验二中,吉非替尼组大鼠在用药2周时均开始出现了皮肤脱屑现象,用药3周时开始出现背部皮疹、结痂、渗出等皮肤炎症表现;且随着用药时间的不断延长,皮疹等皮肤不良反应越发严重。本实验中大鼠在皮疹形态特征、出现时间等方面与临床及文献报道相符[21];在病理表现方面,吉非替尼组大鼠皮肤HE染色病理切片显示表皮中有大量中性粒细胞浸润、棘层松解、毛囊周围炎症等表现;在血清指标方面,IL-6等炎性因子指标较空白对照组明显升高,与文献相关报道类似[10];据此可初步判断该模型的成功建立。在本实验中,吉非替尼组大鼠皮疹发生率为100%,虽然与既往实验研究的报道相似[12],但较临床报道有明显提高[22]。通过文献回顾并结合临床实际,我们推测这可能与吉非替尼的致敏性有关。因此,为了与药物过敏进行鉴别,本研究选择应用卵清蛋白作为高致敏原对大鼠进行干预,并以IgE为重要指标进行了初步探索。根据上述实验二的结果,吉非替尼组大鼠在血清IgE水平方面较空白组无明显差异,故可初步排除药物过敏的可能。另一方面,BN大鼠为近交系大鼠,是评价药物过敏反应的良好的动物模型[23],其对各种刺激的敏感性和反应性更为强烈[24],也可能是导致皮疹发生率升高的原因之一。
厄洛替尼皮疹的发生率应较吉非替尼更高[25],但根据本研究结果和既往文献记载,应用厄洛替尼灌胃的方式不能在小鼠中建立EGFRIs皮疹动物模型[9]。其原因可能是诱导性EGFR抑制或缺失对于成年鼠毛囊的生长发育没有明显的影响所致[9]。也可能与小鼠的皮肤中缺乏角质形成细胞-血管生成素受体的过度表达有关[26]。因此在本研究中,厄洛替尼组并未表现出与吉非替尼组相似的临床表现。且在本研究中,通过病理切片我们也发现,厄洛替尼组大鼠皮肤HE染色并未显示出明显的炎症表现,与空白对照组无明显差别;血清学指标上较空白组也无明显差异。故综合文献和以上实验结果,我们初步判断,厄洛替尼灌胃建立皮疹动物模型并不成功,此模型可复制性和可信性不高。
因此,应用西妥昔单抗注射液、厄洛替尼并不能很好的建立皮疹动物模型,但运用吉非替尼可以在BN大鼠中建立较好的动物模型,大鼠皮肤可出现较为典型的皮疹表现,该模型的可靠性和可复制性较高。本研究尚未在小鼠或其他动物品系中运用吉非替尼进行模型的复制工作,故此模型能否扩大种群仍需进行进一步探索。