红鳍东方鲀幼鱼适宜投喂频率和投喂水平的研究
2021-04-13卫育良王建学徐后国梁萌青
卫育良 王建学 徐后国 梁萌青*
(1.中国水产科学研究院黄海水产研究所,青岛266071;2.青岛海洋科学与技术国家实验室,海洋渔业科学与食物产出过程功能实验,青岛266237)
红鳍东方鲀(Takifugurubripes)是主要的河鲀养殖品种之一,也是农业农村部和国家食药总局联合签发的2种有条件开放养殖的河鲀鱼之一[10]。由于受到自1990年起河鲀“禁食令”的影响,红鳍东方鲀相关营养学研究错过水产动物营养与饲料研究的快速发展阶段,研究基础非常薄弱,直接导致现阶段的养殖过度依赖鲜杂鱼而缺乏专用配合饲料[11]。针对这一现状,本团队从2017年至今围绕红鳍东方鲀营养生理与饲料研发开展了大量的研究工作[11-19],以期能填补红鳍东方鲀营养需求参数的空白。基于这一目的,本试验开展了红鳍东方鲀适宜投喂频率和投喂水平的研究。同时,考虑到红鳍东方鲀在养殖过程中存在严重的相互残食现象,而投喂频率和投喂水平对缓减鱼类养殖过程中的相互残食现象具有重要的作用[20],这进一步表明在红鳍东方鲀上开展适宜投饲频率和投喂水平研究的必要性。
1 材料与方法
1.1 试验设计
在本试验中,红鳍东方鲀投喂频率和投喂水平试验同时进行,其中投喂频率试验结合实际生产过程,设2(07:00、17:00)、3(07:00、12:00和17:00)和4次/d(07:00、12:00、17:00和21:00)共3个投喂频率,分别记为F2、F3和F4组。试验饲料选用商品料,购自青岛赛格林生物科技有限公司,其粗蛋白质含量为47.74%,粗脂肪含量为10.01%。投喂过程采用自由采食,表观饱食投喂(观察鱼的摄食情况,当超过80%的鱼没有摄食行为时,判定为达到表观饱食水平[12])。投喂水平试验也选用相同的商品饲料,投喂水平设为鱼体体重的2%、4%、6%、8%和10%共5个投喂水平,分别记为R2、R4、R6、R8和R10组,所有投喂水平均采用3次/d(07:00、12:00、17:00)的投喂频率。
1.2 试验鱼及养殖管理
养殖试验所用红鳍东方鲀幼鱼购自河北唐山海都水产食品有限公司,养殖试验在海阳市黄海水产有限公司进行,试验开始前,先进行28 d的转饵驯化,使红鳍东方鲀幼鱼从摄食鲜杂鱼转为配合饲料,然后进行剪牙处理,以减轻养殖试验过程中红鳍东方鲀之间可能的相互残食。转饵及剪牙结束后,继续暂养14 d,然后饥饿24 h,开始正式养殖试验。在投喂频率试验中,将270尾初始体重15 g左右的大小均匀、体格健壮且体表无明显伤痕的红鳍东方鲀随机放入9个养殖桶(0.7 m×0.7 m×0.4 m),每桶放30尾,每组3个重复,每个重复30尾鱼。在投喂水平试验中,将450尾初始体重15 g左右的大小均匀、体格健壮且体表无明显伤痕的红鳍东方鲀放入相同的15个养殖桶内,每桶放30尾,每组3个重复,每个重复30尾鱼。对试验中未摄食的饲料用虹吸法收集,烘干并称重,记录残饵重量。养殖试验周期为28 d,养殖期间采用自然光照,流水养殖,水温为18~22 ℃,盐度为30~31,pH为7.4~8.2,溶解氧含量为5~7 mg/L。
1.3 样品采集
试验结束前,按照正常投喂过程进行最后1次投喂,摄食结束后2 h,在流水状态下,从养殖桶进水口取水样,作为空白对照;从养殖桶出水口取水样,用于养殖水体的水质分析。同时,对所有红鳍东方鲀幼鱼进行24 h饥饿处理,然后对每桶鱼进行计数、称重,用于测定和计算鱼的相关生长指标。然后,每桶随机取2尾鱼,用肝素钠处理过的1 mL注射器于鱼的尾静脉处抽血,抽血后解剖后取肝脏,液氮速冻后,保存到-80 ℃冰箱中,用于相关酶活性分析。最后,每桶再随机取4尾未抽血的鱼,-20 ℃保存,用于鱼体成分分析。
1.4 指标测定
1.4.1 饲料及鱼体成分分析
饲料和鱼体的粗蛋白质、粗脂肪、粗灰分和水分含量采用AOAC[21]标准方法测定。取样后,饲料和全鱼样品放入105 ℃烘干至恒重,采用湿重法计算得到水分含量。粗蛋白质含量采用凯氏定氮仪测定(UDK142 automatic distillation unit,VELP,意大利)总氮含量,再乘以6.25计算得到粗蛋白质含量。粗脂肪含量采用索氏抽提法(Foss Tecator,Hoganas公司,瑞典)测定,抽提液为沸点30~60 ℃的石油醚。粗灰分含量采用先炭化后灰化的方法,灰化是在马弗炉中灼烧至恒重。
1.4.2 肝脏酶活性分析
准确称取肝脏组织样品,按照重量(g)∶体积(mL)=1∶9的比例稀释,在冰浴条件下匀浆,制成10%的组织匀浆液,然后离心,取上清液备测。测定试剂盒均购自南京建成生物工程研究所,按照说明书上的步骤用分光光度计(UV-5200型紫外分光光度计,上海元析仪器有限公司)或酶标仪(Infinite M200 luminometer,Tecan公司,瑞士)进行酶活性测定。胰蛋白酶活性检测采用胰蛋白酶测定试剂盒(紫外比色法,A080-2-2),用分光光度计在波长253 nm下测定吸光度值。糜蛋白酶活性检测采用糜蛋白酶测定试剂盒(A080-3-1),脂肪酶活性检测采用脂肪酶测定试剂盒(比色法,A054-1-1),肝脏淀粉酶活性检测采用α-淀粉酶测试盒(淀粉-碘比色法,C016-1-1),谷草转氨酶(AST)活性检测采用谷草转氨酶测试盒(C010-2-1),谷丙转氨酶(ALT)活性检测采用谷丙转氨酶测试盒(赖氏法,C009-2-1),均用酶标仪在相关酶对应波长下检测。
1.4.3 养殖水体中氨态氮和磷酸盐含量分析
养殖水体中氨态氮含量测定根据在弱碱性环境下,氨与苯酚和次氯酸盐反应生成靛酚蓝的原理,采用靛酚蓝分光光度法在640 nm波长处测定吸光度值;亚硝态氮含量测定根据酸性环境下,亚硝酸盐和磺胺会发生重氮化反应后,其产物与盐酸萘乙二胺耦合生成红色偶氮染料的原理,采用盐酸萘乙二胺分光光度法在543 nm波长处测定吸光度值;磷酸盐含量测定根据酸性环境下,磷酸盐与钼酸铵反应生成磷钼黄,再用抗坏血酸还原生成磷钼蓝的原理,采用磷钼蓝分光光度法在882 nm波长处测定吸光度值。
1.5 计算方法及统计分析
成活率(SR)、摄食率(FI)、特定生长率(SGR)、FER、肝体比(HSI)、脏体比(VSI)和肥满度(CF)的计算参考以下公式:
SR(%)=100×试验结束时每桶鱼数量/
试验开始时每桶鱼数量;
FI(%/d)=100×总干物质摄食量/[试验天数×
(初始体重+终末体重)/2];
SGR(%/d)=100×(ln终末体重-
ln初始体重)/试验天数;
FER=(终末体重-初始体重)/
摄入饲料干物质重;
HSI(%)=100×肝脏重/体重;
VSI(%)=100×内脏重/体重;
CF(g/cm3)=100×体重/体长3。
试验结果以平均值±标准误(mean±SE)表示,采用SPSS 20.0软件进行统计分析。统计分析前,先分别用SPSS 20.0上的Shapiro-Wilk和Levene’s检验进行正态分布检验和方差齐性检验,然后进行单因素方差分析(one-way ANOVA),当差异显著时,进行Tukey多重比较。P<0.05表示差异显著。
2 结 果
2.1 投喂频率和投喂水平对红鳍东方鲀幼鱼生长和饲料利用的影响
由表1可知,在投喂频率试验中,不同投喂频率对红鳍东方鲀幼鱼终末体重、SR、FI、SGR和FER均无显著影响(P>0.05)。
在投喂水平试验中,不同投喂水平显著影响红鳍东方鲀幼鱼的终末体重、FI、SGR和FER(P<0.05)。R2组终末体重显著低于R4、R8、R10组(P<0.05);R2组FI、SGR和FER显著低于其他各组(P<0.05),但其他各组之间无显著差异(P>0.05)。
2.2 投喂频率和投喂水平对红鳍东方鲀幼鱼形体指标的影响
由表2可知,在投喂频率试验中,不同投喂频率显著影响红鳍东方鲀幼鱼的HSI和VSI(P<0.05),对CF无显著影响(P>0.05)。F3组HSI和VSI显著高于F2组(P<0.05)。
在投喂水平试验中,不同投喂水平显著影响红鳍东方鲀幼鱼的HSI和VSI(P<0.05),对CF无显著影响(P>0.05)。R2组HSI显著低于其他各组(P<0.05)。R2组VSI最低,显著低于R8和R10组(P<0.05),但与R4和R6组无显著差异(P>0.05)。
2.3 投喂频率和投喂水平对红鳍东方鲀幼鱼体成分的影响
由表3可知,在投喂频率试验中,不同投喂频率对红鳍东方鲀幼鱼的粗蛋白质、粗脂肪、粗灰分和水分含量均无显著影响(P>0.05)。
在投喂水平试验中,不同投喂水平对红鳍东方鲀幼鱼的粗蛋白质、粗脂肪、粗灰分和水分含量均无显著影响(P>0.05)。
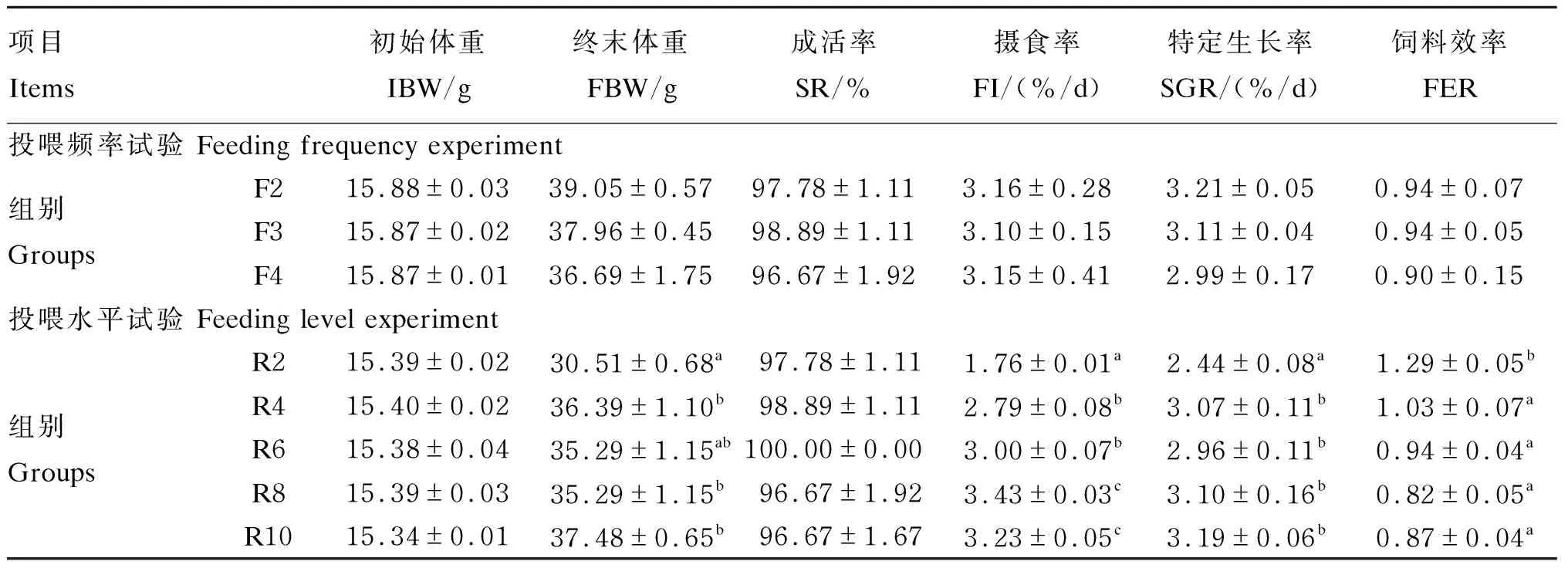
表1 投喂频率和投喂水平对红鳍东方鲀幼鱼生长和饲料利用的影响
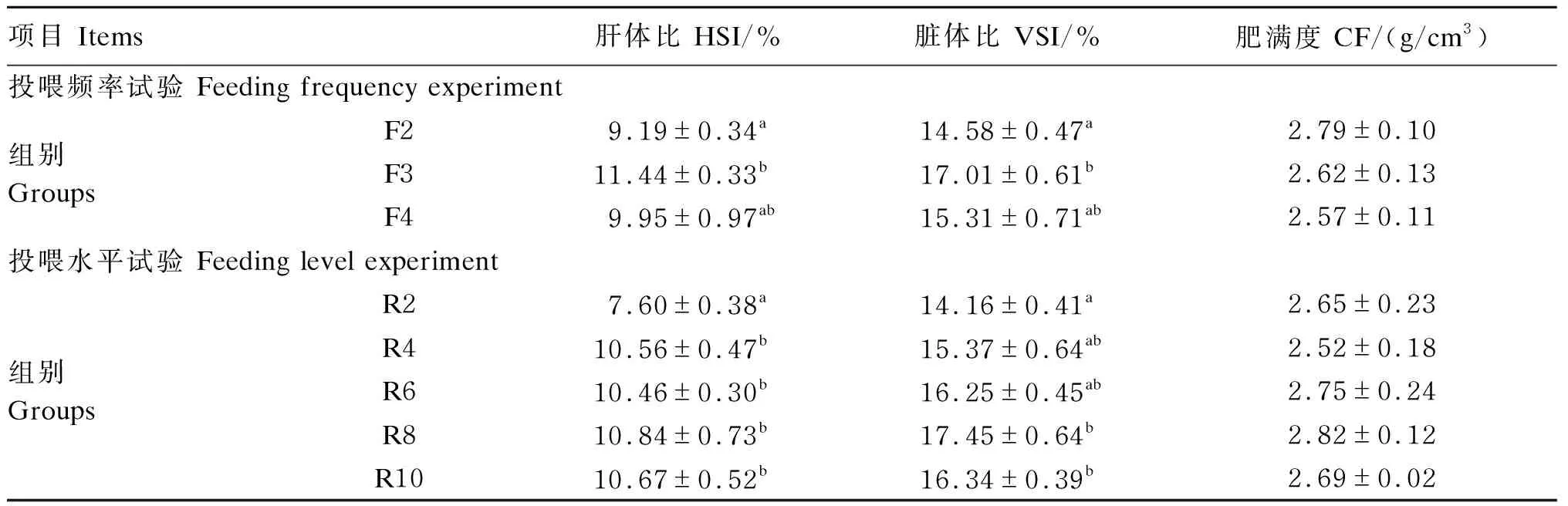
表2 投喂频率和投喂水平对红鳍东方鲀幼鱼形体指标的影响
2.4 投喂频率和投喂水平对红鳍东方鲀幼鱼肝脏消化酶活性的影响
由表4可知,在投喂频率试验中,不同投喂频率显著影响红鳍东方鲀幼鱼的肝脏胰蛋白酶和脂肪酶活性(P<0.05),对肝脏糜蛋白酶和淀粉酶活性无显著影响(P>0.05)。F3组肝脏胰蛋白酶和脂肪酶活性显著高于F2和F4组(P<0.05)。
在投喂水平试验中,不同投喂水平显著影响红鳍东方鲀幼鱼的肝脏胰蛋白酶、糜蛋白酶和脂肪酶活性(P<0.05),对肝脏淀粉酶活性无显著影响(P>0.05)。R2组肝脏胰蛋白酶活性最低,显著低于R4、R8和R10组(P<0.05);R2组肝脏糜蛋白酶活性最高,显著高于其他各组(P<0.05);R2组肝脏脂肪酶活性最低,显著低于R4组(P<0.05),但与R6、R8和R10组无显著差异(P>0.05)。
2.5 投喂频率和投喂水平对红鳍东方鲀幼鱼肝脏蛋白质代谢相关酶活性的影响
由表5可知,在投喂频率试验中,不同投喂频率显著影响红鳍东方鲀幼鱼的肝脏ALT活性(P<0.05),对肝脏AST活性无显著影响(P>0.05)。F3组肝脏ALT活性显著低于F2组(P<0.05)。
在投喂水平试验中,不同投喂水平显著影响红鳍东方鲀幼鱼的肝脏ALT活性(P<0.05),对肝脏AST活性无显著影响(P>0.05)。R2组肝脏ALT活性最低,显著低于R4和R10组(P<0.05),但与R6和R8组无显著差异(P>0.05)。
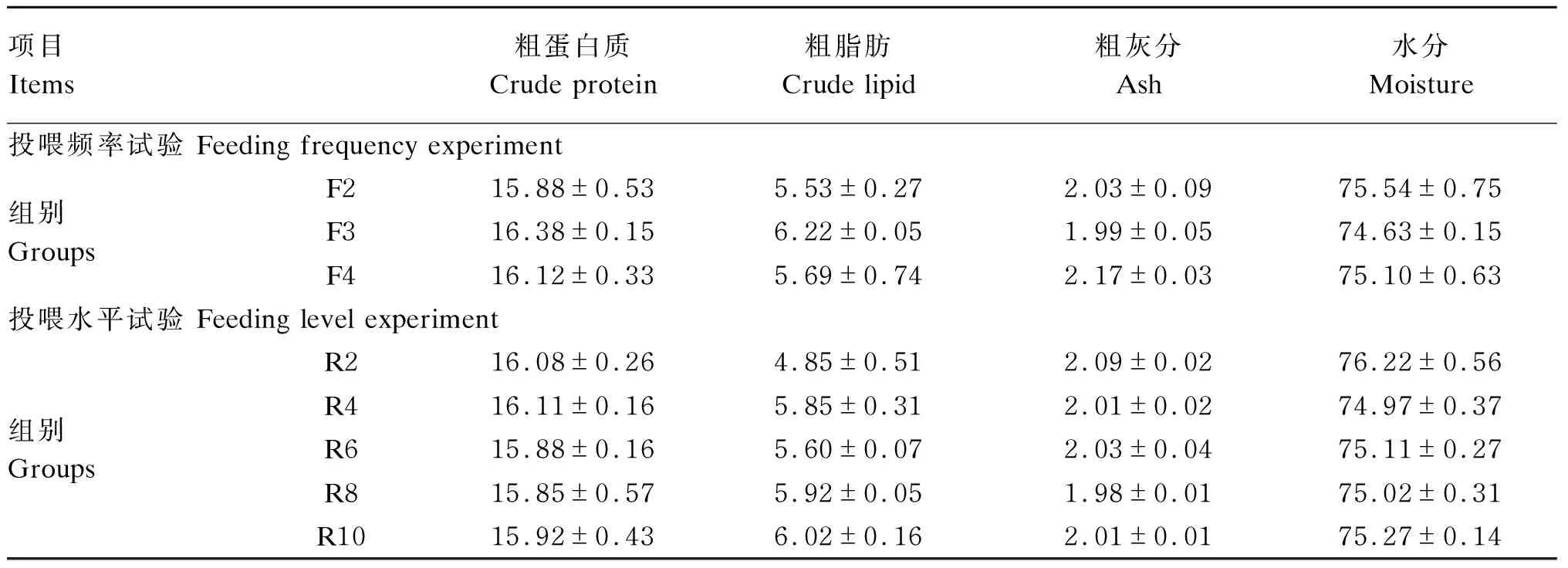
表3 投喂频率和投喂水平对红鳍东方鲀幼鱼体成分的影响(湿重基础)
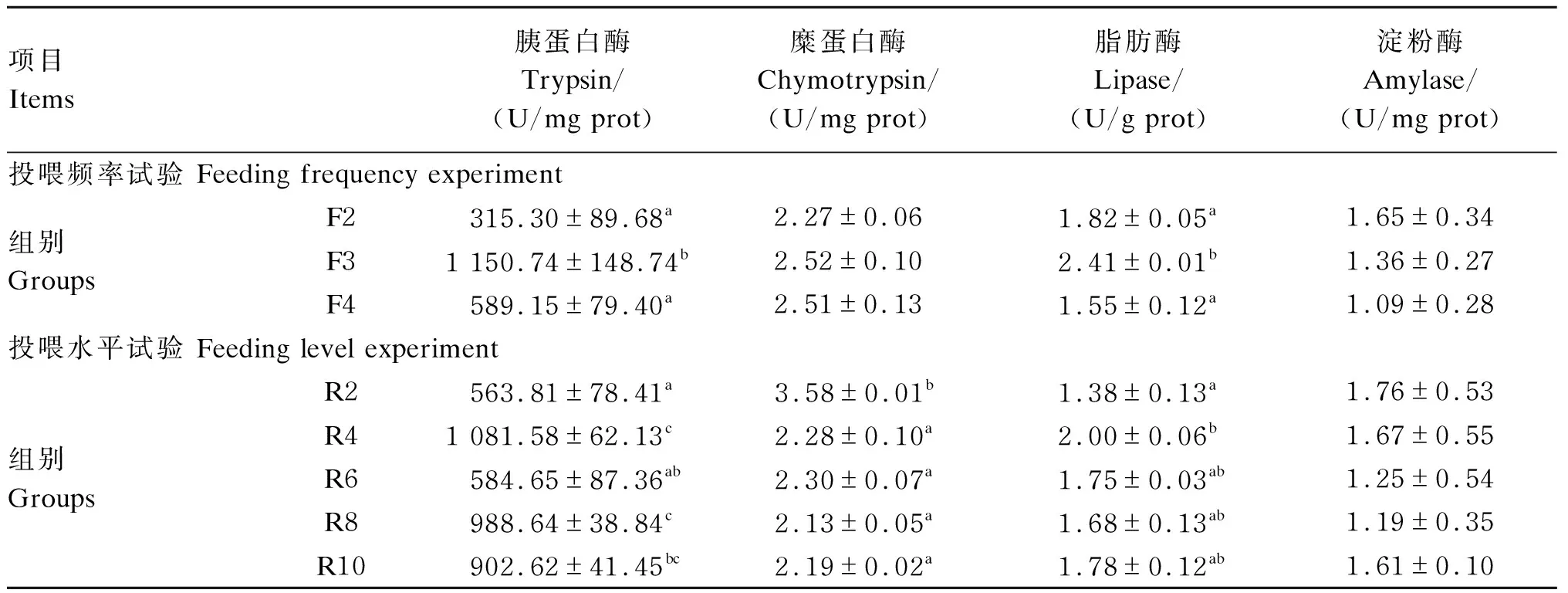
表4 投喂频率和投喂水平对红鳍东方鲀幼鱼肝脏消化酶活性的影响
2.6 投喂频率和投喂水平对红鳍东方鲀幼鱼养殖水质指标的影响
由表6可知,在投喂频率试验中,尽管各试验组养殖水桶出水口的氨态氮、亚硝态氮和磷酸盐含量相比进水口空白对照组均有所升高,但不同投喂频率对红鳍东方鲀幼鱼的养殖水质指标均无显著影响(P>0.05)。
在投喂水平试验中,与投喂频率试验的结果类似,尽管各试验组养殖水桶出水口的氨态氮、亚硝态氮和磷酸盐含量相比进水口空白对照组大部分有所升高,但不同投喂水平对红鳍东方鲀幼鱼的养殖水质指标均无显著影响(P>0.05)。
3 讨 论
3.1 投喂频率和投喂水平对红鳍东方鲀幼鱼生长和饲料利用的影响
自由采食和白天投喂是水产养殖实际生产中主要投喂策略,本研究结合实际养殖过程设3个投喂频率,结果发现终末体重、SR、SGR、FI和FER在不同投喂频率组之间均无显著差异,其原因可能主要有2个方面:第一,2次/d的投喂频率已满足红鳍东方鲀幼鱼生长的需要,因此,继续提高投喂频率,对生长无显著促进。类似的结果在多种鱼类上发现,如在大菱鲆上,Zheng等[1]报道,1次/d的投喂频率可满足大菱鲆的生长,继续提高至2和3次/d,均没有进一步提高大菱鲆的生长;在施氏厚唇丽鱼(Iodotropheussprengerae)上,Karadal等[2]从每2天1次到每天4次的投喂频率研究发现,施氏厚唇丽鱼在每天2次投喂即达到最适投喂频率。第二,可能受当时养殖场地及试验条件限制选择28 d较短的养殖周期有关。在之前一些投喂频率研究中,养殖周期会选择8周或者更长的时间[2-3,22-24],但养殖周期长短主要由鱼的生长速度决定,而红鳍东方鲀是生长速度较快的鱼类,在本试验中尽管只有28 d的养殖周期,但红鳍东方鲀的终末体重相比初始体重增加了131%~146%,且在同时进行的相同养殖周期投喂水平试验中,不同投喂水平显著影响了红鳍东方鲀幼鱼的终末体重、FI、SGR和FER,这表明尽管可能存在养殖周期较短影响投喂频率试验中生长结果在不同投喂频率下无显著差异,但这种影响因素可能不是主要的。类似研究在大菱鲆上也有发现,生长结果受投喂频率变化的影响不显著而受投喂水平变化的影响显著[1]。此外,在投喂水平试验中,发现所有SGR、FER等主要反映生长性能的指标均在投喂水平为体重的4%的情况下出现拐点,且投喂水平为体重的4%~10%时,FI均在约3.2%,表明这一投喂水平已经能够满足红鳍东方鲀幼鱼生长需要,过高投喂水平会造成饲料浪费。同时,本研究的结果也暗示在红鳍东方鲀的养殖投喂策略中,投喂水平对生长的影响大于投喂频率,因此,在养殖过程中,应该更加关注投喂水平,保证每次投喂能够达到饱食状态。此外,红鳍东方鲀在养殖过程中,存在严重的相互残食现象,从而导致较高的死亡率[12]。一些研究发现,适宜的投喂频率和投喂水平均能有效缓减鱼类养殖过程中的相互残食[20]。而在本研究中,无论是在投喂频率还是投喂水平试验中,红鳍东方鲀的SR均高达96.67%~100%,且各组之间无显著差异,这一结果高于之前本团队关于红鳍东方鲀营养学研究中所有养殖试验的SR[12-16,18-19]。其原因可能是,在本试验的养殖过程中,通过添加深井海水,养殖水体的水温维持在18~22 ℃,从而导致尽管红鳍东方鲀养殖中存在相互残食的现象,但由于水温合适,残食引起的死亡率并没有随之升高。因此,在本试验条件下,无法通过死亡率对投喂频率和投喂水平影响红鳍东方鲀相互残食效果作出评价。
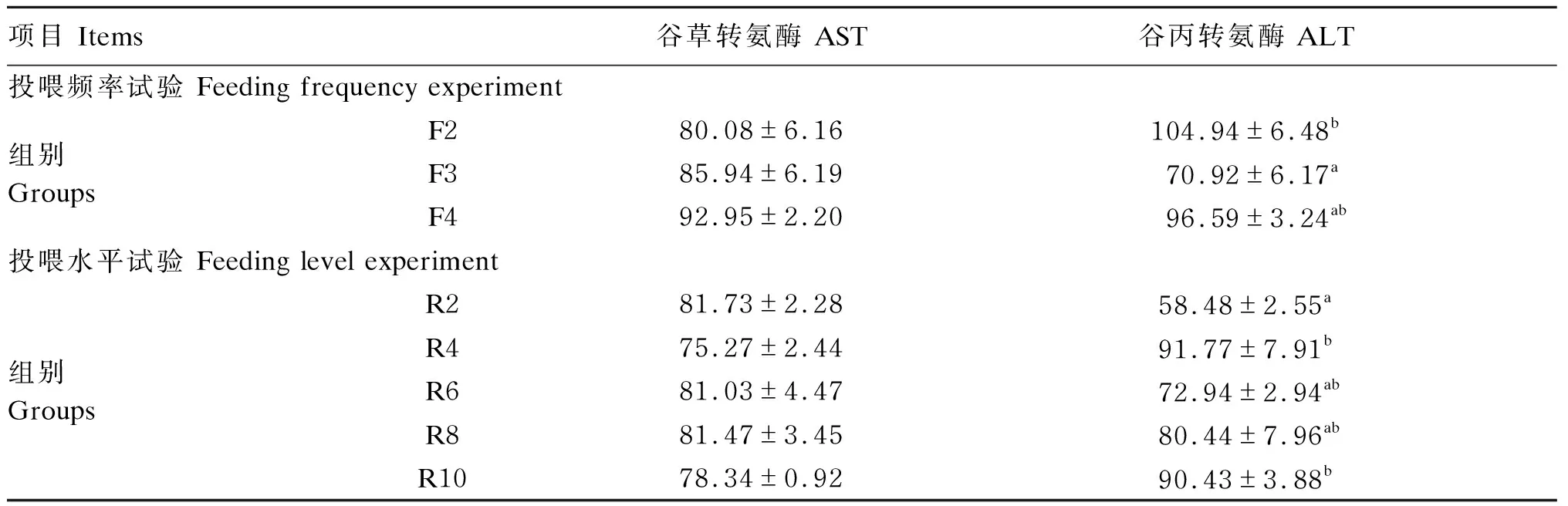
表5 投喂频率和投喂水平对红鳍东方鲀肝脏蛋白质代谢相关酶活性的影响
3.2 投喂频率和投喂水平对红鳍东方鲀幼鱼体成分和形体指标的影响
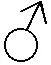
表6 投喂频率和投喂水平对红鳍东方鲀幼鱼养殖水质指标的影响
3.3 投喂频率和投喂水平对红鳍东方鲀幼鱼消化酶和蛋白质代谢相关酶活性的影响
投喂频率和投喂水平不仅会影响鱼类等水生动物的生长,而且会影响内源性消化酶的活性[6,31-32]。因此,本研究分析了投喂频率和投喂水平对红鳍东方鲀肝脏消化酶活性的影响。结果发现,在投喂频率试验中,3次/d的投喂频率显著提高肝脏胰蛋白酶和脂肪酶活性,表明适宜的投喂频率能提高消化酶的活性[31-32],但本试验消化酶活性变化的拐点与生长结果所反映的适宜投喂频率并不一致,在生长结果中,2次/d的投喂频率即可满足生长,这种现象也在俄罗斯鲟鱼(Acipensergueldenstaedtii)的研究中发现,以生长结果为评价指标得到的适宜投喂频率为3次/d,但消化酶活性变化的拐点却出现在4次/d的投喂频率组[33],产生这种不一致的原因可能是生长是鱼类对投喂频率变化的整体响应,它不仅反映消化能力,而且反映鱼类的摄食、吸收、代谢等综合情况,而消化酶活性仅从消化层面反映鱼类对投喂频率的响应。在投喂水平试验中,消化酶活性变化与生长结果一致,均是每天投喂体重的4%出现统计学上的最大值。同时,与投喂频率试验相似,投喂水平试验中消化酶活性产生差异的也为蛋白酶和脂肪酶,这表明投喂策略的改变主要影响红鳍东方鲀蛋白质和脂肪的消化,而对淀粉等糖类的消化影响不明显,类似的结果在大黄鱼的研究中也发现投喂频率对淀粉酶活性影响不明显[32],分析原因可能与鱼类先天对糖的利用率低有关[34]。
既然投喂频率和投喂水平均会影响红鳍东方鲀肝脏蛋白酶活性,因此,本研究进一步分析其对肝脏蛋白质代谢相关酶活性的影响。鱼类蛋白质代谢中,有2个重要的氨基酸分解酶,分别为AST和ALT,其中AST的主要作用为将天冬氨酸和α-酮戊二酸催化生成谷氨酸和草酰乙酸,ALT的主要作用为将丙氨酸和α-酮戊二酸催化生成谷氨酸和丙酮酸,而草酰乙酸和丙酮酸可以进入三羧酸循环参与能量代谢,因此,AST和ALT活性变化,除了表明会影响肝脏中能量代谢的活性,还表明会影响肝脏中转氨基的活性[35-37]。本试验中,虽然不同投喂频率和投喂水平对肝脏AST活性无显著影响,但显著影响肝脏ALT活性,在投喂频率试验中,表现为3次/d的投喂频率组肝脏ALT活性最高,类似的结果也出现在巨滑舌鱼(Arapaimagigas)上[38];在投喂水平试验中,同样也发现肝脏ALT活性在每天投喂体重的4%的投喂水平组显著升高,并且肝脏ALT活性随饲料投喂频率和投喂水平的变化与蛋白质和脂肪消化酶活性的变化趋势一致,这从另一个方面证明投喂频率和投喂水平变化不仅影响蛋白质消化,而且影响氨基酸的分解代谢。
3.4 饲料投喂频率和投喂水平对红鳍东方鲀幼鱼养殖水体中氨态氮、亚硝态氮和磷酸盐含量的影响
之前的研究证明,投喂频率和投喂水平会对水产动物养殖水体的水质产生重要影响,特别是池塘养殖、循环水养殖等处于静水状态下的养殖,氨态氮、亚硝态氮、磷酸盐等在水体中的含量会随着投喂水平或投喂频率(饱食投喂下)增加而显著升高[1,5-6,39-40]。而我国沿海的工厂化养殖中采用的养殖模式主要为流水养殖模式,这种养殖模式下的投饲频率和投喂水平对养殖水体氨态氮含量等重要水质指标的影响却缺乏研究。基于此,本试验模拟现阶段工厂化养殖最常用的流水养殖,研究投喂频率和投喂水平对红鳍东方鲀养殖水体水质的影响,结果发现,氨态氮、亚硝态氮和磷酸盐含量这3个重要水质指标虽然在投喂结束后2 h在养殖水桶的出水口相比进水口数值上有所升高,但不同投喂频率和投喂水平均对这3个指标均无显著影响,表明在流水养殖情况下,由于饲料及鱼体排泄产生的氨态氮等会随着水流排出养殖水体,因此,投喂策略对养殖水体水质变化的影响极小。
4 结 论
根据生长及消化酶活性结果,在本试验条件下,初始体重为15 g左右的红鳍东方鲀幼鱼适宜的投喂频率为2~3次/d,投喂水平为体重的4%。此外,在流水养殖模式下,不同投喂频率和投喂水平对养殖水体氨态氮、亚硝态氮和磷酸盐含量的影响极小。
