蛋白酶抑制剂对含水生菜种子耐冻性的影响
2021-04-06鲍红艳邓佳宝刘宝林韩颖颖
鲍红艳,于 影,邓佳宝,刘宝林,韩颖颖
(上海理工大学健康科学与工程学院/生物医学技术研究院,上海 200093)
植物种子根据贮藏特性的不同可以分为3类:正常型、顽拗型和中间型[1]。正常型种子含水量较低,不易被低温所影响,因此种子自身对于低温胁迫具有一定的抵抗能力[2]。相反,顽拗型种子在发育末期不经历成熟脱水,脱落时水分含量较高,对低温和脱水较敏感,因此脱水和低温对其影响较大[3]。顽拗型种子长期贮藏困难较大,对顽拗型种子贮藏的研究具有重要意义。生菜(Lactuca sativa)种子是正常型种子,但含水生菜种子能模拟顽拗型种子的含水状况,是研究种子含水量和低温保存关系的模式材料[4]。
植物种子在低温条件下会产生一定的抗冷反应,通过调控相关基因转录表达,调节有关蛋白质合成,提高种子内超氧化物歧化酶(Superoxide dismutase, SOD)和过氧化氢酶(Catalase, CAT)活性、产生新的蛋白成分、积累更小分子量球蛋白多肽等,进而提高种子抗冻性[5]。当种子受到低温冷害时,种子内的变化最先且主要发生在细胞膜上[6]。研究表明,提高种子内SOD活性以及提高羟自由基清除能力有利于维持机体内自由基平衡,稳定植物细胞膜[7—8]。Laskowski等[9]研究表明,蛋白酶抑制剂可阻止生物细胞膜发生不良蛋白水解反应。许雷等[10]提出蛋白酶抑制剂的靶标主要是植物体内的半胱氨酸蛋白酶,即巯基蛋白酶。半胱氨酸蛋白酶负责逆境胁迫下受损或者变性蛋白的降解,为新蛋白合成提供肽段或游离氨基酸[11]。蛋白酶抑制剂可防止植物体内不必要的蛋白质降解[12]。2-硝基苯甲酸[5,5'-Dithiobis-(2-nitrobenzoic acid),DTNB]是蛋白酶抑制剂,是一种巯基修饰剂,与巯基反应形成二硫键[13—14]。半胱氨酸蛋白酶抑制剂DTNB处理可促进种子贮藏蛋白水解,显著抑制球蛋白水解[15]。目前,关于低温胁迫下添加外源DTNB对种子生理活性的研究未见报道。
不同降温速率对低温保存的种子质量造成影响[16]。含水生菜种子受低温胁迫时有两种耐冻机制,慢速降温下,种子由于外部先结冰而使胚趋于干燥进而保护种子[17];快速降温下,种子采用过冷机制降低冰晶形成的温度[18]。种子受到低温胁迫时,种子胞内形成冰晶从而对细胞造成机械损伤[19]。抗冻蛋白是一类可以抑制冰晶生长的蛋白,可减轻低温损伤。植物在抗寒时合成小分子量抗冻蛋白,以提高其抗寒性能[5,20]。外源添加2-硝基苯甲酸能否使低温下种子产生新的蛋白成分并不明确。
本研究通过添加外源DTNB研究低温条件下含水生菜种子的发芽率、生理活性变化以及种子胞内形成的冰晶热物性;对新产生的蛋白成分进行质谱分析和鉴定,以及探讨小分子量球蛋白多肽对种子耐冻性的影响,旨在为研究外源蛋白酶抑制剂调控种子球蛋白降解的生物学机理奠定基础,也为开发种子低温保护剂提供新的思路。
1 材料与方法
1.1 材料
罗莎绿生菜(Lactuca sativa)种子购自北京凤鸣雅世科技发展有限公司。
试剂:琼脂粉、DTNB、硫酸亚铁、乙二胺四乙酸二钠(EDTA-Na2)、氯化硝基四氮唑蓝(NBT)、水杨酸、甲硫氨酸、过氧化氢(30%)、核黄素、SDS-PAGE变性丙烯酰胺凝胶快速制备试剂盒、Tris-HCl (pH 6.8)、PAGE胶蛋白微量回收试剂盒等,均购自生工生物工程(上海)有限公司。
仪器:PLANERkryo360-1.7程序降温仪(英国)、GZX-250B光照培养箱(中国通利信达)、微量紫外分光光度计(美国)、Powerpac Basic 电泳仪(美国)、DSC仪器(美国)、低温显微镜(日本)等。
1.2 方法
1.2.1 常温下DTNB处理生菜种子吸胀后含水量测定
配制 DTNB 浓度为 0、0.1、1、2、5 mmol·L–1,1%琼脂培养基。每份0.2 g罗莎绿生菜种子撒入培养皿中,放在常温(21 ℃)、光照强度 30 μmol·m–2·s–1的光照培养箱中吸胀处理,吸水11 h,此时种子完全吸水但未发芽[21]。取材后擦干表面水分,立即放入烘箱内103 ℃烘17 h。每个样品做3组平行。

1.2.2 常温下含水生菜种子发芽率测定
生菜种子按照1.2.1吸胀处理,每样品取25粒种子播种至培养基,3组平行。在1.2.1光照培养箱中培养,连续5 d观察发芽情况[22]。

1.2.3 慢速降温下含水生菜种子发芽率测定
种子按照1.2.1吸胀处理后,擦干表面水分,分别装入1.5 mL EP管中,放入程序降温仪慢速降温,降温程序见表1。降温结束后室温放置30 min,种子播种处理同1.2.2。

表1 程序慢速降温参数设置Table 1 Parameter setting during slow program cooling
1.2.4 慢速降温至不同温度梯度时含水生菜种子发芽率的测定
外源添加 0、2 mmol·L–1DTNB,同 1.2.3 对生菜种子进行吸胀和降温处理。温度分别降至–13 ℃、–15 ℃、–17 ℃、–20 ℃后,室温放置 30 min。按照1.2.2播种并测定发芽率。
1.2.5 含水生菜种子生理活性测定
外源添加 0、2 mmol·L–1DTNB 的生菜种子按1.2.4慢速降温至–20 ℃。采用氮蓝四唑比色法测定种子SOD活性[23],通过Fenton反应测定种子羟基自由基清除能力[24]。以相同条件常温的含水生菜种子为对照。
1.2.6 含水生菜种子热物性分析
外源添加 0、2 mmol·L–1DTNB,同 1.2.1 吸胀处理。取一颗饱满的生菜种子于培养皿中,进行差示扫描量热法(Differential scanning calorimeter,DSC)实验,降温程序同文献[25]。
1.2.7 差异蛋白点测定
外源添加 0、2 mmol·L–1DTNB,同 1.2.3 对种子吸胀处理后降温至–20 ℃。用TCA丙酮沉淀法抽提种子总蛋白。根据丁玉娇[23]双向电泳操作程序设置参数,对差异蛋白点进行质谱分析鉴定(生工生物工程(上海)有限公司)。利用Bio Tools软件搜索NCBI prot数据库,寻找相匹配的蛋白质[26]。
1.2.8 含水生菜种子球蛋白提取及SDS-PAGE图谱
同 1.2.7吸胀和程序降温处理的含水生菜种子进行球蛋白提取和SDS-PAGE电泳实验,电泳条件参考Han等[25]的方法并作改进,先80 V、20 min然后120 V、80 min。
1.2.9 球蛋白多肽提取液处理的种子发芽率测定
采用PAGE胶蛋白微量回收试剂盒将1.2.8球蛋白多肽回收。回收的不同大小分子量球蛋白多肽提取液,每个条带做3组平行,分别取60 μL加入培养基中,种子吸胀和降温处理同 1.2.3。按照 1.2.2播种并测定发芽率。
1.2.10 球蛋白多肽热物性测定
对1.2.9球蛋白多肽提取液进行DSC实验,每个样品提取液取10 μL放在皿中,每组样品做3组平行。DSC的慢速降温程序同1.2.6。
1.2.11 球蛋白多肽的冰晶显微观察
将1.2.9回收的球蛋白多肽进行低温显微观察,每组取3 μL置于低温显微镜的载玻片上,降温速率为 1 ℃·min–1,观察冰晶形成的起始温度和放热焓值。每组样品做3组平行。
2 结果与分析
2.1 常温下DTNB处理生菜种子吸胀后含水量的变化
生菜种子在吸水 12 h后发芽,因此选取吸水11 h种子进行含水量测定,吸胀后生菜种子含水量见表2。常温下不同浓度DTNB对生菜种子吸胀含水量无显著影响,种子含水量维持在50%左右。因此可以保证后续慢速程序降温实验中生菜种子的耐冻性不受含水量差异的影响。

表2 不同浓度DTNB吸胀处理后生菜种子含水量及发芽率Table 2 Water content and germination rate of Lactuca sativa seeds with different concentration of DTNB treatments
2.2 常温下含水生菜种子发芽率的变化
发芽率是衡量种子活性的指标之一。常温下不同浓度 DTNB对生菜种子发芽没有影响(P>0.05),其发芽率均为92%左右(表2)。
2.3 慢速降温下含水生菜种子发芽率的变化
慢速程序降温可以模拟自然界低温胁迫等环境下的温度变化。采用不同浓度DTNB对生菜种子进行吸胀处理,慢速降温条件下将生菜种子从常温降温至–20 ℃,观察生菜种子的发芽情况,以发芽率为指标筛选保护效果最佳的DTNB浓度。外源添加0、0.1、1、2、5 mmol·L–1DTNB 处理生菜种子,吸胀后经程序降温,2 mmol·L–1DTNB处理的种子发芽率最高,表明2 mmol·L–1DTNB对低温胁迫环境下生菜种子抗冻性的保护效果最佳(P<0.01),即在此浓度下种子会做出抗冷反应来抵御低温损伤。后续选取 2 mmol·L–1DTNB 进行实验。
2.4 慢速降温至不同温度时含水生菜种子发芽率的变化
通过慢速降温设置低温梯度及外源添加2 mmol·L–1DTNB处理种子,根据发芽率和低温伤害指标确定含水生菜种子的致死温度及DTNB对种子抗冻性的影响。温度降至–13 ℃、–15 ℃、–17℃时,2 mmol·L–1DTNB处理的生菜种子发芽率与对照无显著差异(P>0.05)(图1);当温度降至–20 ℃时,对照组发芽率大幅度下降,约下降 3 0%。降温至–20 ℃时,对照组含水生菜种子发芽率仅为8.89%,2 mmol·L–1DTNB处理组的发芽率为37.78%,对照组与外源添加DTNB处理的生菜种子发芽率存在极显著差异(P<0.01)(图1)。表明温度降至–20 ℃时含水生菜种子自身无法抵御低温损伤,造成种子几乎处于死亡状态,推测–20 ℃是影响含水生菜种子发芽的致死温度。

图1 DTNB吸胀与不同温度对生菜种子发芽率的影响Fig. 1 Germination rate of Lactuca sativa seeds treated with DTNB (2 mmol·L–1) under slow program cooling
2.5 DTNB对含水生菜种子抗氧化活性的影响
常温下,对照组生菜种子SOD活性较低。慢速降温至–20℃时,对照组的SOD活性有所提高,表明低温胁迫下细胞内产生更多的活性氧和羟基自由基(图2: A)。

图2 DTNB(2 mmol·L–1)对生菜种子抗氧化活性的影响Fig. 2 Effect of DTNB (2 mmol·L–1) treatment on antioxidant activity of Lactuca sativa seeds
外源添加2 mmol·L–1DTNB时,常温下含水生菜种子 SOD活性是对照的 3倍,存在极显著差异(P<0.01);程序降温至–20 ℃时,生菜种子的 SOD值与对照相比提高约 1.38倍,二者差异极显著(P<0.01) (图2: A)。说明外源添加 2 mmol·L–1DTNB时促使种子在早期产生较高的 SOD活性可抵御低温对种子造成的冷冻损伤。可见种子内SOD活性提高可提高种子耐冻性,这也是外源添加DTNB能对种子提供低温保护的原因。
生菜种子羟基自由基的清除能力变化也表现出与SOD活性相似的规律。常温下对照组羟基自由基清除率为25.90%,经慢速程序降温后,对照组的羟基自由基清除能力提高至32.01%,表明程序降温后种子内产生更多的抗氧化酶来清除细胞因低温损伤产生的羟基自由基(图2: B)。常温下外源添加2 mmol·L–1DTNB时,羟基自由基清除率提高约1.17倍,经慢速程序降温处理后,羟基自由基的清除能力变化不显著。表明外源添加2 mmol·L–1DTNB在早期已提高清除种子内因低温产生的羟基自由基,使机体尽量减少因羟基自由基大幅度增加而造成的低温损伤。
2.6 含水生菜种子热物性变化
外源添加2 mmol·L–1DTNB对生菜种子吸胀处理,吸胀后对种子进行 DSC实验,降温速率为3 ℃·h–1,对照组第一个放热峰形成时温度为–15 ℃左右,即胞内冰晶形成的起始温度约为–15 ℃(表3)。经2 mmol·L–1DTNB处理后含水生菜种子放热峰起始温度也在–15 ℃左右,温度变化不显著。DSC测得的结晶峰放热焓值代表水分结冰所释放的热量,即放热焓值绝对值越大,种子形成的冰晶越大,对种子的损伤亦越大。
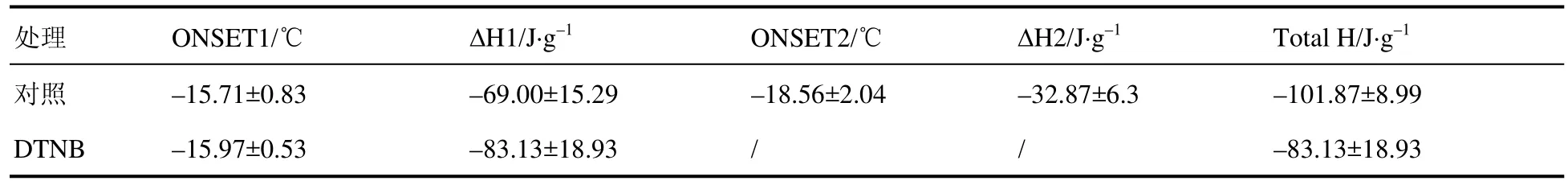
表3 慢速降温下生菜种子胞内形成冰晶的温度及放热焓值Table 3 Ice crystal formation temperature and exothermic han value of 2 mmol·L–1 DTNB treatment during slow paragram cooling
对照组生菜种子形成两个结晶峰,其总放热焓值绝对值为 101.87 J·g–1,而外源添加 2 mmol·L–1DTNB组生菜种子只出现一个结晶峰,放热焓值绝对值较低(表3)。以上表明在慢速降温条件下,外源添加2 mmol·L–1DTNB吸胀处理的含水生菜种子耐冻性比对照组强,即与对照组相比,种子胞内水分含量更低,种子胚处于更干燥的状态,胞内形成的冰晶更小,对种子的低温损伤较小,故种子活性较强,发芽率更高(图1)。
2.7 差异蛋白点分析
提取慢速降温条件下生菜种子蛋白进行双向电泳,发现外源添加2 mmol·L–1DTNB组的蛋白条带与对照组存在两个差异蛋白点(图3)。对差异蛋白点进行质谱分析,表明蛋白点1为11S 种子贮藏球蛋白Jug r4(XP_023733339.1),蛋白点2为11S 种子贮藏球蛋白2 (XP_023769779.1),两个差异蛋白点都属于球蛋白家族,分子量集中在 14.4~18.4 kDa。表明外源添加2 mmol·L–1DTNB 可促进生菜种子贮藏蛋白的水解,水解成单个小分子的球蛋白多肽。低温下外源添加2 mmol·L–1DTNB 之所以使种子产生抗冻性也可能与种子内贮藏蛋白降解为小分子量球蛋白多肽有关。

图3 DTNB吸胀处理生菜种子差异蛋白点Fig. 3 Differential protein spot stripe of DTNB treatment in Lactuca sativa seeds

表4 DTNB吸胀处理生菜种子差异蛋白点质谱分析鉴定Table 4 Identification of differential ptotein points by mass spectrometry in Lactuca sativa seeds treated with DTNB
2.8 含水生菜种子球蛋白多肽的积累
慢速程序降温条件下,对照组与外源添加2 mmol·L–1DTNB 含水生菜种子球蛋白SDS-PAGE 电泳图谱见图4。基于分子量的球蛋白电泳条带显示。对照组与外源添加2 mmol·L–1DTNB含水生菜种子球蛋白电泳图谱的较大分子量集中在30~45 kDa,中等分子量集中在20~30 kDa,较小分子量集中在14.4~18.4 kDa。与对照组相比,外源添加2 mmol·L–1DTNB可以促进种子贮藏蛋白降解为更小分子量(18.4 kDa以下)的球蛋白多肽。这与图3双向电泳蛋白点分析结果一致,外源添加2 mmol·L–1DTNB吸胀处理的生菜种子,具有较多分子量18.4 kDa以下的球蛋白多肽积累。

图4 慢速降温下不同处理含水生菜种子球蛋白SDS-GAGE电泳条带Fig. 4 SDS-PAGE electrophoretic bands of globulin in aqueous lettuce seeds under slow cooling of different treatments
2.9 小分子量球蛋白多肽提取液吸胀对种子发芽率的影响
检测图4回收的小分子量球蛋白多肽提取液对慢速程序降温的生菜种子发芽率的影响,DTNB+球蛋白组处理吸胀后的生菜种子发芽率为 25.88%±0.88%,与对照组相比发芽率存在显著差异(P<0.05)(表5)。表明DTNB组中积累的小分子量球蛋白多肽可以提高慢速程序降温后的含水生菜种子发芽率,小分子量球蛋白多肽提取液可提高种子的低温耐受性和抗冻性。

表5 小分子量球蛋白多肽对发芽率的影响Table 5 Effect of small molecular globulin polypeptide on germination rate of Lactuca sativa seeds
2.10 不同分子量球蛋白多肽的热物性分析
差示扫描量热法实验(DSC)表明,不同分子量球蛋白多肽(C1、C2、C3、C4、CD)形成冰晶时放热峰的起始温度在上升。慢速降温条件下,对照组C1球蛋白多肽在–36 ℃左右出现冰晶,当C4球蛋白多肽的放热峰出现时起始温度已上升至–22 ℃(表6)。DTNB组中最小分子量球蛋白多肽CD放热峰出现时温度已上升至–18 ℃左右。冰晶形成的起始温度上升,则种子在低温环境下对温度的敏感性降低,即减少了低温胁迫对其造成的损伤。一般来说,细胞外会先于细胞内结冰,胞内水分渗透到细胞外,使胚趋于干燥状态从而在低温胁迫条件下保护种子。C1~C4放热峰的总放热焓值增大,胞内更多的水分渗透到胞外,胞内水分不断减少,使胚趋于干燥状态。胞内水分活度越低,种子在低温胁迫条件下更容易存活下来。这也是外源添加2 mmol·L–1DTNB吸胀处理后经降温后种子内积累的小分子量球蛋白多肽 CD与对照组积累的小分子量球蛋白多肽相比可以使生菜种子在低温下产生抗冻性的原因。
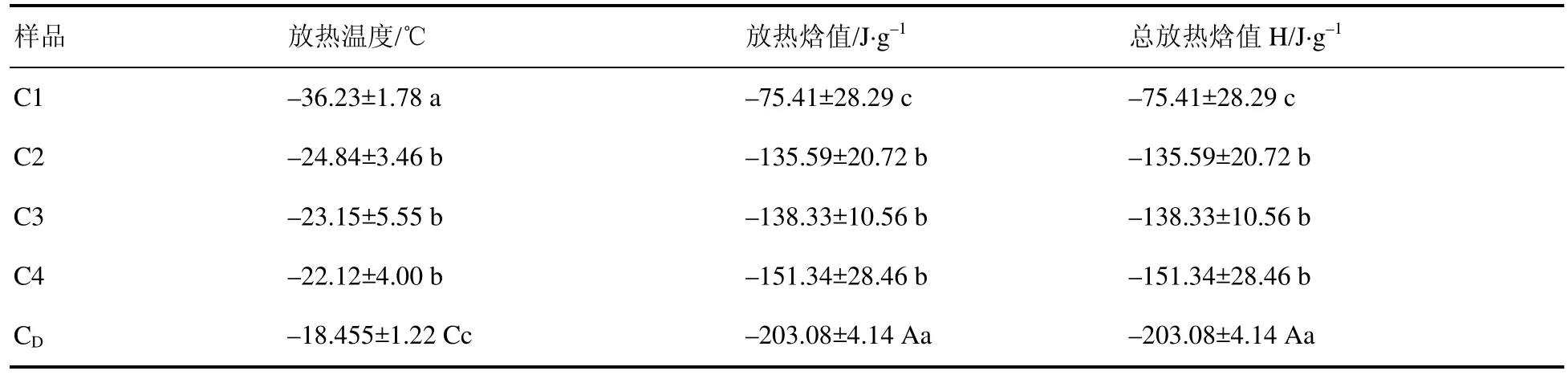
表6 不同大小分子量球蛋白多肽的DSC实验Table 6 DSC experiments of globulin polypeptides with different molecular weights
2.11 不同分子量球蛋白多肽冰晶的显微变化
为了进一步验证不同分子量球蛋白多肽胞内冰晶形成大小以及冰晶形成时的起始温度,对不同分子量球蛋白多肽进行低温显微镜观察。球蛋白多肽C1、C2、C3、C4、CD形成的冰晶随着分子量减小逐渐变小(图5)。C1形成的冰晶呈枝状且遍布整个视野,枝状冰晶对种子的损害作用大;C2形成的冰晶变得圆润且遍布整个视野,圆润冰晶比枝状冰晶对种子的低温损害作用小;C3和 C4形成的冰晶也呈圆形,但C4形成的冰晶更小,即对种子的损伤小;与C4相比,外源添加DTNB积累的小于18.4 kDa球蛋白多肽CD形成的冰晶更小更圆润,即对种子的低温损害最小,与球蛋白多肽提取液吸胀种子程序降温后发芽率较高的结果相一致。说明球蛋白多肽分子量越小对种子的保护效果更佳,同时验证了在低温胁迫环境下,外源添加2 mmol·L–1DTNB的种子吸胀后,积累的小分子量球蛋白多肽能提高种子的抗冻能力。

图5 不同分子量球蛋白多肽在低温下形成的冰晶形状Fig. 5 Low temperature microscope experiment of globulin polypeptides with different molecular weights
3 讨论
低温胁迫会导致种子机械损伤甚至死亡,可通过添加冰冻保护剂维持低温条件种子的活力[27—28]。常用的冰冻保护剂有二甲基亚砜(DMSO)、蔗糖、甘油等,但都存在一定的不足,如对不同种类的细胞具有一定的毒性。本研究采用外源添加蛋白酶抑制剂DTNB处理生菜种子,探讨其通过慢速程序降温时抗冻能力。研究发现,当温度降至–20 ℃时,生菜种子几乎处于死亡状态。Han等[25]研究表明,慢速降温条件下–20 ℃是含水生菜种子的致死温度。而外源添加 2 mmol·L–1DTNB 的含水生菜种子在–20℃时发芽效果显著,即 2 mmol·L–1DTNB 可提高种子的抗冻性。
植物遭受逆境胁迫时施加外源物质可在一定程度上调节抗氧化酶活性,增强植物体抗逆性[19]。植物在低温下会表现出一定的抗寒性,SOD是机体清除活性氧的第一道防线[19],其活性增强可清除植物体在低温下产生的 ROS和羟基自由基等物质以提高机体抗寒能力[29]。Anwar等[30]研究表明,外源添加5-氨基乙酰丙酸(ALA)可提高植物体的抗氧化酶活性,稳定丙二醛和 ROS的积累。本研究发现外源添加2 mmol·L–1DTNB在初期就可以提高种子内抗氧化酶活性,有效缓解植物在冷应激中受到的损伤。
外源添加DTNB吸胀处理的含水生菜种子再经低温–20 ℃胁迫后,其发芽率与对照组明显提高。DSC差示扫描量热法测定显示,对照组生菜种子形成两个放热峰,即种子内有两次形成冰晶。根据Jaganathan等[31]的研究,第一个放热峰是胚乳中冰晶形成,第二个放热峰是胚胎中冰晶形成。胚胎中更多的冰晶形成将导致种子受到更大的伤害[31]。添加2 mmol·L–1DTNB吸胀处理的生菜种子只在胚乳中形成一次放热峰,胚胎中未形成冰晶。因此减少了胚胎中冰晶对种子的伤害,这也是外源添加2 mmol·L–1DTNB可以提高种子抗冻性的原因。
植物体贮藏蛋白中球蛋白的含量最高[32],种子贮藏蛋白在种子萌发初期发生水解,生成氨基酸并为种子萌发提供营养。植物贮藏蛋白的水解离不开蛋白酶的作用[33],主要包括半胱氨酸蛋白酶和丝氨酸蛋白酶等。以球蛋白为例,半胱氨酸蛋白酶、木瓜蛋白酶对种子球蛋白进行降解,以半胱氨酸蛋白酶抑制剂如碘乙酸(JAA)、DTNB处理促进贮藏蛋白水解,显著抑制球蛋白降解[15]。本研究双向电泳实验表明,DTNB促进生菜种子贮藏蛋白降解为小分子量的球蛋白亚基,促进 11S 种子贮藏球蛋白Jug r4 (XP_023733339.1)和 11S 种子贮藏球蛋白 2(XP_023769779.1)两种球蛋白的积累。SDS-PAGE电泳图也同样显示外源添加DTNB后种子内有更多的分子量低于18.4 kDa球蛋白多肽积累。种子贮藏球蛋白的水解参与保护种子免受氧化应激[34],而且分子量小的多肽比分子量较大的多肽表现出更高的抗氧化活性[35—36]。这也是外源添加DTNB在低温条件下可以使含水生菜种子产生抗冻性的原因之一。
