肌肉减少症对接受TACE治疗原发性肝癌患者生存期的影响
2021-04-02向谦陈丽付丹徐庆叶斌陈霞
向谦,陈丽,付丹,徐庆,叶斌,陈霞
原发性肝癌(hepatocellular carcinoma, HCC)是常见的恶性肿瘤,年发病率约为26.92/10万,死亡率约为23.72/10万,分列我国恶性肿瘤性疾病发病构成和死亡构成第4位和第2位[1]。外科手术是肝癌首选的治疗方法,但由于国内大部分患者具有肝硬化背景,或发现时已达中晚期,能获得手术机会的患者仅20%~30%[2]。经导管动脉化疗栓塞术(transarterial chemoembolization, TACE)是目前失去手术机会进展期肝癌最常用的标准治疗手段之一,可以显著延长患者的生存时间[3-5]。TACE治疗效果存在个体化差异,受肝功能储备、肿瘤容积负荷、临床分期等多种临床因素影响[6]。
肌肉减少症(sarcopenia, Src)是与高龄、肝硬化、慢性肾功不全、恶性肿瘤等多种健康问题相伴随的骨骼肌量减少、肌力下降和骨骼肌功能减退的临床综合征[7-9]。在各种肝脏疾病中,Src一方面影响患者的生存质量,另一方面也增加了肝性脑病、感染等并发症风险[10]。有报道指出Src可以作为HCC患者根治性外科手术、生物靶向治疗后生存时间欠佳的预测因子[11-13],然而Src的存在对接受TACE治疗的HCC患者预后的影响尚不十分明确。因此,本研究拟开展回顾性队列分析,以评估术前Src和初次接受TACE治疗的HCC患者预后可能的关联。
1 资料与方法
1.1 病例资料
本研究经我院医学伦理委员会批准,回顾性分析2014年1月至2018年1月在我院初次诊断和接受首次TACE治疗的155例HCC患者的资料。纳入标准:①符合中华人民共和国卫生和计划生育委员会医政医管局《原发性肝癌诊疗规范》[2]中HCC诊断标准;②初次诊断HCC和接受首次TACE患者。排除标准:①既往有其他肿瘤病史;②曾接受生物靶向治疗;③缺乏TACE治疗前用于判断Src的CT影像学资料;④未按照规范治疗的随访患者。
155例患者排除既往有其他肿瘤病史、曾接受生物靶向治疗、缺乏 TACE治疗前用于判断 Src的 CT 影像学资料、未按照规范治疗随访患者共 57 例。最终纳入分析患者98例,其中男65例,女33例。98例HCC患者中60例(61.22%)在接受首次TACE治疗前已合并存在Src。详见图1。

图1 患者纳入排除情况
研究由课题组两位高年资医师共同完成患者病例资料的提取,采集纳入患者年龄、性别、体质量指数(body mass index,BMI)、基础肝病原因、是否存在肝硬化、肝功Child-Pugh分级、肿瘤BCLC分期、美国东部肿瘤协作组体力状况评分(Eastern Cooperative Oncology Group performance status,ECOG-PS)、是否合并糖尿病、是否合并心血管疾病、是否合并慢性肾病、甲胎蛋白(alpha-feto protein, AFP)、异常凝血酶原(de-gamma-carboxyl prothrombin,DCP)、CT影像学资料、TACE治疗情况、术后随访记录。
1.2 TACE治疗
TACE适应证、禁忌证、治疗过程及观察随访方案遵循《中国肝细胞癌经动脉化疗栓塞治疗临床实践指南》[4]。常规TACE(conventional-TACE,cTACE),灌注化疗选择5-氟尿嘧啶(5-fluorouracil, 5-FU),随后选择多柔比星/表柔比星(多柔比星20~100 mg;表柔比星40~100 mg)与碘化油充分混合成乳剂,经肿瘤的供血动脉支注入进行栓塞,应尽量栓塞肿瘤的所有供养血管,以尽量使其去血管化。观察到碘化油乳剂注射引起血流减慢后,注入少量聚乙烯醇颗粒栓塞剂(1~2 mL悬浮液)达到栓塞终点。
1.3 Src判断标准
选择患者接受TACE治疗前4周内平扫CT影像用于骨骼肌量测定。在第3腰椎水平横截面根据CT值(-29~150 HU)计算骨骼肌(包括腰大肌、竖脊肌、腰方肌、腹横肌、腹外斜肌、腹内斜肌)质量指数(skeletal muscle index,SMI),Src在男性和女性诊断标准[14]选择为SMI分别低于40.31和30.88 cm2/m2。
1.4 观察指标
患者首次接受TACE治疗至疾病进展时间(time to progress, TTP)和患者总生存时间(overall survive, OS)。
1.5 统计学方法
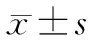
2 结果
2.1 患者基线情况
两组年龄、性别、基础肝病情况、肝功能Child-Pugh评分、肿瘤BCLC分级、合并糖尿病、合并心血管疾病、合并慢性肾功不全、治疗前血AFP、血DCP水平方面均无显著性差异(P>0.05)。Src组BMI低于无Src组(P=0.001),ECOG-PS评分高于无Src组(P=0.027),见表1。

表1 纳入患者一般情况
2.2 TACE治疗和随访情况
纳入分析的98例患者中,有11例在接受首次TACE治疗后报告存在持续低热、食欲减退和肝功损害,均在2周内改善,没有与TACE相关死亡和严重并发症出现。根据患者耐受情况和对治疗反应进行后续TACE治疗,无Src组患者接受TACE治疗次数和观察随访时间显著多于Src组患者(均P=0.001),见表2。

表2 TACE治疗和随访情况
2.3 TTP和OS
观察期间87例(88.78%)患者发生死亡,其中71例(81.61%)死亡与肝脏疾病相关。接受TACE治疗的HCC患者中位TTP为6.50(5.0,11.0)个月,中位OS期为11.00(7.00,14.00)个月。98例患者在接受首次TACE治疗后3、6、12、18、24个月两组患者肿瘤无进展比例分别为88.78%、50.00%、16.33%、4.08%、4.08%;3、6、12、18、24个月总生存率分别为96.94%、78.57%、36.73%、15.31%、11.22%。两组患者TTP和OS存在显著性差异(P均<0.000 1),见图2、图3。

图2 两组TTP Kaplan-Meier曲线比较

图3 两组OS Kaplan-Meier曲线比较
2.4 首次TACE术前结局相关危险因子
在Cox比例风险回归模型下采用单因素与多因素回归分析术前与TACE治疗后OS相关预测因子。单因素分析提示治疗前BMI<25 kg/m2、Src存在、HBV或HCV病毒性肝病基础、BCLC分级C级、ECOG-PS评分≥2分、治疗前AFP>400 μg/L与TACE治疗后OS不佳相关,见表3。筛选BMI、治疗前Src、肝病原因、BCLC分级、ECOG-PS评分、血AFP水平进入多因素分析,显示治疗前Src(HR:2.265,95%CI:1.350~3.800;P=0.002)、肿瘤BCLC分级C级(HR:1.627,95%CI:1.044~2.534;P=0.031)、ECOG-PS评分≥2分(HR:1.811,95%CI:1.050~3.125;P=0.033)、治疗前AFP>400 μg/L(HR:1.867,95%CI:1.198~2.911;P=0.006)可以作为TACE治疗的独立危险因子,见表4。

表3 TACE治疗相关危险因子Cox单因素分析
3 讨论
Src是慢性肝脏疾病和肿瘤常见合并症,报道称14%~78%等待肝移植的慢性肝病成年患者存在Src[15],11%~45%的HCC患者存在Src[13],其发生受年龄、性别、营养摄入、肝功能减退、肿瘤消耗等诸多原因影响[16]。Src在HCC预后中扮演的角色正在受到越来越多的重视:Src与初次诊断HCC患者生存预后独立相关[11];在接受根治性外科手术患者,术前Src是肿瘤复发与死亡独立危险因子[12];在接受索拉非尼生物靶向治疗和接受射频消融术HCC患者中也有类似结论[17-18]。然而Src是否能作为TACE治疗生存效果的预测因子,目前尚无统一认识。
常用TACE疗效预测因子包括肝功能储备状态、肿瘤分期、血AFP水平等[19],本研究探讨了Src与首次接受TACE治疗HCC患者生存预后可能的联系。从本研究中可以看到,首先,进展期HCC患者Src发病率高,进入本回顾性分析的98例患者中61.22%在首次接受TACE治疗前即已合并Src。虽然该数据略高于前述部分文献报道[11,13,20],但与接受生物靶向治疗和接受射频消融术HCC患者研究数据相近[17-18],这可能是由于研究群体选择为失去外科手术机会进展期HCC,也从另一方面提示临床工作者需要对本类型患者营养状况进行关注。其次,除了肿瘤BCLC分级、ECOG-PS评分、血AFP水平与既往文献[4,21-22]报道吻合的指标以外,Src是TACE治疗预后不佳强力的独立预测因子。存在 Src 且接受 TACE 治疗的 HCC 患者,出现预后不良的风险是无 Src 患者的 2.265倍(95%CI: 1.350-3.800,P=0.002)。虽然之前也有研究认为[23-24]TACE治疗过程中骨骼肌量降低才是TACE治疗生存结局欠佳的危险因素,而非治疗前Src。但上述研究37%的患者入组时已接受过其他抗肿瘤治疗,难以避免实体肿瘤缺血坏死的低热、食欲减退等与Src、生存预后的混杂影响;并且治疗后数月观察SMI变化用于评估TACE效果,时效性相对滞后,临床意义可能有限。而本研究选择临床中更常见的初次诊断的HCC患者,基于治疗前信息对治疗结局进行预测分析,患者也无需反复接受放射照射检查以评估SMI变化,对实践可能更有帮助。同时,Src一方面可以为TACE治疗效果和结局预测提供参考,通过MDT为患者选择更合适的治疗方案;另一方面,HCC患者肝硬化程度,肿瘤病理分型、BCLC分期、ECOG-PS状态等一些和TACE疗效有关的因素多是目前常规治疗难以进行干预的,而Src却是一个通过医学干预有可能得到改善的指标。文献报道[25-27]夜间加餐以增加营养素和能量供给、补充支链氨基酸活化雷帕霉靶蛋白途径增加肌蛋白合成,以及补充维生素D对增加肌量和肌力有帮助;补充左旋肉碱可以通过活化胰岛素样生长因子-1/AKT/p70S6激酶途径[28],以及运动锻炼的抗炎、抗氧化效果等对Src起到预防效果[29]。也许通过干预Src[30],可能提升接受TACE治疗HCC患者生存预后,这也为我们后续研究提供了思路,可以有待进一步探索。
本研究中Src与TACE治疗预后独立相关的机制可能与炎症、免疫、细胞因子有关[31-32]。有研究发现骨骼肌丢失时,瘦素、肿瘤坏死因子α、白介素-6等脂肪炎症因子水平增高,而肌细胞因子如IL-15水平降低,该变化对机体免疫系统起负性抑制作用,更容易出现感染和肿瘤进展[33];同时瘦素本身也促进肿瘤细胞增殖而增加HCC的侵袭性[34]。当然,Src本身也会造成患者体质下降、功能和生活质量减退,这也可以解释纳入研究两组患者年龄、性别、基础肝病情况、肝功能Child-Pugh评分、肿瘤BCLC分级、合并糖尿病、合并心血管疾病、合并慢性肾功不全、治疗前血AFP、血DCP水平等基线指标具有良好可比性,但两组BMI和ECOG-PS存在差异。此外,资料中两组患者随访观察时间和TACE治疗次数也存在差异,原因可能两组患者TTP与OS不同有关。生存时间越长患者有更长的随访观察时间,对肿瘤治疗效果越好,肿瘤进展越慢的患者有更多后续的TACE治疗机会。这两项指标在患者首次接受TACE治疗前不会对最终生存起到预测作用,故未将这两项指标纳入分析。
本文研究也存在局限性。研究方案设计为回顾性分析,患者资料时间范围覆盖自2014年始,为避免混杂因素对结果造成干扰,纳入均为接受cTACE患者,未涉及药物洗脱微球 TACE(drug eluting beads-TACE,DEB-TACE)病人资料[35]。研究病例数相对较少、观察时间相对较短,观察期间患者中位TTP和OS略低于其他文献报道[3-5],这可能与资料覆盖时间范围较广、严格选择失去手术机会进展期患者、未纳入DEB-TACE和生物靶向治疗患者有关。但在中位时间10.7个月的观察期内,95.92%的患者出现了肿瘤进展,88.78%出现了临床结局,故本研究结果仍具有价值。
综上所述,相当部分HCC患者首次接受TACE治疗前已合并存在Src。Src是TACE治疗总体生存欠佳的独立危险因素,可以作为HCC患者接受TACE治疗预后的预测因子。是否能将干预Src作为改善TACE临床结局的治疗策略可以有待进一步研究证实。
