基于同位素标记相对和绝对定量技术研究藏香猪冷鲜肉冰温保鲜分子机制
2021-03-31杨飞艳辜雪冬孙术国谢司伟黄文阳
杨飞艳,辜雪冬,孙术国,,罗 章,谢司伟,黄文阳
(1.中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.西藏农牧学院食品科学学院,西藏 林芝 860000)
猪肉约占全球肉类消费总量的40%[1]。藏香猪,在西藏又称人参猪,生长在海拔3 000~4 000 m的地区,以天然野生食用植物为主要食物,并以皮薄、脂肪含量低、肉质鲜美、营养丰富而闻名[2-3]。然而,由于目前对藏香猪肉理化评价、加工技术等基础研究缺乏,造成藏香猪肉在贮藏加工过程其质构、色泽、感官等品质损失巨大。
肉的冰温保鲜技术是最近20 年开发的最新保鲜技术,相对于冷冻保鲜,其滴水损失少,贮藏过程品质保持最佳,相对于冷藏保鲜技术,其保鲜时间更长[4]。然而,目前研究肉的贮藏品质主要通过测定质地、外观、风味、颜色等[5],主要集中于宏观层面,较难解释肉在贮藏过程品质劣化分子机制。随着蛋白质组学技术在肉类科学中的应用,为揭示肉在贮藏过程品质变化规律提供重要研究手段,目前已有研究发现肉在冷藏过程中涉及与其品质劣化相关的生物标记物[6],部分揭示了肉在贮藏过程中品质劣化内在分子机制[7]。冰温保鲜相对冷藏保鲜优势明显,但相关的保鲜分子机制原理仍不明确。
因此,本研究利用同位素标记相对和绝对定量(isobaric tags for relative and absolute quantitation,iTRAQ)蛋白质组学技术,比较分析了冰温和冷藏保鲜条件下藏香猪冷鲜肉蛋白质组的变化,旨在了解冰温条件对藏香猪冷鲜肉品质保鲜分子机制,为冰温保鲜技术合理利用、冷鲜肉合理贮藏提供参考。
1 材料与方法
1.1 材料与试剂
原料肉选自西藏贡博甘达县萨沙镇的天然牧场藏香猪肉大腿肉(成年猪肉,正常、健康、无病、年龄1 岁)。
牛血清白蛋白(bovine serum albumin,BSA)(质量浓度为5 μg/μL)、氨水、胰酶美国Sigma公司;胰蛋白酶、肌钙蛋白I(Troponin I)、钙蛋白酶抑制素(Calpastatin)、反贝克林1(anti-Beclin 1)美国Promega公司;Bradford染液、甲醇、裂解液L3、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、三羟甲基氨基甲烷(Tris)、丙酮广州辉骏生物科技有限公司;乙腈美国Fisher公司;BCA蛋白分析试剂盒、ECL化学发光底物试剂盒上海碧云天生物技术有限公司。
1.2 仪器与设备
1524R低温培养箱珠海黑马医学仪器有限公司;OQ610 Squirrel数据记录器英国格兰特仪器公司;SP-765PC紫外-可见分光光度计上海光谱仪器有限公司;Nicolet iG50傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)仪、Ultimate 3000 RSLC nano液相色谱(liquid chromatography,LC)仪、Orbitrap Fusion Lumos Tribrid质谱(mass chromatography,MS)仪美国赛默飞世尔科技公司;Acclaim PepMap RSLC C18分析柱(2 mm×150 mm,2 μm)美国Dionex公司;XHF-DY均质机宁波新芝生物科技股份有限公司;DHP-9012恒温箱上海一恒科学仪器有限公司。
1.3 方法
1.3.1 样品制备
将现宰的猪肉精细分割,取25 g冷鲜肉样品进行无菌袋包装,放入含冰袋的保温箱中,在3 h内运送到实验室。所有无菌袋包装的样品置于低温培养箱中,分别在-2 ℃和4 ℃中贮藏16 d,于第0、4、8、16天观察并测定各项理化指标。选取0 d与16 d的样品进行蛋白质组学分析。
1.3.2 藏香猪冷鲜肉的冰点测定
用于测定实验的腔室温度设置为(-20.0±1.0)℃。使用数据记录器以1 min的间隔记录温度。当所有探针记录的温度均低于-10 ℃时,将样品从培养箱中取出。藏香猪冷鲜肉的冰点是根据冰点曲线的“高原”初始温度确定的,平衡冰点是发现冷却速度最慢时的温度范围[8]。
1.3.3 总挥发性盐基氮含量的测定
根据GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》测定总挥发性盐基氮(total volatile base nitrogen,TVB-N)含量。
1.3.4 弹性感官评分的测定
参考GB/T 22210—2008《肉与肉制品感官评定规范》对肉弹性进行打分。肉弹性指标评价标准:1)按压肉样表面后立即恢复评分为10 分;2)按压肉样表面恢复较快评分为8 分;3)按压肉样后凹陷恢复缓慢评分为6 分;4)按压肉样后凹陷不能恢复评分为小于4 分;若样品平均分小于6 分,则视为感官不可接受[9]。
1.3.5 蛋白质二级结构的测定
利用FTIR分析总蛋白的二级结构[10]。将真空冷冻干燥48 h后的藏猪肉粉碎成200 目的粉末,准确称量2 mg样品,加入0.1 g干燥无水的溴化钾,用研钵研磨成均匀粉末,压制成薄片进行FTIR分析,数据采集范围在4 000~500 cm-1,每次测定前需扣除空气背景光谱,32 次扫描积累,分辨率为4 cm-1,每个样品测定3 次,取最具代表性的图谱用于分析。
1.3.6 菌落总数测定
菌落总数(total aerobic count,TAC)的测定按照参考Liu Qian等[11]的方法。无菌条件下每个处理组称10 g碎猪肉,用90 mL 0.85 g/100 mL无菌生理盐水匀浆1 min。将1 mL匀浆液加入9 mL 0.85 g/100 mL无菌生理盐水中,连续稀释10 倍。在(36±1)℃下孵育48 h,菌落总数以lg(CFU/g)表示。
1.3.7 蛋白质组学分析
1.3.7.1 蛋白质提取、胰蛋白酶消化及iTRAQ试剂标记
取猪肉(3 g)与1 mL L3裂解液,预冷却、砂浆完全研磨溶解后,转移至环氧树脂试管(1.5 mL)中,超声处理(功率600 W、间隔1.5 s)5 min,于12 000 r/min、4 ℃离心20 min,并收集上清液。取上清液于4 个试管中,每个试管取250 μL,并在-20 ℃下加入1 mL丙酮过夜使其沉淀。将沉淀的蛋白质在4 ℃、12 000 r/min下离心20 min,倒出上清液,干燥,得到加工的蛋白质块。加入适量的裂解液L3以溶解蛋白质,超声溶解(100 W,打开0.8 s、关闭0.8 s,超声4 次,重复溶解一次),在4 ℃、12 000 r/min离心20 min,吸出上清液并转移到新的EP管中。用0.22 μm聚偏氟乙烯膜过滤,获得猪肉总蛋白提取物,用BCA蛋白分析试剂盒测定滤液的蛋白质量浓度。蛋白质的胰蛋白酶消化及iTRAQ试剂标记参考Mi Si等[12]的方法。
1.3.7.2 高pH值反相色谱分级
先用100 μL体积分数95%的A相(20 mmol/L甲酸铵,pH 10.0)和100 μL体积分数5%的B相(含20 mmol/L甲酸铵,pH 10.0)平衡柱子30 min,然后将标记后的混合多肽用100 μL的A相复溶;进样,以0.2 mL/min的流速进行梯度洗脱;梯度洗脱条件为:0~5 min,5% B;5~10 min,5%~10% B;10~60 min,10%~40% B;60~65 min,4 0%~9 5% B;6 5 ~7 5 m i n,保持95% B;75 min~85 min,95%~5% B。整个洗脱过程在214 nm波长处进行监测,从梯度洗脱开始根据峰型收集组分,每管接60 s,反复循环接样;根据峰型和时间共收取10 个组分,真空干燥后,进行第二维反向LC-MS分析。
1.3.7.3 第二维反相LC-MS分析
LC条件:色谱柱为Acclaim PepMap RSLC C18柱,流动相A为1%(体积分数,后同)的甲酸溶液,流动相B为80%的乙腈溶液(含0.1%甲酸)。洗脱条件为:0~5 min,5% B;5~8 min,5%~10% B;8~40 min,10%~30% B;40~45 min,30%~35% B;45~50 min,35%~90% B;50~55 min,保持90% B;55~56 min,90%~5% B;56~65 min,5% B;流速为300 nL/min。
MS条件:一级MS参数:分辨率60 k,最大离子强度400 000,最大注入时间50 ms,扫描范围:350~1 800m/z;二级MS参数:分辨率7.5 k;最大离子强度50 000;最长注入时间80 ms;母离子选择20 个;母离子碎裂方法为高能碰撞解离;碰撞能量32%。
1.3.7.4 蛋白质鉴定和定量
使用Penrot Pilot Software 4.5软件对MS鉴定结果进行合并和数据转换,通过添加反库计算由随机匹配导致的误报率(false positive rate,FDR)。FDR设置为小于1%,并且至少有一种匹配的特异性肽。搜索参数包括:样品类型=iTRAQ 8plex(标记肽);半胱氨酸烷基化=碘乙酰胺;酶=胰蛋白酶。蛋白质阈值大于1.3(相当于≥95%的肽置信度)用作鉴定标准。利用Excel软件对蛋白可信肽段数和覆盖率进行统计,利用Prism Graph软件作图。采用t检验对两个重复进行相对定量分析,以1.5 倍临界值评估蛋白表达的上调和下调,P<0.05表示差异显著。
1.3.7.5 差异表达蛋白分析
采用单变量分析差异倍数和t统计检验进行BH校正得到P值。差异离子同时满足:差异倍数平均值(average,AVG)不低于2.0(或AVG不高于0.5)、P<0.05的蛋白质被认为是差异表达蛋白。
1.3.8 蛋白质印迹分析
使用12%(体积分数,下同)的SDS-十二烷基硫酸钠分离蛋白质样品(20 μg),然后将蛋白质电泳转移到硝酸纤维素膜上。转移后,在室温下用摇床将膜用5%脱脂奶(含0.5% Tris-HCl+0.05% Tween,TBS/T)封闭1 h。按1∶5 000的比例加入一抗(anti-Beclin 1),即6 mL含5% BSA的TBS/T加入1.5 μL抗体,过夜。然后,将膜用TBS/T洗涤3 次(每次10 min)。在室温下用5% BSA以1∶3 000比例稀释的二抗,室温孵育1 h后,将膜在TBS/T中洗涤3 次(每次10 min)。最后,将膜的蛋白质面朝上放置在两层胶片之间,将这两层胶片或其他透明胶片粘贴在曝光盒上。利用ECL化学发光底物试剂盒进行曝光、显影和定影。
1.4 生物信息学与统计分析
为了表征丰度差异蛋白的特性。使用基因本体(gene ontology,GO)(http://www.geneontology.org)进行蛋白质的功能注释。利用京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)途径数据库(http://www.genome.jp/kegg/pathway.html)预测所鉴定蛋白质的主要代谢途径和生化信号转导途径。对于猪肉样品品质的参数结果,使用SPSS 18.0软件的多因素方差分析进行多重比较,所有结果均表示为平均值±标准差,所有猪肉样品使用6 个重复,每个重复进行3 次平行。使用SPSS 18.0软件对猪肉中的丰度差异蛋白与品质指标之间进行Pearson相关分析。
2 结果与分析
2.1 藏香猪冷鲜肉的冰点温度
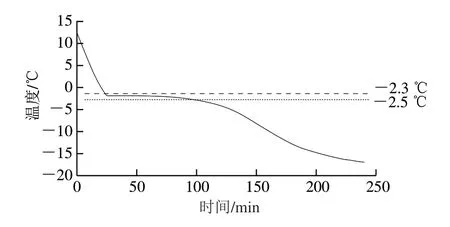
图 1 藏香猪冷鲜肉的冷冻曲线Fig. 1 Freezing curve of chilled Tibetan fragrant pig meat
如图1所示,当温度下降到-2.3~-2.5 ℃时,进入最大冰晶形成区,温度下降极慢,由此测定藏香猪冷鲜肉的冰点为-2.4~-2.5 ℃,低于普通猪肉的冰点(-0.8~-1.2 ℃)[13],主要是这两种猪肉在组成成分的差异所导致,如藏香猪肉氨基酸、蛋白质、不饱和脂肪酸和微量元素相对普通猪肉含量更高[14],高浓度的营养物质可能导致藏香猪更低的冰点,然而,富含营养物质理论上是不利于其贮藏保鲜,冷藏和冰温的表现效果是否存在差异,目前鲜有相关的报道。同时,藏香猪肉较低的冰点温度特点有利于将过冷技术应用到藏香猪冷鲜肉的贮存和保藏中,因为它提供了更宽的工作温度范围,并降低了对保藏设备的要求[15]。
2.2 冰温保鲜条件下藏香猪冷鲜肉理化指标和蛋白质二级结构变化
TVB-N是指蛋白质在酶和细菌的作用下分解,产生挥发性的碱性含氮物质,例如氨、伯胺和仲胺等,其含量是评估肉类新鲜度的重要指标。藏香猪肉冷藏16 d,其TVB-N含量从5.10 mg/100 g(初始值)升高到17.77 mg/100 g,已经超过新鲜肉的限量值(15 mg/100 g)[16-17],而冰温贮藏的藏香猪肉样品TVB-N含量从初始值增加到13.51 mg/100 g,结果表明冰温贮藏对藏香猪冷鲜肉保鲜效果更好(表1),表1中藏香猪冷鲜肉在冰温贮藏和冷藏过程中TAC变化与TVB-N含量变化结果一致。可能归因于冰温相对于冷藏,冷鲜肉内源酶和腐败细菌引发的蛋白质降解反应速率更低,包括核苷酸降解、游离氨基酸的脱氨基、脱羧以及胺类的氧化等反应速率[18],藏香猪冷鲜肉蛋白质降解会导致其质构和风味品质劣化。感官指标是衡量冷鲜肉品质的一种最直接、重要的指标,能够影响消费者的购买意向[19]。藏香猪冷鲜肉弹性随着贮藏时间的延长,呈现逐渐下降的趋势,但冷藏条件下降更快。猪肉蛋白质的二级结构决定了其功能特性,蛋白质的二级结构与肉的整体品质密切相关[20]。酰胺I带(1 700~1 600 cm-1)是蛋白质二级结构变化的敏感区域,吸收峰最强,经常被用于分析蛋白质二级结构[21]。本研究结果表明在冰温和冷藏16 d条件下,藏香猪肉样中蛋白质二级结构主要表现为β-折叠和β-转角变化,而α-螺旋和无规卷曲相对含量虽然也变化,但变化不显著(数据未展示),冰温贮藏过程中藏香猪冷鲜肉蛋白质β-折叠和β-转角相对含量变化不显著(P>0.05),冷藏过程中β-折叠相对含量变化显著,β-转角相对含量变化虽然不显著,但比冰温贮藏组变化大,说明藏香猪肉在冰温贮藏条件下蛋白质二级结构较冷藏条件更稳定,导致蛋白质二级结构被破坏的程度较低,对冷鲜肉质地结构起到较好的保护作用[22]。
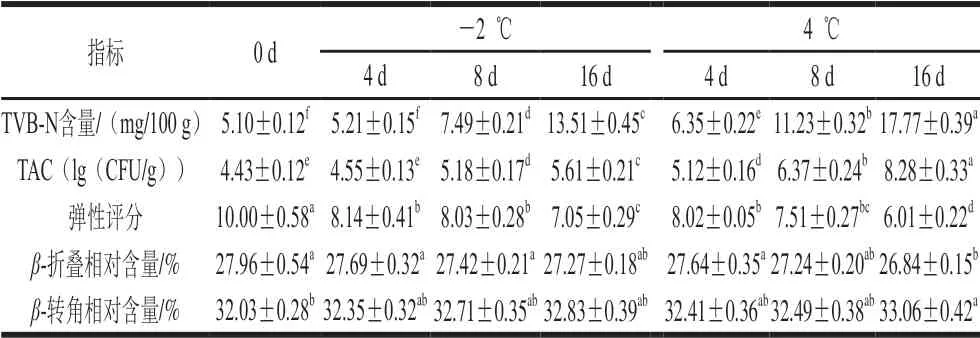
表 1 藏香猪冷鲜肉在不同贮藏温度下的TAC、理化品质和蛋白质二级结构变化Table 1 Changes in TAC, physicochemical quality and protein secondary structure contents in chilled Tibetan fragrant pig meat stored at different temperatures
2.3 定量蛋白质组学分析结果
对采用定量蛋白质组学分析获得的数据进行过滤后,总共匹配了4 756 个蛋白质,并将它们映射到1 197 个可信赖的蛋白质上。在所有鉴定出的蛋白质中,约71.7%的蛋白质包含至少两个肽(图2A)。此外,鉴定出的蛋白质具有较高的序列覆盖率,鉴定出67.57%的蛋白质具有超过5%的序列覆盖率,鉴定出43.48%的蛋白质具有超过10%的序列覆盖率(图2B)。肽段长度显示大多数肽段长度在6~17范围内(图2C);肽段长度超过11后,随着肽段长度的增加,肽段的数量变得越来越少。
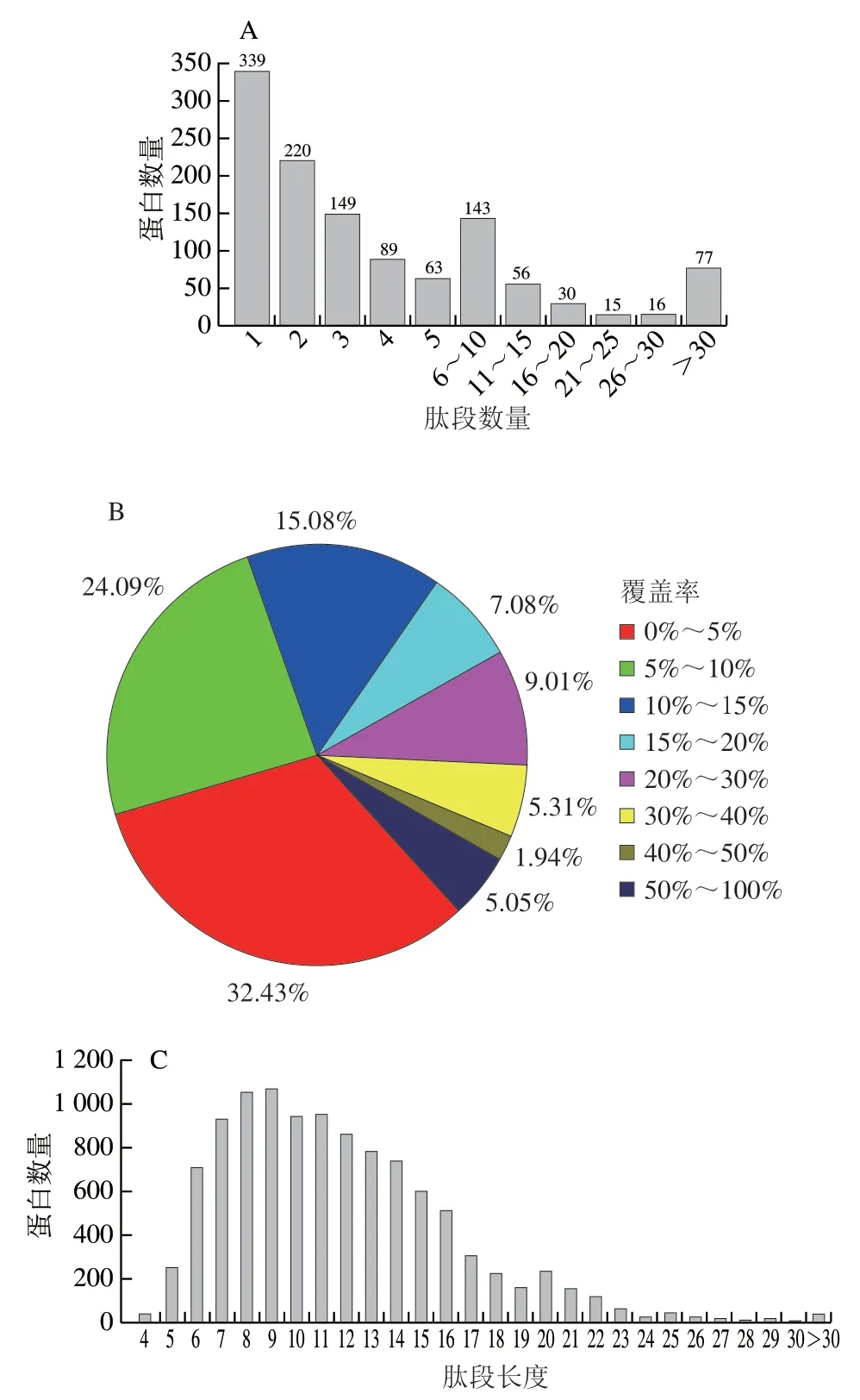
图 2 藏香猪冷鲜肉定量蛋白质组学分析结果Fig. 2 Results of quantitative proteomics analysis of chilled Tibetan fragrant pig meat
2.4 丰度差异蛋白的鉴定和比较结果
基于“AVG≥2.0或AVG≤0.5,且P<0.05”的两个标准鉴定了丰度差异蛋白。与0 d肉样品相比,在-2 ℃和4 ℃下16 d的肉样品中共有179 个蛋白质丰度发生了显著变化。-2 ℃16 d/0 d和4 ℃16 d/0 d比较分别有143 个丰度差异蛋白和97 个丰度差异蛋白,包括61 个共有的丰度差异蛋白(图3A)。考虑到猪肉蛋白质组在两种温度条件下变化的复杂性,本研究拟从其重叠的61 种丰度差异蛋白变化规律中寻找温度对猪肉品质影响的共同规律和分子机制。
2.5 重叠丰度差异蛋白的生物信息学分析结果
GO分析结果如图3B和图3C所示。在生物过程中,重叠丰度差异蛋白质主要参与解剖结构发育、生物合成过程和细胞分化;在分子功能分类中,重叠丰度差异蛋白质主要功能涉及离子结合、细胞骨架蛋白结合以及结构分子活性等;在细胞组成中,重叠丰度差异蛋白质主要分布在细胞质、细胞骨架以及含蛋白质复合物中。利用KEGG数据库的分析结果如图3D和图3E所示,结果表明,重叠丰度差异蛋白质主要涉及代谢通路、肌肉扩张障碍、钙信号通路等途径。根据结果可以推测,冷鲜肉在贮藏过程,其细胞质或者细胞骨架中与细胞结构相关蛋白分子功能发生变化,导致它们参与的代谢、结构功能以及信号转导功能发生障碍,而蛋白质和代谢酶作为猪肉组织中重要组成部分,其结构、分子功能和分布的变化必然会影响到肉的色泽、质构等品质,譬如肌红蛋白结构变化就会影响肉的色泽变化和质构变化。而这种变化非常容易受到贮藏温度和微生物的影响,因此,通过对贮藏猪肉重叠丰度差异蛋白的生物信息学分析,宏观掌握贮藏猪肉品质变化过程中所涉及的生物过程、分子功能和相关蛋白的分布,进而推测肉品质变化的可能分子机制以及受到的影响原因。

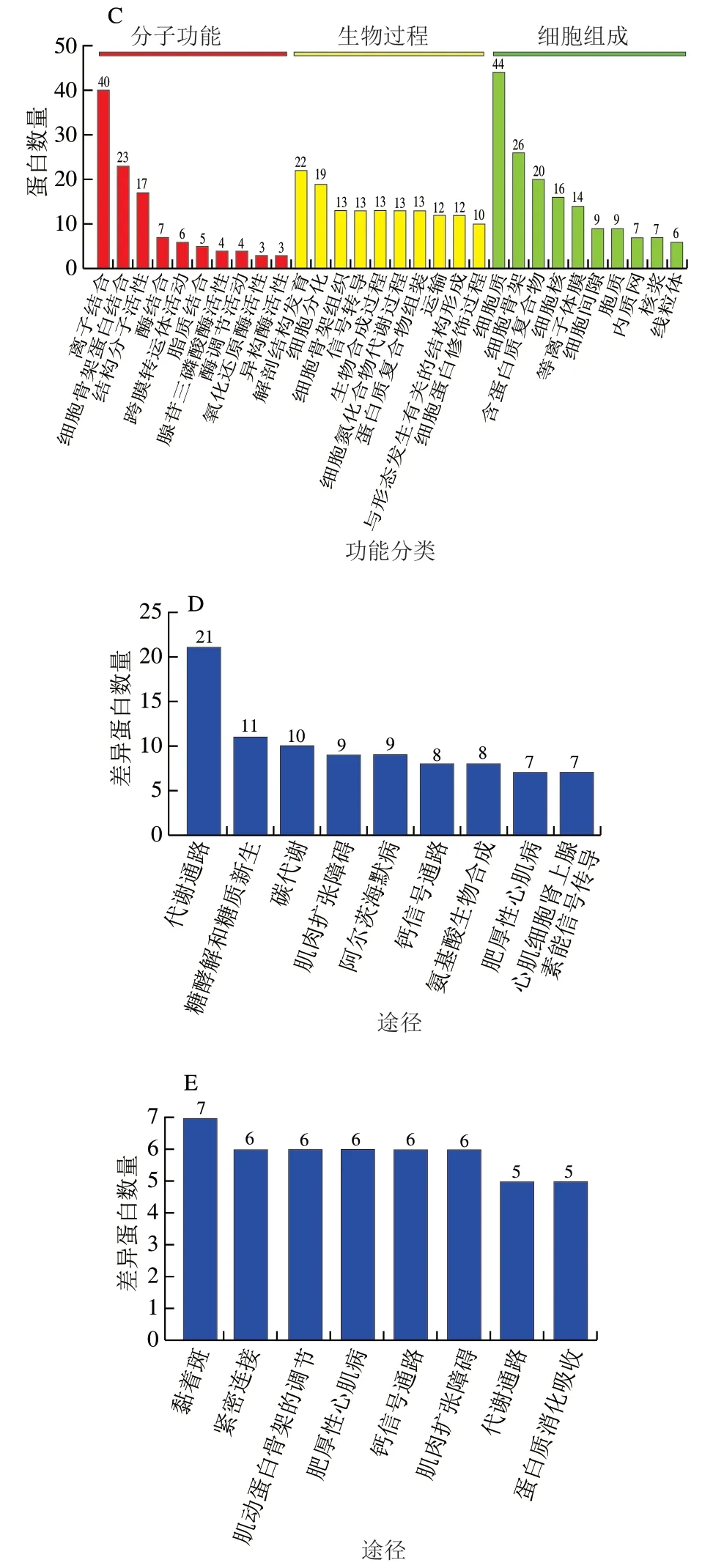
图 3 藏香猪冷鲜肉在-2 ℃和4 ℃条件下贮藏16 d后与0 d相比的蛋白差异表达Fig. 3 Analysis of differentially expressed proteins in chilled Tibetan fragrant pig meat stored at -2 and 4 ℃ for 16 days
2.6 藏香猪冷鲜肉中丰度差异蛋白与微生物指标、理化品质及蛋白质二级结构变化的相关性
目前,蛋白质组学应用肉类研究成为一个研究热点,Yu Qianqian等[23]采用蛋白质组学技术研究牛宰后肉品质变化规律,基于蛋白质分子水平一定程度解释了牛肉成熟机制。然而,动物宰后成熟阶段与其冷鲜肉贮藏过程是两个完全不同过程,贮藏肉的质构、贮藏环境条件以及表面微生物数量与成熟阶段肉存在巨大差异;因而,动物宰后成熟阶段蛋白质组学研究结果并不能用于解释冷鲜肉在贮藏过程的品质变化机制。藏香猪肉与普通猪肉的组成差异明显,而其他品种猪肉的蛋白质组学研究成果参考性非常有限,因此,基于蛋白组学技术研究藏香猪肉在冰温和冷藏贮藏过程中品质变化机制,可以补充相关研究的不足。为了进一步验证上述推测,利用Pearson相关性分析法对重叠丰度差异蛋白与冷鲜肉的微生物指标、品质特性(TVB-N含量和弹性)和蛋白质二级结构(β-折叠相对含量和β-转角相对含量)进行相关性分析(表2),旨在初步探明藏香猪肉冰温保鲜的分子机制。结果表明:这些丰度差异蛋白根据特定功能分为5 类:结构蛋白(39.3%)、代谢酶(11.5%),应激蛋白(8.2%),钙调节蛋白(16.4%)和其他蛋白(24.6%),其与冷鲜肉的微生物指标、品质特性(TVB-N含量和弹性)和蛋白质二级结构(β-折叠和β-转角相对含量)整体上存在显著相关性。

表 2 藏香猪冷鲜肉中丰度差异蛋白表达量与TAC、品质(TVB-N含量和弹性)、蛋白质二级结构(β-折叠和β-转角相对含量)的相关性Table 2 Correlation of differentially expressed proteins in chilled Tibetan fragrant pig meat with TAC, quality traits (TVB-N content and springiness)and protein secondary structure (β-sheet and β-turn contents)
2.6.1 结构蛋白
结构蛋白对猪肉组织结构、质构以及色泽起着重要的作用。肌球蛋白在调节收缩、细胞内囊泡递送、细胞迁移、胞质分裂和维持细胞形态中起重要作用[23]。研究结果表明,结构蛋白中肌球蛋白-1、慢型-肌球蛋白结合蛋白C、肌球蛋白-4、肌球蛋白-2、原肌球蛋白α-1链和原肌球蛋白α-3链表达量均与肉的弹性和β-折叠相对含量呈极显著正相关(P<0.01),与TVB-N含量、TAC和β-转角相对含量呈显著(P<0.05)或极显著负相关(P<0.01)(表2)。这说明猪肉贮藏过程中其肌球蛋白经历降解,蛋白质β-折叠相对含量降低,β-转角相对含量增加,肉的弹性降低,导致肉的质构品质变差,而这种质构品质变化主要受到贮藏温度和冷鲜肉TAC的影响。从上述结构蛋白在冰温(-2 ℃)和冷藏(4 ℃)两种温度条件下差异表达情况可知,冰温更利于结构蛋白的保持,可能原因在于冰温更利于控制腐败微生物对蛋白质的降解,本研究藏香猪冷鲜肉在贮藏过程结构蛋白变化规律一定程度解释了其品质变化规律。Shi Jing等[24]研究也表明,肉肌球蛋白在肉贮藏过程降解越快,其质构、风味以及色泽等品质下降越快。
2.6.2 代谢酶
本研究分析了α-1,4-葡聚糖磷酸化酶、4-α-葡糖基转移酶、AMP脱氨酶、磷酸甘油酸突变酶、UTP-1-磷酸葡萄糖尿酰转移酶等代谢酶与藏香猪冷鲜肉的品质特征的相关性,结果表明,α-1,4-葡聚糖磷酸化酶和4-α-葡糖基转移酶的表达量均与TVB-N含量、β-转角相对含量呈显著(P<0.05)或极显著(P<0.01)负相关,与肉弹性指标和β-折叠呈现显著正相关(P<0.05)(表2),α-1,4-葡聚糖磷酸化酶促进肉糖原分解,4-α-葡糖基转移酶将分解的糖基转移到蛋白质上,且在冰温条件下这两种代谢酶的表达量显著高于冷藏条件,说明冰温贮藏能为冷鲜肉正常生理代谢提供必要的能量,抑制蛋白质分解生成胺基,冰温条件能较好地保持蛋白质结构,维持冷鲜肉的弹性指标和蛋白质二级结构。AMP脱氨酶表达量与TVB-N含量、TAC呈极显著正相关(P<0.01),与冷鲜肉其他品质指标相关性较低,且在冷藏条件下其表达量高于冰温条件,说明冰温条件抑制腺苷一磷酸被AMP脱氨酶催化降解成NH3和肌苷酸[25],有利于冷鲜肉贮藏保鲜。磷酸甘油酸突变酶表达量与TVB-N含量呈极显著负相关(P<0.01),与TAC呈极显著正相关(P<0.01),与冷鲜肉其他品质指标相关性较低,且在冰温条件下其表达量高于冷藏条件,说明冰温条件更好地维持冷鲜肉碳代谢,有利于冷鲜肉贮藏保鲜。
2.6.3 应激蛋白
应激蛋白又称为热休克蛋白,是在高热、缺血、缺氧和其他应激条件下由变性蛋白诱导产生的,其表达量能反映细胞受到外界的刺激水平[26-27]。热休克蛋白beta-7和热休克蛋白家族B(小)成员6这两种热休克蛋白的表达量与TVB-N含量、TAC呈极显著正相关(P<0.01),与β-转角含量呈显著正相关(P<0.05),与肉弹性和β-折叠相对含量呈现显著(P<0.0 5)或极显著(P<0.01)负相关(表2),且在冰温条件下其表达量低于冷藏条件,说明冰温条件对藏香猪冷鲜肉细胞刺激水平更低,受到微生物污染更轻,能够减少蛋白质变性酶解,从而维持冷鲜肉的弹性指标和蛋白质二级结构,达到贮藏保鲜的效果。
2.6.4 钙调节蛋白
肌钙蛋白是肌肉组织收缩的调节蛋白,位于收缩蛋白的细肌丝上,在肌肉收缩和舒张过程中起着重要的调节作用,Bekhit等[28]发现鲜绵羊肉于5~35 ℃真空贮藏过程中,其肌肉中的肌钙蛋白(肌钙蛋白I、肌钙蛋白T和肌钙蛋白C)表达量上调,说明肌肉细胞受到损伤,表明蛋白一定程度发生降解。肌钙蛋白T和结构蛋白等细胞骨架蛋白与肉质性状息息相关,已知存在于骨骼肌中[29]。本研究结果表明,肌钙蛋白I、肌钙蛋白T、肌钙蛋白C表达量均与TVB-N含量和β-转角相对含量呈极显著负相关(P<0.01),与肉弹性和β-折叠相对含量呈现显著(P<0.05)或极显著(P<0.01)正相关,且在冰温条件下其表达量低于冷藏条件,说明藏香猪冷鲜肉细胞在冰温条件下受到损伤少,肌肉弹性和蛋白质二级结构仍然保持较好。钙蛋白酶抑制蛋白是一种广泛分布的内源性抑制蛋白质,能特异地抑制需钙激活的中性蛋白酶,其分子结构中每个钙抑素分子均包含1 个前导(L)域和4 个抑制域(I~IV),每个抑制域均可以抑制1 个钙蛋白酶分子表达[30-31]。钙蛋白酶抑制蛋白表达量与TVB-N含量和β-转角相对含量呈极显著负相关(P<0.01),与肉弹性和β-折叠相对含量呈显著(P<0.05)或极显著(P<0.01)正相关,且在冷藏条件下该蛋白表达量为冰温条件下的2.33 倍,说明冷藏条件下发生更为剧烈的蛋白质酶解反应,冷鲜肉由于自身存在免疫系统,会诱导钙蛋白酶抑制蛋白表达量上调。上述结果一定程度上反映藏香猪冷鲜肉在冰温条件下蛋白质分解速率更慢,有利于抑制腐败微生物增殖和蛋白分解产生胺基,较好地保持肉弹性和蛋白质二级结构,起到较好的贮藏保鲜效果。
2.6.5 其他蛋白
在其他蛋白中,半胱氨酸和甘氨酸富集蛋白3在细胞胞浆结构组织中起着关键的作用,其表达量与TVB-N含量、TAC和β-转角相对含量呈极显著正相关(P<0.01),与肉弹性和β-折叠相对含量呈现极显著负相关(P<0.01)(表2),且冰温条件表达量远低于冷藏条件,一定程度说明冷藏条件冷鲜肉细胞结构变化更大,尽管冰温和冷藏条件下细胞自身存在免疫系统,但冷藏条件其受到更多逆环境(相对较高温度、微生物等)作用,可能会导致半胱氨酸和甘氨酸富集蛋白3表达量更高。
2.7 蛋白质印迹验证结果
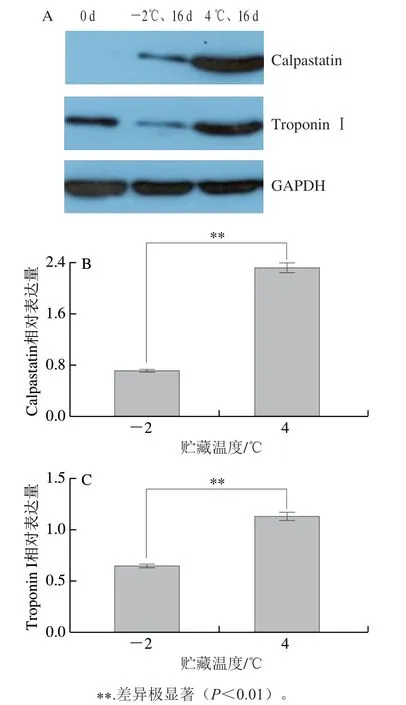
图 4 冷鲜猪肉在贮藏期间Western Blot分析(A)及不同贮藏温度条件下Troponin I(B)和Calpastatin(C)差异表达Fig. 4 Western blot analysis (A) of troponin I and calpastatin in chilled fragrant pig meat during storage and their differential expression levels (B, C) at different storage temperatures
为了验证研究中iTRAQ观察结果,本实验选择了具有代表性的两种重叠差异蛋白质(Troponin I和Calpastatin)进行蛋白质印迹分析。如图4所示,Western Blot印迹分析结果表明,与0 d相比,藏香猪冷鲜肉中Troponin I和Calpastatin在16 d时的相对表达量明显增加,但冷鲜肉在冷藏条件下这两种蛋白相对表达量更高,这与表2分析结果高度一致,一定程度上反映本蛋白质组学分析方法可靠性较高,同时也说明贮藏温度显著影响冷鲜肉蛋白质表达,进而造成肉品质的差异。
3 结 论
藏香猪冷鲜肉的冰点温度为-2.4~-2.5 ℃。贮藏过程中,冰温条件猪肉TAC、TVB-N含量、弹性及蛋白质二级结构变化明显低于冷藏条件,与0 d肉样品相比,在两种贮藏条件下共有179 个蛋白质丰度发生了显著变化,其中共有丰度差异蛋白61 个,这些蛋白质主要分为结构蛋白、代谢酶、应激蛋白和钙调节蛋白,这些共有丰度差异蛋白与猪肉理化品质及蛋白质二级结构之间正体上具有显著相关性,可以作为潜在生物标记物来标记猪肉贮藏品质优劣。初步推测冰温保鲜机制在于,相对于冷蔵保鲜,冰温保鲜更好抑制冷鲜肉微生物增长,降低了猪肉蛋白质(如Troponin I和Calpastatin)表达量,特别是能降低腐败微生物对肉蛋白质二级结构的影响,从而较好保持猪肉理化和质构品质。本研究从蛋白质分子水平初步解释了冰温贮藏保鲜的分子机制,研究成果可为合理设计冷鲜肉贮藏条件提供参考。
