褐藻胶降解过程及链剪切模型的研究
2021-03-18陈佳薇陈静静
陈佳薇 , 陈静静 , 张 涛 , 江 波 *,2
(1.江南大学 食品学院,江苏 无锡 214122;2.江南大学 食品安全国际联合实验室,江苏 无锡 214122)
大量研究已证明褐藻胶作为水溶性膳食纤维,具有抗菌、降血糖等生理特性[1-3]。 但天然褐藻胶是一种生物大分子, 相对分子质量集中在4×105~8×106, 即使在低浓度下形成的溶液黏度也很高,流动性与适口性差,使其无法应用到食品体系中发挥重要生理特性。 与天然褐藻胶相比,低相对分子质量的褐藻胶不仅具有一定的成膜性,可减缓碳水化合物的吸收速度,同时具有较好的调节肠道菌群并可作为水溶性膳食纤维等特点[4]。 此外,多糖相对分子质量分布宽度也是影响其生理特性的重要参数。因此,低相对分子质量及相对分子质量分布范围较窄的褐藻胶的研究可为开发新功能性食品配料提供理论依据。
现在绝大多数的研究都集中在褐藻胶裂解酶上,且关于褐藻胶的降解方式大多利用物理或化学方法如伽马射线法、超声法、酸解法、氧化法,但降解效率低,反应后期易发生糖链聚集[5-6]。 生物酶解法相比于物理化学法,反应条件温和,高效,且不会生成有害副产物[7]。 本实验中,褐藻胶裂解酶来源于需钠弧菌(Vibrio natriegens),是一种内切酶,通过β-消除反应作用于 O-β-1,4 糖苷键,并同时在 C4、C5 之间形成不饱和双键。纤维素酶是一种复合酶体系,内切型葡聚糖酶(EG)可降解纤维素分子的内糖苷键O-β-1,4 糖苷键,迅速降低聚合度并产生外切型纤维二糖酶(CBH)作用的新链端,CBH 则以切割末端的纤维素链以释放可溶性纤维二糖或葡萄糖。利用纤维素复杂的多酶体系,将其作为辅酶探究是否与褐藻胶裂解酶有高效地协同作用,增加纤维素酶的应用范围,为探究低相对分子质量、窄相对分子质量分布范围的褐藻胶制备方式提供更多选择。
关于可控酶解探究中酶解时间、 加酶量范围,不同酶解作用方式对产物相对分子质量特性的影响与酶解历程中酶与糖链分子间的链剪切行为密切相关。 因此,深入观测酶解历程中链剪切行为有助于明确各降解条件范围,获得相对分子质量特性满足生理特性需求的系列褐藻胶降解产物。 目前关于纤维素、瓜尔胶和魔芋葡甘聚糖与各自特异性酶在酶解历程中分子间的链剪切模型研究已有报道,而关于褐藻胶链剪切模型的研究仍是空白[9-10]。作者通过GPC-MALLS 法了解了酶解历程中褐藻胶降解物相对分子质量及相对分子质量分布的变化规律,阐明了褐藻胶在两种酶作用下的链剪切模型,以及两种酶在酶解历程中对相对分子质量分布的变化规律,确定了满足生理特性需求的系列褐藻胶降解产物的降解条件,为褐藻胶作为膳食纤维增补剂在食品中的应用提供依据。
1 材料与方法
1.1 材料与仪器
褐藻胶:青岛双城有限公司提供;褐藻胶裂解酶:作者实验室制备;纤维素酶:国药集团化学试剂有限公司产品。
DAWN HELEOS Ⅱ 多角度寂光检测器: 美国怀雅特技术公司产品;Triad 冻干机:美国Labconco公司产品;Milli-Q Integral Cabinet 3 超纯水系统:美国密里博公司产品;VISCO 黏度计: 日本爱宕公司产品;透析袋:江苏博美达生命科学有限公司产品。
1.2 试验方法
1.2.1 酶的制备海藻酸钠液体培养基:8 g/L 海藻酸钠,8 g/L NH4Cl,30 g/L NaCl,1 g/L MgSO4·7H2O,1 g/L CaCl2,2 g/L K2HPO4,0.05 g/L MnSO4·H2O,上述所有试剂溶解于去离子水中,并在121 ℃,灭菌20 min。 海藻酸钠液体培养基既是种子液也是发酵液。 野生菌株需钠弧菌以体积分数2%接种于种子液,28 ℃、200 r/min,连续培养 12 h。 接着种子液以体积分数2%接种于发酵液,37 ℃、200 r/min, 连续培养24 h。发酵液6 200 g,离心10 min,所得上清液为褐藻胶裂解酶粗酶液,贮藏于4 ℃冰箱中用于后期分析实验。 纤维素酶粉末溶解于pH 7 的磷酸盐缓冲液中,配置成1 mg/mL 的酶液,贮藏于4 ℃冰箱中待后期实验使用。
1.2.2 酶活测定褐藻胶裂解酶酶活通过DNS 法测定。 DNS 配方:1 L 体系中,45 ℃加热溶解 185 gC4O6H4KNa,6.35 g DNS,21 g NaOH,5 g C6H5OH,5 g Na2SO3。 溶液配置后,稳定一星期后使用。
配置不同质量浓度的无水葡萄糖标准溶液:0、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mg/mL。 取 0.3 mL 葡萄糖标准溶液,加入1 mL DNS,沸水中反应10 min,待冷却后,加入 1 mL 水。 以 0 号管为空白,在550 nm 波长下,测定吸光度。 以葡萄糖质量浓度为横坐标,吸光值为纵坐标,绘制标准曲线。 得到回归方程:y=1.338x-0.231 6,R2=0.998。
褐藻胶裂解酶酶活性单位(IU)定义为在分析条件下,每毫升粗酶液每分钟从底物中释放1 μmol还原糖所需的酶量。 纤维素酶活力酶活性单位(IU)定义为在分析条件下,每毫升的酶液每分钟从底物中释放1 μmol 还原糖所需的酶量。
1.3 反应体系制备
褐藻胶溶解于pH 7 的磷酸盐缓冲溶液中,配置成质量分数为1%的褐藻胶溶液。 反应体系为150 mL,置于250 mL 的酶反应器中,转速600 r/min,预热至反应温度35 ℃。
1.4 一步加酶法对褐藻胶降解程度影响
研究不同加酶量对褐藻胶降解程度的影响。 定时取样,反应液沸水中煮沸10 min 灭活,透析,冷冻干燥,测定褐藻胶在不同降解时间的降解程度。
1.5 分步加酶法对褐藻胶降解程度影响
褐藻胶裂解酶每次加酶量为2.56 U/g, 研究4种加酶方式对褐藻胶降解程度的影响。 定时取样,反应液沸水中煮沸10 min 灭活,透析,冷冻干燥。加酶方式如表1 所示。
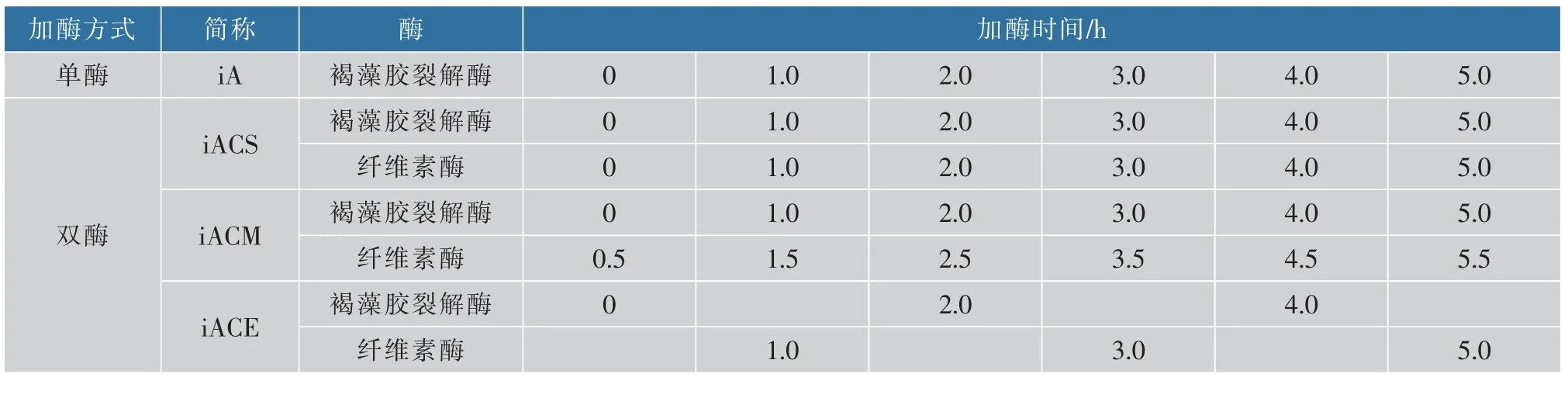
表1 分步水解法加酶方式Table 1 Enzymatic addition methods of interval hydrolysis
1.6 相对分子质量参数测定
相对分子质量 (Mw,Mn) 及分散系数 (PDI)由GPC-MALLS 测 定 。 采 用 Ultrahydrogel 2000 和Ultrahydrogel 500 两根柱子串联,样品质量浓度5 mg/mL,0.22 μm 滤膜过滤,进样量 200 μL,流动相为 0.1 mol/L 的 NaNO3溶液, 流量 0.6 min/mL,柱温箱温度35 ℃。
2 结果与分析
2.1 褐藻胶裂解酶一步法重均相对分子质量变化
酶解反应时间控制在6 h,反应温度35 ℃,图1显示了褐藻胶裂解酶一步法降解方式对天然褐藻胶相对分子质量的影响。在2 h 反应时间内,产物的相对分子质量整体随酶活增加而降低,说明水解程度随酶活增加而升高。 酶添加量2.56 U/mg 和3.84 U/mg 水解所得产物的相对分子质量无明显差异,结果见表2。图2 显示,酶添加量对褐藻胶降解程度的影响。反应进程控制在2 h 内时,随着酶活的增加降解程度升高,相对分子质量间差异明显;反应进程控制在2 h 以上时, 随着酶活的增加降解程度变化趋势缓慢,当酶添加量高于5.12 U/mg 时,降解程度趋于平缓,相对分子质量间无明显差异甚至出现相对分子质量略微上升的趋势。 Zhang 等人在研究纤维素酶水解纤维素过程中也出现相同现象[8],是因为反应体系中始终存在未水解或者难水解的大分子片段多糖链[9-10]。结合表2 中相对分子质量及相对分子质量分散系数的变化, 在相同反应时间内,随反应时间延长至2 h 以上, 相对分子质量与酶添加jgjf 的正相关关系变弱, 且相对分子质量分布范围变宽,这可能是因为随着加酶量的增加,褐藻胶裂解酶与难水解的大相对分子质量片段结合,增加了体系中高相对分子质量组分[11]。
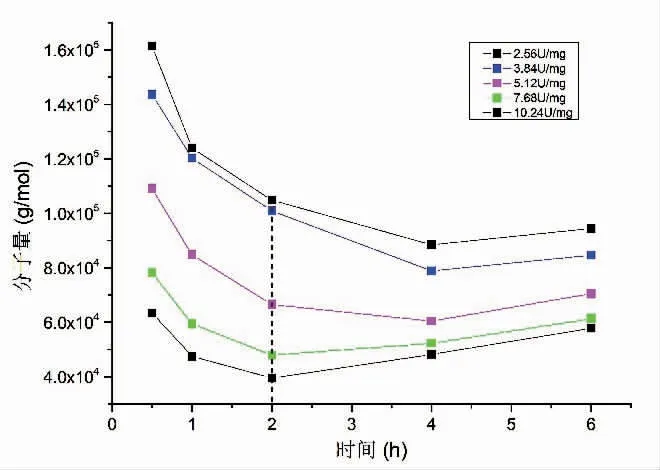
图1 褐藻胶裂解酶一步法反应时间对降解产物相对分子质量的影响Fig.1 Effect of reaction time on the molecular weight of hydrolysates by alginate lyase one step hydrolysis
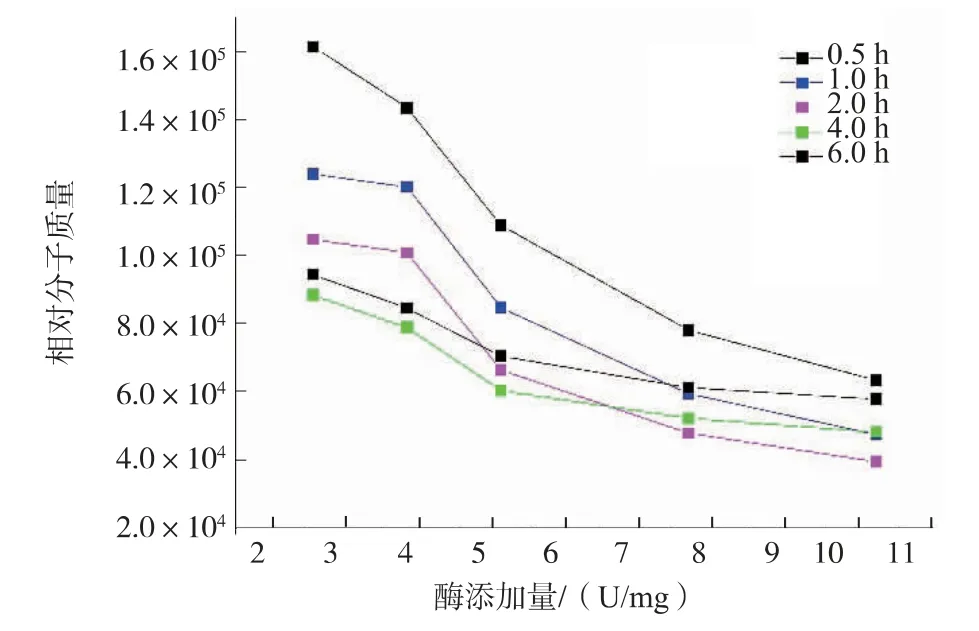
图2 褐藻胶裂解酶一步法酶添加量对降解产物相对分子质量的影响Fig.2 Effect of enzymati cactivity on the molecular weight of hydrolysates by alginate lyase one step hydrolysis
2.2 分步法重均相对分子质量变化
分步法按照表1 所示加酶,4 种分步加酶降解过程中相对分子质量的变化情况如图3 所示,具体数据如表2 所示。 褐藻胶裂解酶分步降解过程中,随着反应时间的增加,相对分子质量始终保持下降的趋势。 1 h 内产物降解程度较低,重均相对分子质量为467 900, 与褐藻胶初始相对分子质量相比无明显差异。反映进程在2 h 和3 h 时降解程度增加,相对分子质量分别降至247 000 和148 500,相对分子质量分别相比于上一阶段下降2.0 倍和1.6 倍。反应进程在4~5 h 时降解程度减缓, 相对分子质量相较于上一阶段均下降0.78 倍,最终在6 h 相对分子质量变化程度趋于平缓。 反应初始阶段相对分子质量变换缓慢是因为酶是一种生物大分子,褐藻胶溶液在水溶液中会形成凝胶网络结构,且反应初始阶段加入的酶活较低,影响生物大分子酶与褐藻胶糖链的充分接触,从而使得初始阶段降解缓慢。
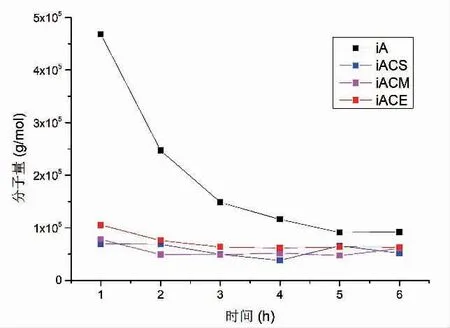
图3 分步法相对分子质量-时间变化曲线Fig.3 Effect of reaction time on the molecular weight of hydrolysatesby interval hydrolysis methods
与褐藻胶裂解酶分步法相比,双酶降解过程中3 种加酶方式iACS、iACM、iACE 在反应初始阶段降解速率明显高于褐藻胶裂解酶单酶分步降解,相对分子质量在 1 h 内分别下降 5.8,5.1 和 3.5 倍,而反应进程延长至1 h 以上,3 种加酶方式下相对分子质量随反应时间的增加,产物相对分子质量间波动较小。 从1 h 内相对分子质量变化可以得出纤维素酶可以高效协同褐藻胶裂解降解大分子糖链,其中iACS 同步加酶的方式水解效率最高, 其次是iACM和iACE。但在1 h 后两者协同水解效率发生迅速下降,这可能是因为反应体系中不同相对分子质量组分发生变化,从而影响纤维素酶与褐藻胶裂解酶对不同组分的选择优先性,具体情况需进一步分析相对分子质量分布变化规律。
2.3 褐藻胶裂解酶产物相对分子质量分布变化
依据表2 获得的数均相对分子质量(Mn)和重均相对分子质量(Mw),关于水解过程中产物的分散系数PDI 可以计算出来。这里使用Cooper 提供的关于Mn和Mw的具体计算方法作为参考[12]。
重均相对分子质量主要受到高相对分子质量组分的影响,而数均相对分子质量主要受到低相对分子质量组分的影响。 故水解过程中Mw和Mn的变化趋势以及分散系数的变化是酶与糖链剪切行为在产物相对分子质量变化角度上的体现。 基于以上理论,通过图4、表2 和表3 可以推断褐藻胶裂解酶在降解过程中的链剪切行为。 褐藻胶初始分散系数为 1.75,相对分子质量范围在 0.1×106~8×106,其中质量分数 2×105~6×105占 90%。 图4 是褐藻胶裂解酶分步法中产物相对分子质量分布图, 更能直观体现出链剪切模型在相对分子质量上的变化规律。 随着褐藻胶裂解酶的加入, 在反应1 h 时出现了低相对分子质量组分 Mw<1×105。 随着酶的再次加入,产物的低相对分子质量组分交替出现, 相对分子质量中 Mw<1×105的组分被水解至更小, 超出 GPCMALLS 检测下限,无法显示在图中。 整个反应过程中分散系数整体是呈现上升趋势, 并始终高于初始值,这种变化与链非随机剪切模型相似,Banks 等对纤维素与纤维素酶的非随机剪切模型研究中也呈现类似现象[13]。 非随机剪切模型主要是因为酶对底物的单次剪切和多次剪切的结合, 单次剪切指酶与底物每次接触只剪切一个底物分子一个糖苷键; 多次剪切是指酶对一个底物分子一次剪切后, 仍然存留在该底物上并继续对已断裂的底物进行多次剪切。褐藻胶质量分数已超过缠结质量分数, 形成密度不均匀的凝胶网状结构, 使得褐藻胶裂解酶无法自由扩散。随着低相对分子质量出现,酶在该组分间的扩散速率增加,剪切概率增加,故出现低相对分子质量累积现象。Ballauff 等指出酶分子与糖链的相互作用机制与中央剪切规律非常接近, 即酶对底物糖苷键的剪切存在中央优先的特点[14]。 Cheng 等也指出酶分子对瓜尔豆胶的链剪切模型为中央剪切[15]。 本实验中褐藻胶裂解酶与褐藻胶的链剪切模型属于多次剪切模型和中央剪切模型的结合,且组分水解优先性伴随着糖链分子尺寸变化而变化。 如图5 所示,初始阶段通过中央剪切和多次剪切的方式迅速水解 Mw>1×105的相对分子质量多糖链, 当 Mw≤1×105的组分增加时, 褐藻胶裂解酶优先吸附该类多糖,少部分吸附于未水解长链多糖进行非随机型剪切。 随着Mw≤1×105组分多糖进一步水解至低于Mw<1×104,其溶液中扩散速率增加,不易与酶发生有效碰撞,故酶与扩散速率慢的大分子糖链结合进行剪切。
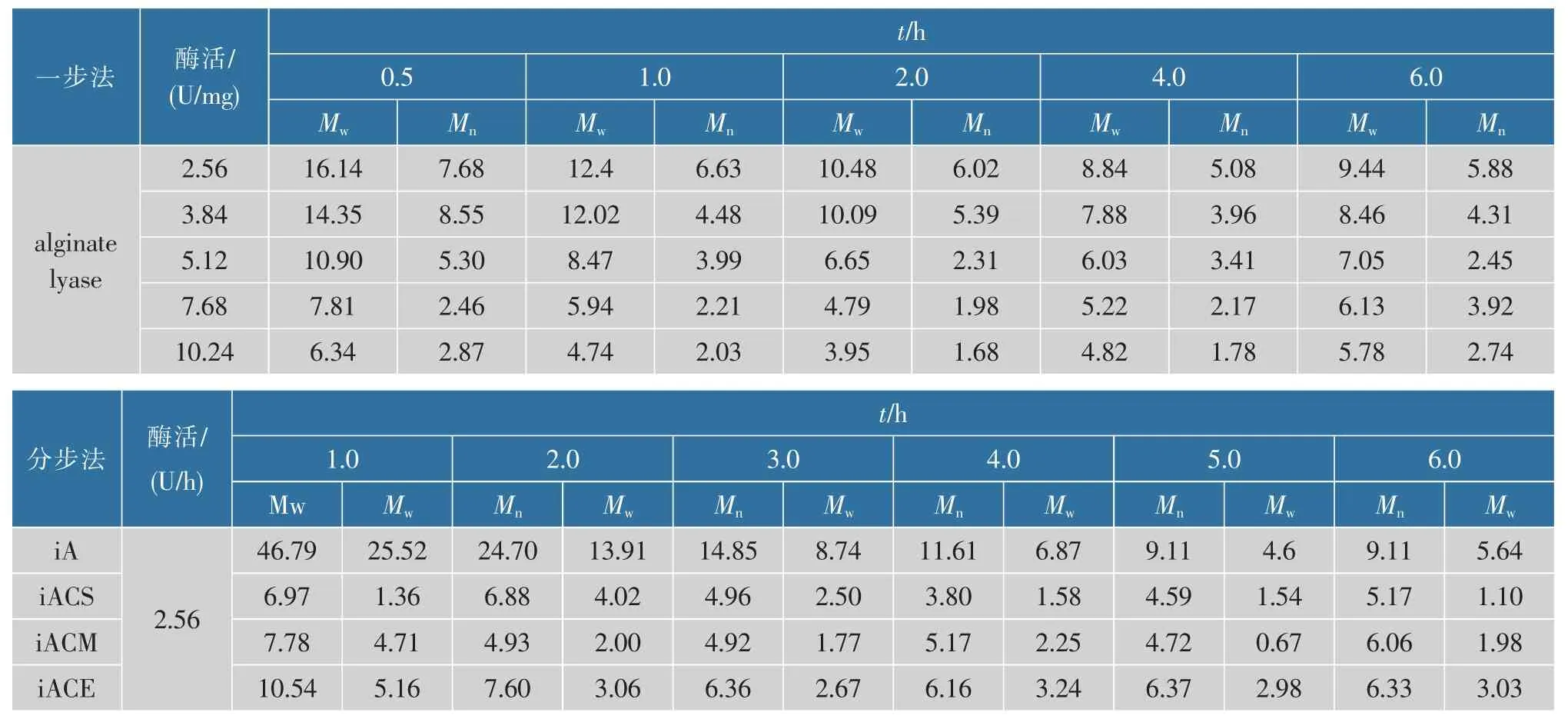
表2 不同降解方式对相对分子质量的影响Table 2 Effect of different hydrolysis methods on the molecular weight of hydrolysates×105
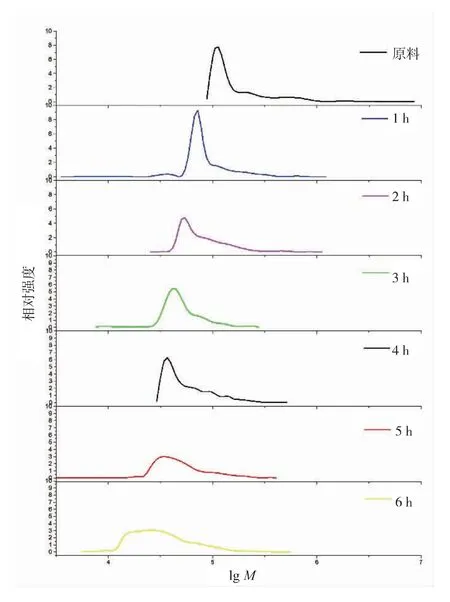
图4 褐藻胶裂解酶分步法相对分子质量分布图Fig.4 Molecular weight distribution of alginate lyase interval hydrolysis
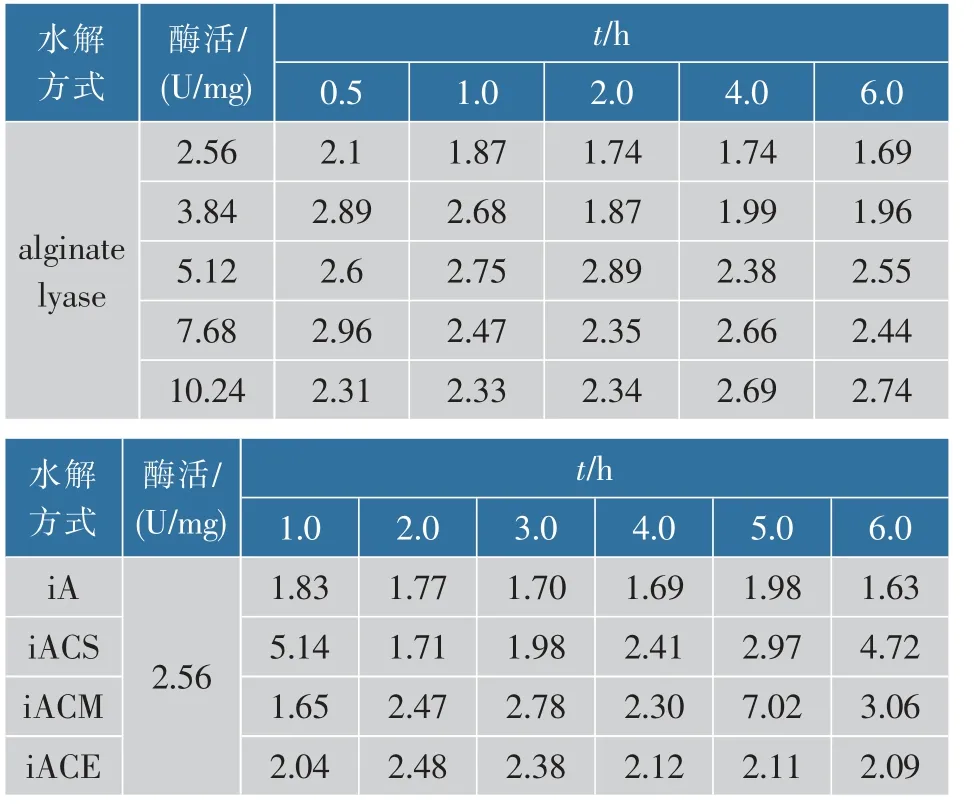
表3 不同水解方式对分散系数的影响Table 3 Effect of different hydrolysis methods on the molecular weight distribution of hydrolysates
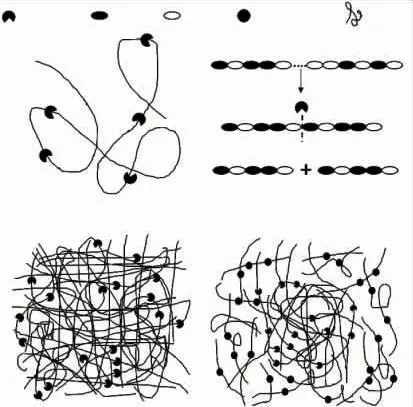
图5 褐藻胶在两种酶作用下的链剪切模型示意图Fig.5 Schematic representation of the proposed mode for the degradation of algin by two enzymes
2.4 双酶产物相对分子质量分布变化
在表3 中,iACS 中相对分子质量分散系数在初始阶段明显变宽,从原始的1.65 上升至5.14。 结合表2,iACS 中 Mn的下降速率(10.6 倍)明显高于 Mw的下降速率(5.8)倍,说明纤维素酶的加入促进了低相对分子质量组分的降解,使得Mn快速降低。 图6中iACS 在1 h 时低相对分子质量分布明显变宽至1×103,而高相对分子质量组分1×106大部分被降解至 1×105。 iACM 在第 5 小时时分散系数从 2.3 升高至 7.02, 图6 中 iACM 第 5 小时时 1×104组分迅速增加,而高相对分子质量1×105组分下降缓慢,所以造成分散系数明显上升。 iACM 在降解过程中其分散系数在2 h 内呈上升状态, 后逐渐下降并趋近于分散系数2。 在高分子链的随机剪切过程中,PDI 值随反应进行最终无限趋近于2。 若体系初始PDI 值高于2,则PDI 值逐渐下降并无限趋近于2;若PDI值低于2,则PDI 值逐渐上升并无限趋近于2。 说明iACE 在2 h 后的剪切模型与随机剪切模型类似。
前期预实验表明纤维素在单独作用于褐藻胶裂解酶时产物相对分子质量无明显变化(未展示),而在与褐藻胶裂解酶水解过程中能产生协同作用并使相对分子质量快速下降,说明纤维素酶中的内切型葡聚糖酶起主要协同作用。 iACS 和iACM 中PDI 值的突然增大说明纤维素酶对相对分子质量1×104~1×105组分有吸附优先性, 因此出现 PDI 值迅速升高的现象。 由此推测在双酶反应体系剪切行为如图5(d)所示,底物先在褐藻胶裂解酶的作用下生成相对分子质量 1×104~1×105组分, 从而诱导纤维素酶开始降解该组分糖链,前者主要作用于Mw≥1×105组分, 而后者主要作用于由 alginate lyase 降解高相对分子质量组分产生的低相对分子质量组分,最终表现出随机剪切模型[16]。这可能与内切型葡聚糖酶的底物结构特异性结合有关。 内切型葡聚糖酶已被证实只作用于非晶体结构[17],而天然大分子褐藻胶溶液中糖链易发生聚集行为与氢键结合形成针状晶体结构[6],故高相对分子质量时内切型葡聚糖酶无法作用于底物, 但随着降解过程的进行,相对分子质量下降,聚集行为减弱,内切型葡聚糖开始作用于无晶体结构的低相对分子质量糖链。
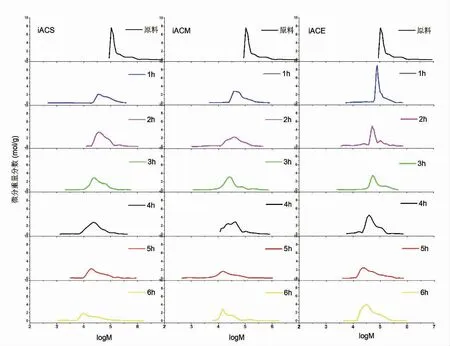
图6 褐藻胶裂解酶-纤维素酶分步法相对分子质量分布Fig.6 The molecular weight distribution of alginate lyase-Cellulase interval hydrolysis
3 结 语
采用5 种降解方式作用于褐藻胶, 利用GPCMALLS 表征降解过程中系列褐藻胶降解产物相对分子质量、分散系数,分析2 种酶作用下的链剪切模型,确定了满足生理特性需求的系列褐藻胶降解产物的制备条件范围。 褐藻胶裂解酶在作用于褐藻胶时主要表现为中央剪切和多次剪切模型。 整个反应进程中随反应时间的延长,相对分子质量组分增加。 多次剪切行为的存在使得小分子片段不断增加,酶与其发生有效碰撞的概率减少,并开始与溶液中的大分子长链或未降解长链结合,故在褐藻胶一步法降解过程中, 当反应时间超过2 h 出现相对分子质量上升的情况。 同样的原理也体现在酶添加量这一因素中。 同一反应时间下,随着加酶量的增加, 相对分子质量未呈等比例下降, 在加酶量达10.24 U/mg 时相对分子质量下降倍数减小,是因为酶量的增加提高了酶在低相对分子质量片段间的浓度,从而提高了低相对分子质量降解速度,但并未提高高相对分子质量的降解速度。 故为了确保相对分子质量组分的均一性,减少小相对分子质量片段的积累,可采用以下方法:1)褐藻胶一步法降解过程应该将反应时间控制在2 h 以内, 褐藻胶分步降解过程反应时间控制在5 h 内;2) 两种方式加酶量控制在2.56~10.34 U/mg。在上述条件范围内可制备相对分子质量在20 000~120 000,分散系数范围在1.6~2.4 的系列褐藻胶降解产物。 双酶作用中,纤维素多酶体系中的内切型葡聚糖酶起主要协同作用。褐藻胶裂解酶主要作用于Mw≥1×105组分,纤维素酶主要作用于 1×104~1×105组分, 反应后期呈随机剪切模型。iACE 法有助于两者充分发挥对不同相对分子质量组分的吸附特性, 增加与底物结合概率,减少低相对分子质量积累,确保相对分子质量的均一性和稳定性。 但本次实验的研究仍存在不足, 单次加酶量过高使得底物在2 h 内相对分子质量下降迅速,2 h 后相对分子质量无明显变化。
