下调肿瘤源性免疫球蛋白G表达对胃癌细胞增殖的影响及其机制研究
2021-03-18王居平赵静周青宏巫祥生农安娜华浩铭杨树琳陈丽莹任瑞华2彭慧
王居平,赵静,周青宏,巫祥生,农安娜,华浩铭,杨树琳,陈丽莹,任瑞华2,彭慧
(1. 右江民族医学院,广西 百色 533000;2. 赣南医学院,江西 赣州 341000)
胃癌是消化系统常见的恶性肿瘤,占我国癌症发病率的第四位,并呈上升趋势。早期多无明显临床症状,往往就诊时已到中晚期,且大多数患者因发生转移而失去手术的最佳时机[1-2]。因此,了解胃癌的发生发展机制并寻求特异的疗法是当务之急。免疫球蛋白(Ig)是人体中极其重要的蛋白质,广泛存在于血浆、组织液和分泌液中,参与机体的免疫反应。传统的免疫学理论认为,只有B淋巴细胞和浆细胞才能产生和分泌Ig,但近年来国内外多个研究组发现胃癌、乳腺癌、肺癌、宫颈癌等多种癌细胞也能表达Ig,特别是IgG[3-6]。更重要的是,与经典IgG不同,非B细胞来源的IgG参与多种肿瘤的发生发展过程[7-11]。近年来许多研究显示,ATP酶中的P-ATP酶如Na+-K+-ATP酶、H+/K+-ATP酶不仅参与正常的细胞活动,如维持细胞内外钠、钾离子的生理分布,也参与了包括胃癌在内的多种肿瘤的发生发展[12-15]。本研究旨在通过探讨Na+-K+-ATP酶在肿瘤源性IgG促进胃癌细胞增殖中的作用和机制研究,为胃癌的诊断和防治提供新的靶点。
1 材料与方法
1.1 细胞株和裸鼠 人胃癌细胞SGC-7901和HGC-27购于武汉普诺赛生命科技有限公司,12只4~5周龄BALB/c 裸鼠购于北京维通利华实验动物技术有限公司。
1.2 主要试剂 DMEM培养基、胎牛血清和0.25%胰酶购于Gibco公司;Control siRNA片段序列正义链为5′ UUCUCCGAACGUGUCACGUTT3′,反义链为5′ACGUGACACGUUCGGAGAATT3′,IGH-G1siRNA片段序列正义链为5′CCAAGGACACC-CUCAUGAUTT3′,反义链为5′AUCAUGAGGGUGUCCUUGGTT3′,siRNA片段和shRNA质粒载体购于上海吉玛制药技术有限公司;转染试剂LipofectamineTM2000购于美国Invitrogen公司;10XRI-PA裂解缓冲液购于美国Upstate公司;CCK-8试剂盒购于北京索莱宝科技有限公司;ATP酶试剂盒购于南京建成生物工程研究所;BCA蛋白质浓度测定试剂盒购于上海碧云天生物技术有限公司;鼠抗人IgG(γ链特异性)抗体购于美国Sigma公司;ECL发光液购于美国Merck Millipore公司;遗传霉素G418和兔抗人β-actin抗体购于生工生物工程(上海)股份有限公司;RT-qPCR相关试剂购于宝生物工程(大连)有限公司;免疫组化试剂购于北京索莱宝生物技术公司。
1.3 细胞培养和siRNA干扰实验 将SGC-7901细胞置于含有10%胎牛血清、100 U/ml青链霉素的DMEM培养基中,将HGC-27细胞置于含有20%胎牛血清、100 U/ml青链霉素的RPMI 1640培养基中,在37℃、5% CO2的培养箱中培养。当细胞贴壁达80%时,用0.25%的胰酶消化细胞,进行传代培养,取对数生长期细胞进行实验。转染前使细胞在六孔板中达到50%~60%的融合,用LipofectamineTM2000将IGHG1 siRNA和Control siRNA片段转染进入以上两种细胞,72 h后收细胞进行后续实验。
1.4 胃癌稳转细胞系的建立和裸鼠成瘤实验 将Control shRNA和IGHG1 shRNA质粒载体转染到HGC-27细胞中,用G418筛选出最佳药物浓度后并处理细胞,经过4~6周的筛选,最终得到稳定表达Control shRNA和IGHG1 shRNA的单克隆细胞系。将此细胞5×107个溶于200 μl PBS中,注射到裸鼠的皮下,实验组和对照组裸鼠各6只。8周后将以上裸鼠麻醉处死,取出裸鼠肿瘤并拍照。对于裸鼠肿瘤组织,在完成HE染色后用免疫组化技术检测以上组织增殖相关标志物PCNA和Ki67的表达。
1.5 免疫印迹实验 收集siRNA干扰后的细胞样品,裂解后测定细胞蛋白浓度,每个样品取50 μg蛋白经SDS-PAGE凝胶电泳分离后转移到硝酸纤维素膜上。用5%牛奶封闭2 h,PBST洗膜后,加入一定稀释倍数的一抗,4℃孵育过夜,第2天用PBST洗膜后在室温孵育HRP标记的二抗1 h,PBST洗膜后加入ECL发光液在暗室用胶片曝光,以β-actin为内参照。
1.6 RT-qPCR 用RNAsio Plus试剂提取细胞总RNA后,按照PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒说明书将总RNA逆转录成cDNA。根据TB Green○RPremix Ex TaqTMⅡ (TliRNaseH Plus)试剂盒说明书,加入相应反应体系,用罗氏Lightcycler96荧光定量PCR仪检测CT值。使用2-△△Ct法分析IGHG1在mRNA水平的相对表达量。
1.7 细胞增殖实验 在SGC-7901和HGC-27细胞中均转染Control siRNA和IGHG siRNA片段,将转染Control siRNA片段的细胞定为对照组,转染IGHG1 siRNA片段的细胞定为实验组。转染6 h后,胰酶消化并进行细胞计数,每孔2000个细胞,在96孔板中接种细胞悬液(100微升/孔),72 h后,根据细胞增殖检测试剂盒说明书,向细胞中加入10 μl CCK-8试剂,放入细胞培养箱中继续培养1 h,在Bio-Rad酶标仪上测定490 nm波长处的吸光度值。在实验过程中设置空白对照组,每组细胞做6个重复。
1.8 Na+-K+-ATP酶活性测定 转染72 h后将细胞收集加入500 μl生理盐水,用超声破碎仪破碎细胞,400安培10秒/次,间隙20 s,反复5~10次,1000 r/min,离心5 min,取上清液测量细胞蛋白浓度以及总ATP酶和Na+-K+-ATP酶活性。根据酶促反应释放的无机磷含量测定ATP酶活性,按照试剂盒说明书要求逐项加入试剂,最后用紫外分光光度计在636 nm处测定样品吸光度。
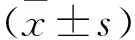
2 结果
2.1 应用siRNA干扰技术下调胃癌细胞中IgG表达 在SGC-7901和HGC-27细胞中均转染Control siRNA片段(对照组)和IGHG1 siRNA片段(实验组)。转染72 h后收细胞,用免疫印迹技术和RT-qPCR技术分别检测以上细胞中IgG的表达。结果表明,与对照组细胞相比,实验组细胞中IgG在蛋白(见图1A和图1C)和mRNA水平(见图1B和图1D)的表达降低(P<0.01)。

注:图1B,P=0.002;图1D,P=0.003;**表示P<0.01。
2.2 体外实验证明肿瘤源性IgG表达下调抑制胃癌细胞增殖 在SGC-7901和HGC-27细胞中均转染Control siRNA片段(对照组)和IGHG1 siRNA片段(实验组)。在转染前和转染3 d后,分别用显微镜观察并进行拍照,随机取以上两种细胞的10个不同视野,对每个视野的细胞进行计数并进行方差分析。结果显示,转染3 d后,与对照组细胞相比,实验组细胞数量显著减少(P<0.01)(见图2A和图2C)。在以上细胞中分别转染Control siRNA(对照组)和IGHG1 siRNA(实验组)片段,72h后用CCK-8法检测细胞增殖情况。结果表明,与对照组细胞相比,实验组细胞IgG表达下调抑制胃癌细胞SGC-7901(见图2B)和HGC-27(见图2D)增殖。

注:图2A,P<0.001;图2B,P=0.033;图2C,P=0.003;
2.3 体内实验证明敲低肿瘤源性IgG表达阻碍胃癌细胞增殖 本实验通过G418筛选构建了稳定表达Control shRNA(对照组)和IGHG1 shRNA(实验组)的HGC-27胃癌细胞系并检测了IgG在蛋白和mRNA水平的表达,随后将以上稳转细胞注射进BALB/c 裸鼠背部两侧皮下,8周后测量裸鼠瘤体大小,摘除肿瘤组织后完成HE染色,检测与肿瘤增殖相关的标志物PCNA、Ki67和阴性对照PBS表达水平。结果表明,以上稳转细胞中IgG在蛋白和mRNA(见图3A和图3B)水平的表达都降低(P<0.01)。与对照组相比,实验组裸鼠肿瘤体积减少(见图3C),PCNA和Ki67的表达也降低(P<0.05)(见图3D)。
2.4 肿瘤源性IgG表达下调降低胃癌细胞中Na+-K+-ATP酶活性 转染72 h后收集细胞并用超声裂解细胞,取上清分别检测总ATP酶和Na+-K+-ATP酶活性。结果表明,与对照组细胞相比,实验组细胞中以上2种ATP酶活性均降低(P<0.05)(见图4A和图4B)。
注:图3B,P=0.001;图3D,PPCNA=0.013,PKi67=0.011;*表示P<0.05,**表示P<0.01比例尺20 μm(每组比例尺相同,故每组只画了第一张图片)。

注:图4A,P=0.04,P=0.007;图4B,P=0.039,P=0.049;*表示P<0.05,**表示P<0.01。
3 讨论
ATP在生物体内各种生命活动中发挥重要作用。目前发现至少有三类ATP酶,分别为:P-ATP酶、F-ATP酶、V-ATP酶[16]。P-ATP酶分布在真核细胞的质膜、少数细胞器膜和大肠杆菌、链球菌的内膜[17]。F-ATP酶是一类结构最复杂、研究最深入的质子泵ATP酶,存在于细菌内膜、叶绿体的类囊体和线粒体内膜的内侧[18]。V-ATP酶存在于真核细胞内的空泡型细胞器上,如酵母、真菌的空泡,植物的液泡,动物的溶酶体、笼蛋白衣被小泡、嗜铬颗粒、突触小泡和分泌小泡等[18-19]。Na+-K+-ATP酶属于P-ATP酶,能维持线粒体膜电化学梯度,是线粒体功能、结构变化的灵敏指标[20]。Na+-K+-ATP酶为三羧酸循环的关键酶,由α、β和γ 3个亚单位组成。其中α-亚单位是一种跨膜蛋白,可促进细胞内外K+和Na+之间交换,进而调节体内外离子间的动态平衡[21]。由于Na+-K+-ATP酶在机体内扮演多种重要的角色,因此Na+-K+-ATP酶表达和活性改变将诱发多种疾病[22],并且癌细胞中Na+-K+-ATP酶表达和活性改变将影响其(其代表癌细胞)发生发展[23]。有报道指出[24],下调Na+-K+-ATP酶(同前,均为Na+-K+-ATP酶)α1亚基的表达抑制非小细胞肺癌的增殖和迁移。使用Na+-K+-ATP酶抑制剂将抑制肝癌细胞HepG2的增殖,并诱导细胞凋亡[25]。Li L等[26]发现Na+-K+-ATP酶β3亚基在人的胃癌组织中显著升高,并通过PI3/AKT信号通路促进胃癌细胞的发生发展和预后。我们认为Na+-K+-ATP酶可能通过PI3/AKT信号通路影响细胞增殖。除此之外,Na+-K+-ATP酶的活性取决于细胞内的磷脂酰丝氨酸(phosphatidylserine,PS)和胆固醇。有研究表明[27-30],PS能够稳定Na+-K+-ATP酶的表达,卵磷脂(phosphatidylcholine,PC)和脑磷脂(phosphatidylethanolamine,PE)能够和Na+-K+-ATP酶相互作用进而增强其活性。Habeck M等[31]研究发现,Na+-K+-ATP酶的功能被PS和胆固醇(PC、PE)调节,此过程取决于磷脂的结构特异性、特异的结合位点和特定的动力学机制。我们推测,癌源性IgG可能通过调节PS和胆固醇(PC、PE)来增强Na+-K+-ATP酶的活性进而促进胃癌细胞增殖,我们将在后续的实验中验证这一推论。
本研究从体内和体外两方面证明,下调胃癌细胞中IgG表达后,细胞增殖明显受到抑制,进一步探究其机制,我们发现在以上胃癌细胞增殖受到抑制的同时,Na+-K+-ATP酶和总ATP酶的活性均显著降低,该结果与以前报道的结果相一致。此外,Na+-K+-ATP酶已被证实促进胃癌细胞增殖[26,32]。
综上所述,我们认为IgG可能通过增强胃癌细胞中Na+-K+-ATP酶活性促进细胞增殖(见图5)。下一步,我们将就IgG是否确实通过影响Na+-K+-ATP酶活性促进胃癌细胞增殖做进一步探索。
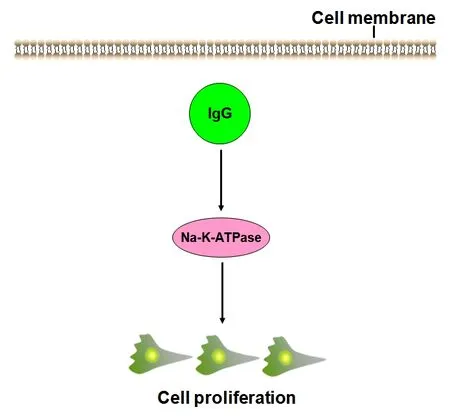
图5 肿瘤源性IgG促进胃癌细胞增殖机制图
