姜黄素联合顺铂通过内质网应激信号通路抑制腺样囊性癌ACC-M细胞增殖作用的研究
2021-03-18
[遵义医科大学第五附属(珠海)医院口腔颌面外科,广东 珠海 519100]
涎腺腺样囊性癌(salivary adenoid cystic carcinoma,SACC)是口腔颌面部常见的唾液腺恶性肿瘤,目前治疗方法仍以手术为主,辅以放化疗。顺铂是治疗腺样囊性癌常见的化疗药物,然而,它的应用受到耐药性和副作用的限制。因此,开发与顺铂协同作用并减少副作用的新药物具有重要意义。研究表明,姜黄素联合顺铂在多种肿瘤中发挥协同作用[1-2]。本研究探讨姜黄素联合顺铂对腺样囊性癌ACC-M细胞的抗肿瘤作用及其对内质网应激相关蛋白GRP78、p-elF2α、CHOP、p-JNK蛋白表达的影响。
1 材料与方法
1.1 主要材料和仪器 ACC-M细胞株购自广州华拓生物科技有限公司,姜黄素(Curcumin,Cur)、顺铂(cisplatin,DDP)、胎牛血清、二甲基亚砜(DMSO)均购自合肥博美生物科技有限责任公司(批号:458-37-7、批号:15663-27-1、批号:15140-122、批号:67-68-5)、RPMI-1640均购自美国Gibco公司(批号:15140-122),MTT试剂盒(批号:C0009S)、LDH试剂盒购自江苏碧云天生物科技研究所(批号:C00016)、GRP78(批号:#3177)、p-elF2α(批号:#3398)、elF2α(批号:#5324)、CHOP(批号:#2895)、p-JNK(批号:#9255)、GAPDH(批号:#5174)均购自美国CST公司,鼠源二抗、兔源二抗购自美国CST公司(批号分别为:#7076、#7074)。酶标仪购自美国ThermoScientific公司,细胞培养箱购自力康生物医疗科技控股集团,96孔板细胞培养板购自Corstor公司(型号:3300),电子天平购自德国艾科勒公司(型号:ALC-210.4)。尼康ECKIPSE TS100/TS100倒置显微镜购自Nikon公司。
1.2 实验分组及细胞培养 将ACC-M细胞分为姜黄素组、顺铂组、联合用药组、对照组,用实验笔标记分组名称、时间。将ACC-M细胞置于含10%胎牛血清及1%双抗(青霉素、链霉素)的RPMI-1640培养基中,于37℃、5%CO2培养箱中培养,并进行传代,待细胞贴壁后取对数生长期细胞进行实验。
1.3 MTT法测定细胞存活率 取对数生长期的ACC-M细胞,加入0.25%胰蛋白酶消化制备成单细胞悬液,计数并调整细胞浓度为1×104个/毫升,每孔加入100 μl细胞悬液接种于96孔板,每组设置5个复孔,置于培养箱培养过夜,然后分组给药。实验分组如下:对照组:加入0.1% DMSO;顺铂组(DDP组):加入DDP(8 μM),姜黄素组:Cur(5 μM、10 μM、20 μM、40 μM);联合用药组:不同浓度(5 μM、10 μM、20 μM、40 μM)Cur联合DDP(8 μM)。加药处理24 h后弃上清,每孔加入1 mg/ml的MTT溶液100 μl,于培养箱中继续孵育4 h,吸去上清,每孔加入100 μl的DMSO,选择495 nm波长,在酶标仪上测定各孔吸光度值(OD值),实验重复3次。细胞存活率=(药物干预组OD值-空白组OD/对照组OD值-空白组OD值)×100%。
1.4 LDH法测定细胞毒性 ①按实验分组给药,取上清液,400 g离心5 min,每组分别取120 μl置于96孔板;②配置INT溶液:将10×INT溶液稀释至×1。按酶溶液∶INT溶液∶乳酸溶液=1∶1∶1比例配置LDH工作液,避光放置;③每组加入60 μl LDH工作液,混匀,室温避光孵育30 min,490 nm测定每组吸光度。计算公式:LDH释放量(%)=(处理组样品OD值-处理组对照孔OD值)/(空白组样品OD值-空白组对照孔OD值)×100%。
1.5 倒置显微镜下观察用药后各组细胞生长情况 取对数生长期的ACC-M 细胞,接种于6孔板中过夜,在姜黄素组、顺铂组、联合用药组中分别加入20 μmol/L姜黄素、8 μmol/L顺铂、20 μmol/L姜黄素+8 μmol/L顺铂进行干预,对照组中加入0.1%DMSO的完全培养基,作用24 h后,倒置显微镜下观察各组细胞形态。
1.6 蛋白质印迹法测定 GRP78、p-elF2α、CHOP、p-JNK 蛋白的表达 倒置显微镜下观察各种细胞形态后,分组加入细胞裂解液,4℃离心,12 000 r/min,离心5 min,吸取上清,测定蛋白浓度,使每孔上样蛋白总量均一化(20 μg),然后在10%SDS-PAGE凝胶上分离,转膜,使用5%脱脂奶粉封闭2 h,然后孵育目的蛋白GRP78、p-elF2α、CHOP和p-JNK一抗(1∶1000稀释),甘油醛-3-磷酸脱氢酶(GAPDH)作为内参,4℃孵育过夜;震荡洗膜3次,孵育二抗,4℃孵育2 h;最后采用Bio-Rad凝胶处理系统采集结果,图片并用image J软件对结果进行定量分析。
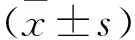
2 结果
2.1 姜黄素联合顺铂对ACC-M细胞的细胞存活率和LDH释放量的影响 用不同浓度的姜黄素单独或联合处理ACC-M细胞24 h,MTT实验测定细胞存活率,收集上清液测定LDH释放量。结果表明:见图1,用8 μM顺铂作用细胞24 h后,与对照组相比,ACC-M细胞存活率明显降低(见图1A);用不同浓度的Cur(5 μM、10 μM、20 μM、40 μM)联合DDP(8 μM)处理ACC-M细胞,与DDP组相比,联合用药组的细胞存活率进一步降低(P<0.05);在LDH释放量得到类似的结果,其中Cur能显著增加由DDP引起的LDH释放量(见图1B)。本实验采用金正均法判断两种药是否存在协同作用,Q=E(a+b)/(Ea+Eb-Ea×Eb),当Q值>1.15时,说明具有协同增效作用,本实验结果显示,当8 μM 顺铂与10 μM姜黄素联用时,计算Q值为1.24,表明两者存在协同作用;当8 μM 顺铂与20 μM姜黄素联用时,计算Q值为1.18,表明两者存在协同作用;其余各组Q值为0.95~1.06,见表1。
注:与空白组比较,#:P<0.05;与顺铂组比较,*:P<0.05;Ctrl:空白对照;DDP:顺铂;Cur:姜黄素。

表1 不同浓度联合用药作用24 h后对ACC-M细胞Q值的影响
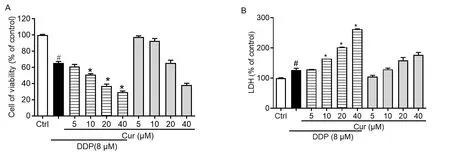
2.2 姜黄素联合顺铂作用24 h后对ACC-M细胞生长情况的影响 各组细胞在加药后24 h,倒置显微镜下观察,对照组ACC-M细胞呈梭形,胞质较为丰富,细胞核位于中央。而加入姜黄素(20 μM)、顺铂(8 μM)后,细胞由梭形变为不规则形,细胞体积增大,细胞核往边上移动,但细胞膜尚完整。同时,细胞贴壁数量减少,脱落漂浮于培养液的细胞增多,尤其在联合用药组(20 μM Cur+8 μM DDP),细胞贴壁细胞明显减少,而脱落于培养液的细胞明显增多。见图2。
注:黑色色箭头代表贴壁ACC-M细胞,红色代表死亡ACC-M细胞;Control:空白对照;DDP:顺铂;Cur:姜黄素。
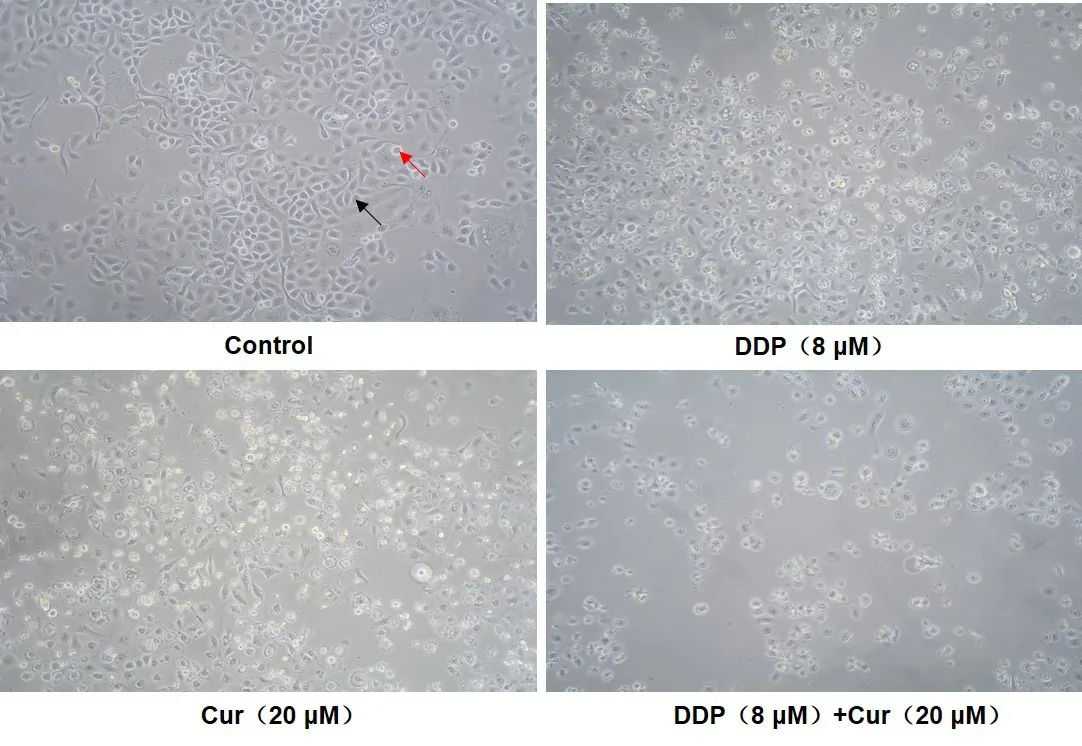
2.3 姜黄素与顺铂单独及联合使用对ACC-M细胞GRP78、p-elF2α、CHOP、p-JNK蛋白表达水平的影响 使用8 μM的DDP和20 μM Cur单独或联合处理ACC-M细胞24 h后,收集蛋白检测内质网应激相关蛋白GRP78、p-elF2α、elF2α、p-JNK和内参蛋白GAPDH的表达。与空白对照组相比,8 μM DDP处理24 h后,DDP组的内质网应激相关蛋白GRP78、p-elF2α、CHOP上调,差异有统计学意义(P<0.05);20 μM Cur联合DDP(8 μM)处理24 h后,GRP78、p-elF2α、CHOP、p-JNK蛋白表达明显上调,差异有统计学意义(P<0.05),表明姜黄素能进一步增强由顺铂诱导的内质网应激反应,见图3。
注:与空白组比较,#P<0.05;与顺铂组比较,*P<0.05;Control(空白对照),DDP(顺铂),Cur(姜黄素),Combination(联合用药)。
3 讨论
SACC是颌下腺和舌下腺最常见的上皮性涎腺恶性肿瘤,占腮腺恶性肿瘤的7%~18%,占小涎恶性肿瘤的35%~58%。SACC可发生在所有年龄段,在50~60岁中老年患者中出现频率更高,临床上以神经浸润和多发性局部复发为特征[3-4]。目前,SACC的治疗以手术为主,即使进行根治性手术治疗,5~10年的复发率仍较高[5],所以目前多主张术后辅以放化疗。术后放疗被认为可以局部控制肿瘤进展,但5年后复发率仍可达到一半[6]。此外,即使局部控制的病人仍可能在辐射场外或远处复发,术后辅以化疗越来越得到研究者的认可。顺铂是治疗癌症的传统一线化疗药物[7-8],其可以诱导DNA-蛋白质以及链间和链内DNA交联,尽管这种交联可以诱导细胞凋亡并抑制细胞增殖,但是顺铂的有效性受到细胞耐药性及毒性的限制,包括遗传毒性、肾毒性和急性骨髓毒性[9-10]。为了减少顺铂的耐药及其毒副作用,增强顺铂的抗肿瘤效果,临床上常将顺铂与其他药物联合使用,中药因其药理作用广,同时毒副作用小而成为理想选择。
姜黄素是从姜黄根茎中提取的脂溶性多酚类衍生物,具有抗炎、抗氧化、降血脂、抗肿瘤等多方面的药理作用[11-13]。在膀胱癌细胞系中,与单独使用姜黄素或顺铂相比,10 μM姜黄素和10 μM顺铂联合使用可明显降低膀胱癌细胞系的生存能力,促使其调亡明显增加[14]。Zhu X等[15]发现,与单纯顺铂相比,姜黄素和顺铂联合应用可通过调节 Twist1上调 miR-186表达,增强顺铂对卵巢癌的抑制作用。本实验MTT及LDH试验结果显示,与单独顺铂组相比,姜黄素联合顺铂可明显抑制ACC-M细胞增殖,增强顺铂对ACC-M细胞毒性,姜黄素联合顺铂具有较好的协同作用,姜黄素可增强顺铂的抗肿瘤效果。
生理或病理条件下的多种刺激可诱导内质网中未折叠蛋白的积累,这将激活一种进化上保守的适应性反应,称为内质网应激,如果刺激严重或持续,则会导致细胞死亡[16-17]。葡萄糖调节反应蛋白78(glucose regulated protein 78,GRP78)又称为免疫球蛋白重链结合蛋白(immunoglobulin heavy chain-binding protein,Bip),正常情况下,GRP78与内质网三种跨膜蛋白(蛋白激酶R样内质网激酶(RNA dependent protein kinase-like ER kinase,PERK)、肌醇需求酶 1(inositol requiring enzyme 1-α,IRE1α) 和活化转录因子6 (activating transcription factor 6-α,ATF6α)结合并使其失活。发生ERS时,未折叠蛋白或错误折叠蛋白与GRP78 /Bip的亲和力较高,内质网腔内GRP78表达增加[18]。本实验发现用姜黄素或联合顺铂处理后,ACC-M细胞中GRP78表达增加,表明内质网应激激活,而联合用药后细胞内GRP78表达增加明显,表明姜黄素联合顺铂可增强内质网应激反应。PEAK通路是内质网应激发生时一条重要的信号通路,据报道其与多种肿瘤的增殖及存活有关,通过靶向PEAK信号通路而诱导细胞凋亡或自噬被认为是一个新的治疗策略[19]。在这项研究中我们发现姜黄素联合顺铂作用后ACC-M细胞内p-eIF2α表达上调,提示姜黄素联合顺铂可能通过PERK /eIF2α信号通路激活内质网应激。
CHOP蛋白又称为生长抑制DNA损伤基因153(growth arrest and DNA damage-inducible gene 153,GADD 153),内质网应激三条信号通路均能诱导CHOP的表达。ATF6、ATF4或XBP1S表达上调通过与CHOP基因启动子内的结合位点相互作用诱导细胞凋亡。我们的研究表明姜黄素或顺铂通过诱导内质网应激以激活ACC-M细胞内CHOP的表达,且联合用药后细胞内CHOP表达明显增加,表明姜黄素联合顺铂通过内质网应激诱导的CHOP信号通路从而诱导ACC-M细胞凋亡。目前,CHOP诱导细胞凋亡的下游机制仍在探索之中。其可介导Bcl-2下调和Bim上调,还可诱导促凋亡蛋白ERO1α和Puma的表达,持续的内质网应激最终导致线粒体功能障碍、细胞色素c释放和caspase-3活化[20]。白亮等[21]研究发现姜黄素作用腺样囊性癌后,细胞内caspase-3明显增加,其认为将姜黄素诱导细胞凋亡的机制可能与caspase-3有关。而本实验发现姜黄素联合顺铂作用后细胞内CHOP蛋白明显增加,因而我们认为姜黄素可能通过诱导CHOP表达而激活下游的caspase-3表达,而诱发ACC-M细胞凋亡。
JNK同样是内质网应激诱导细胞凋亡中重要的信号转导因子,在内质网应激中起重要的调控作用。当细胞发生内质网应激时,IRE1α信号通路激活,其可通过刺激凋亡信号调节激酶1(apoptosis signal regulaing kinase-1,ASK1)的激活,而后者可引起应激激酶Jun-N-末端激酶(JNK)下游激活,进而引发细胞凋亡[22]。本实验发现姜黄素作用24 h后,ACC-M细胞内p-JNK增加,顺铂组p-JNK变化不明显,而联合组p-JNK蛋白表达大于单药组,差异具有统计学意义,说明姜黄素联合顺铂可通过介导P-JNK诱导ACC-M细胞凋亡。
综上所述,姜黄素联合顺铂可对ACC-M细胞产生抑制作用,其机制可能与内质网应激相关。姜黄素联合顺铂可通过诱发ACC-M细胞内GRP78表达增加,可能通过活化PEAK-elF2α及IRE1α信号通路,进而促进CHOP及JNK介导的细胞凋亡。姜黄素属于多靶点的生物活性药物,其联合顺铂对ACC的抗肿瘤作用机制是否还有其它信号通路,有待于进一步的研究。
