双肺移植治疗儿童囊性纤维化的多学科综合诊疗
2021-03-17王胜飞陈静瑜刘懿郑明峰毛文君
王胜飞 陈静瑜 刘懿 郑明峰 毛文君
我国首例儿童肺移植完成于2004年。自此之后,我国在国际心肺移植学会(International Society for Heart and Lung Transplantation,ISHLT)注册的儿童肺移植中心已超过40家,但其中大多数中心每年儿童肺移植手术数量不超过5例[1]。由于供者短缺、术后维护困难、受者家庭条件等多方面因素制约,我国儿童肺移植的发展较成人肺移植缓慢。囊性纤维化是一种常染色体隐性遗传性疾病[2],其病因是编码囊性纤维化跨膜电导调节因子(cystic fibrosis transmembrane conductance regulator,CFTR)的基因发生突变,导致上皮细胞的氯离子和钠离子通道的蛋白激酶功能异常,进一步引起包括肺在内的多个器官水、电解质跨膜运转异常,改变了黏液的特性,呼吸系统主要表现为反复支气管感染和气道阻塞,呈慢性进展性肺阻塞病变[3]。该疾病常见于白种人群,亚洲人群较罕见[4]。经笔者查阅文献,目前国内未见肺移植治疗终末期儿童肺囊性纤维化的报道。
南京医科大学附属无锡人民医院于2020年8月1日收治1例10岁的女性肺囊性纤维化患儿,入我院前于上海儿童医学中心行基因检测发现CFTR基因突变,确诊“肺囊性纤维化”,此发病后患儿反复出现咳嗽、发热,入院时伴发Ⅰ型呼吸衰竭,经多学科综合诊疗(multi-disciplinary team,MDT)讨论行双肺移植手术治疗,术后恢复良好。本文就该病例的MDT讨论经过及术后管理经验进行报道。
1 一般资料
患儿,女,10岁。2015年2月1日无明显诱因出现低热,至当地医院就诊,检查示血象高,未予特殊治疗,进一步到上海儿童医学中心就诊,予抗感染治疗后好转,但未找到发热原因。同年患儿再次出现咳嗽、发热,再次到上海儿童医学中心行基因检测,提示存在CFTR基因突变,确诊“肺囊性纤维化”,当时患儿家属被告知无有效治疗方法。之后几年中,患儿反复出现咳嗽、发热,且发作越来越频繁,近年来每年发作3~4次,均予抗感染治疗后好转,多次痰培养为铜绿假单胞菌、荧光假单胞菌,接受美罗培南、头孢他啶、阿奇霉素等抗生素治疗。现患儿病情进一步加重,拟行肺移植手术入我院。近期患儿反复咳嗽、发热,轻度胸闷、气喘,食欲、睡眠可,大小便正常。体格检查示体温36.6 ℃,脉搏113次/分,呼吸24次/分,血压114/74 mmHg(10 mmHg=1.33 kPa);神志清,呼吸稍促,气管居中,两肺呼吸音粗,可闻及少量干湿性啰音;心率113次/分,律齐,各瓣膜区未闻及明显杂音;腹平软,无压痛,肝脾未触及肿大;双下肢无浮肿。实验室检查示白细胞计数13.73×109/L,中性粒细胞计数 6.66×109/L,单核细胞计数 0.70×109/L,淋巴细胞计数5.70×109/L,血红蛋白131 g/L,红细胞沉降率38 mm/h;未吸氧状态下动脉血气分析结果示pH值7.475,血二氧化碳分压25.7 mmHg,血氧分压58.2 mmHg,提示Ⅰ型呼吸衰竭;活化部分凝血活酶时间31.8 s,凝血酶原时间12.9 s。心脏超声心动图检查示静息状态下超声心动图未见异常,连续多普勒估测肺动脉收缩压为32 mmHg。心电图示窦性心律不齐。腹部超声示肝、胆、脾、胰、门静脉、肾、输尿管、膀胱均未见明显异常。患儿围手术期胸部影像学表现和支气管镜探查表现见图1。胸部CT示两肺多发支气管扩张,局部伴少许炎症病变(图1A)。初步诊断考虑:肺囊性纤维化、先天性支气管扩张、肺部感染、呼吸衰竭。
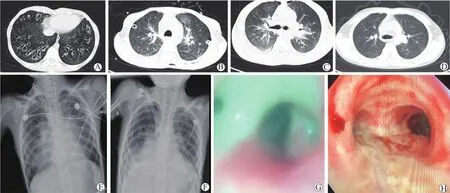
图1 肺囊性纤维化患儿围手术期胸部影像学表现和支气管镜探查表现Figure 1 The perioperative chest imaging findings and bronchoscopy findings in the child with pulmonary cystic fibrosis
供者为山东省德州市人民医院提供的1例12岁脑死亡女性儿童,无胸部外伤史,气管插管2 d,血培养、痰培养阴性,24 h液体平衡-400 mL,氧合指数469 mmHg。供者与受者胸腔大小相近,人类白细胞抗原(human leukocyte antigen,HLA)分型匹配。
2 MDT讨论
2.1 移植科
范立主治医师及陈静瑜主任医师认为,患儿明确诊断为肺囊性纤维化、先天性支气管扩张、肺部感染、呼吸衰竭。患儿由上海儿童医学中心转入我院,确诊肺囊性纤维化,近年来反复感染,经内科治疗后效果欠佳。目前病情进行性发展,活动后气喘加重,血氧饱和度时有下降,此次抗感染治疗未见明显好转,伴发Ⅰ型呼吸衰竭。肺囊性纤维化在欧美人群中是肺移植主要适应证之一,术后5年生存率达60%~70%,我国目前该疾病极为罕见[5]。该患儿经肺移植术前评估,符合肺移植手术适应证,未见手术禁忌证,经医院伦理委员会讨论,同意纳入肺移植等待列表。我院此前已成功完成多例儿童肺移植,拥有足够的临床经验及成熟的外科技术。需等待手术治疗,做好免疫诱导等术前准备工作。
2.2 胸外科
郑明峰主任医师认为,患儿目前诊断明确,符合肺移植手术适应证。因患儿长期缺氧,容易导致心脏和肾脏等重要器官并发症,入院检查其它器官功能基本正常,无手术禁忌证,支持手术治疗,术中需注意维持循环稳定,保证重要器官的灌注。供者氧合指数达标,血、痰培养均为阴性,供者与受者胸腔大小相近,HLA分型匹配,综合各项指标评估供者可用[6-9]。供肺获取前给予甲泼尼龙进行免疫诱导,以降低排斥反应发生风险。患儿拟行双肺移植术,手术时间较长,可考虑采取Clam-shell切口,减少供肺冷缺血时间。具体手术方式需在麻醉置管后评估决定。
2.3 麻醉科
王桂龙主任医师认为,患儿入院检查未见手术禁忌证,拟行双肺移植手术治疗,术中麻醉后可行右心漂浮导管检查再次测定肺动脉压力,并评估双肺氧合情况,以决定最后手术方式。术前需充分备血,做好体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)、体外循环辅助等准备工作。该患儿术前心脏超声心动图检查提示心功能未见明显异常,伴Ⅰ型呼吸衰竭,心功能未出现失代偿,无明显肺动脉高压,无二氧化碳潴留,麻醉诱导后需评估心肺功能,根据术前动脉血气情况及心功能状态决定是否行ECMO辅助[10-12]。肺移植手术时间较长,术中需密切监测各项指标,确保术中患儿生命体征平稳,术后转入重症监护室(intensive care unit,ICU)治疗。
2.4 重症医学科
许红阳主任医师认为,患儿年龄较小,术前心功能评估未见明显异常,术后心肌梗死和脑卒中的发生风险相对较小。术后需密切监测胸腔引流管引流量,给予呼吸机辅助通气,移植术后给予抗感染、免疫抑制、抑酸预防应激性溃疡等治疗,同时予白蛋白支持,维持内环境稳定。患儿术后康复期间可能会出现依从性和配合度较差,需要ICU医护人员的大力配合,儿童肺移植术后病情变化可能较快,紧急程度有时与症状不符,常不能有效表达病情和主诉。因此患儿肺移植术后的ICU监护更具有挑战性。
2.5 儿呼吸内科
徐惠良主任医师认为,患儿已确诊为肺囊性纤维化,该疾病在我国极为罕见,国内暂无流行病学资料,需参考欧美人群治疗方案,该患儿此前已接受相关内科治疗5年,反复咳嗽、发热,此次伴发Ⅰ型呼吸衰竭,内科治疗效果差,肺移植指征明确。患儿度过围手术期后需接受严密随访,可获得长期生存,生长发育及生活质量可得到明显改善。进行儿童肺移植围手术期各项治疗时应注意儿童患者与成人患者的区别,应用ECMO辅助、补液、用药、监护等应遵守个体化原则。
2.6 总 结
移植科陈静瑜主任医师总结:(1)患儿确诊肺囊性纤维化,经内科治疗5年后仍反复发生肺部感染,此次入院伴发Ⅰ型呼吸衰竭,心功能无异常,符合肺移植适应证;(2)患儿伴发先天性支气管扩张、肺部感染、呼吸衰竭,术前需充分备血,麻醉后需评估肺动脉压力、双肺氧合等情况以及手术是否需要ECMO或体外循环辅助;(3)我国儿童肺供者稀缺,目前有合适供者评估可用,拟急诊行双肺移植手术治疗,因手术时间较长且供者需从德州转运至我院,为尽量减少供肺冷缺血时间拟采用Clam-shell切口,术中需密切关注患儿生命体征变化,术后转入ICU监护治疗;(4)患儿年龄较小,以上各项治疗应注意儿童患者与成人患者的差异,严格遵守个体化原则。
3 治疗及随访情况
3.1 手术情况
患儿于2020年8月2日全身麻醉后行纤维支气管镜检查示双侧气道内大量黄脓痰,各支段通畅(图1G)。麻醉科医师评估患儿肺动脉压力不高,单肺氧合尚可,因此未使用ECMO辅助,遂行Clam-shell切口下双肺移植术。患儿取平卧位,前胸部横断胸骨第5肋间切口,双侧同时进胸。手术探查可见双肺呈典型终末期肺囊性纤维化改变,肺顺应性差,双侧气道内大量黄脓痰。先行左肺移植术,离断下肺韧带,打开心包,心包游离出左上、下肺静脉以及左肺动脉。血管切缝器离断左上、下肺静脉,无损伤血管钳钳夹左肺动脉后离断。游离左侧主支气管并离断,移去左侧病肺。修剪气管、动脉以及静脉端备吻合用。胸腔内置入灌注、整修妥的左肺。先依次吻合左主支气管、左侧肺动脉,并试开放无漏血。再吻合左肺静脉、左房袖,留置1针开放排气后收紧打结。左肺通气、扩张好,大小匹配。顺次开放肺动脉、静脉。左肺扩张可,水试无明显漏气。患儿循环稳定,左单肺通气氧合满意,遂再次行右肺移植术,左肺和右肺冷缺血时间分别为514 min和570 min。手术时间290 min,术中出血量800 mL,输血浆400 mL和半浆血300 mL。患儿术后循环稳定,氧合满意,带气管插管转入ICU监护。
3.2 术后维护
患儿于2020年8月2日手术后转入ICU,入科时患儿全身麻醉未醒,心电监护示心率136次/分,血氧饱和度95%,血压105/60 mmHg[去甲肾上腺素 5 μg/min、 肾 上 腺 素 0.01 μg/(kg·min)], 呼 吸25次/分。经口气管插管接呼吸机行辅助通气,动脉血气分析示pH值7.223,血二氧化碳分压58.5 mmHg,血氧分压98.3 mmHg,碳酸氢根20.8 mmol/L,剩余碱-3.6 mmol/L,血氧饱和度95.9%,葡萄糖7.6 mmol/L,乳酸4.0 mmol/L,血钾3.9 mmol/L,血钠144 mmol/L,血钙1.2 mmol/L,提示呼吸性酸中毒,予以调整呼吸机参数,给予呼吸机辅助通气。术后常规给予美罗培南等抗感染治疗,他克莫司(tacrolimus,Tac)、甲泼尼龙免疫抑制治疗,奥美拉唑抑酸和预防应激性溃疡,白蛋白支持,停用肾上腺素,继续使用去甲肾上腺素升高血压,维持内环境稳定等一系列治疗。
患儿术后第1日胸腔引流管引流量左侧150 mL,右侧150 mL;心电监护示心率96 次/分,呼吸24 次/分,血压130/60 mmHg,血氧饱和度98%;床边X线胸片示胸部术后改变,两侧胸腔引流中,少许气胸,两肺渗出性改变(图1E)。患儿术后第1日循环稳定,氧合情况理想,行床边纤维支气管镜检查示隆突及支气管嵴锐利,双侧支气管吻合口整洁、通畅,呼吸道黏膜轻度充血水肿,气道少量痰液予以吸出,未见水肿液(图1H)。予以利尿药减轻肺水肿,视病情逐步降低呼吸机支持条件。监测Tac血药浓度,给予美罗培南联合卡泊芬净进行抗细菌、真菌治疗,继续监测相关感染指标及肝肾功能指标,予以抑酸、化痰、保护肝肾功能及加强营养支持治疗,维持内环境稳定等。术后第1日下午患儿神志清醒、呼吸节律,握力可,通过自主呼吸试验 (spontaneous breathing trial,SBT)后顺利脱机拔管,给予高流量吸氧下患儿呼吸平稳。
术后第2日转回普通病房,予以Tac+泼尼松二联免疫抑制方案、美罗培南+头孢他啶抗细菌、卡泊芬净防治真菌、营养支持、止痛、肺康复训练、对症等治疗。患儿于术后第3日评估吞咽功能可,拔除胃管,调整营养方案,予以进食;Tac血药浓度偏低(4.8 ng/mL),予加量。
术后第4日,患儿间断低流量吸氧,两侧胸腔引流管在位通畅,引流出少量淡血性胸液,漏气少,复查胸部CT示双肺移植术后,两侧气胸,两肺渗出性改变、部分实变,两肺门影增大、心影增大,两侧胸膜增厚,左侧胸壁皮下积气(图1B)。拔除右侧胸腔引流管,并加用更昔洛韦进行抗病毒治疗。
术后第6日,拔除左侧胸腔引流管,复查X线胸片示双肺移植术后,右侧液气胸,较前好转,两肺渗出性改变、部分实变,较前稍进展,两肺门影增浓、模糊(图1F)。
术后第10日,停止吸氧,痰量较前减少,活动耐量明显增加。复查胸部CT示双肺移植术后,两侧气胸、两肺渗出性改变,较前大致相仿,两侧胸腔积液较前进展,心影增大,两侧胸膜增厚,左侧胸壁皮下积气较前吸收(图1C)。复查纤维支气管镜检查示左侧支气管吻合口尚通畅,右侧支气管吻合口通畅,可及灰黄色伪膜覆盖,双侧气道黏膜充血,管腔内分泌物少。
术后第12日,Tac血药浓度偏高(11.5 ng/mL),降低泼尼松和Tac剂量,加用吗替麦考酚酯0.25 g,每日2次。
2020年8月17日,患儿于术后第15日出院,出院时患儿状况良好。
3.3 随访情况
患儿术后3个月来我院复查,胸部CT示双肺移植术后,左膈面上移,左肺舌段及下叶少许间质性改变,左侧胸膜稍增厚(图1D)。其余一般情况可。
4 讨 论
随着肺移植技术的发展,肺移植已经成为多种终末期肺病唯一有效的治疗方法。近年来国内外的肺移植手术数量日趋上升,但儿童肺移植与成人肺移植在数量上仍存在明显差距。根据ISHLT对各中心2016年的统计,年龄<18岁的肺移植受者有107例,而年龄>18岁的肺移植受者有4 554例[13-14]。由于儿童肺移植受者与成人以及不同年龄的儿童供者之间胸腔体积存在显著差异,因此供者来源也受到限制,成人供肺体积过大与儿童胸腔体积不匹配,可能导致肺不张,气道扭曲,严重的甚至引起移植物失功,如供肺过小又可能引起慢性移植肺功能障碍[15]。针对该问题,曾有专家提出人工减容肺以及肺叶移植的方法,从而扩大儿童肺移植的供者池[16]。美国的肺源分配主要根据肺分配评分(lung allocation score,LAS)[17],但由于LAS未对年龄<12岁的儿童受者进行相关规定,后又补充年龄<18岁的供者供肺优先用于年龄<12岁的儿童受者。而我国肺源分配主要参考LAS并结合我国具体情况制定,目前我国的受者选择标准尚未对儿童受者做出特殊说明[18]。国际上儿童肺移植最常见的原发病为肺囊性纤维化,根据ISHLT统计,肺囊性纤维化在6~10岁的受者中占51.0%,11~17岁的受者中占66.3%[14]。国内儿童肺移植目前开展较少,尚无较全面的多中心统计报道。我院于2007年至2019年共完成10例儿童肺移植,受者原发病中6例为特发性肺动脉高压,2例为间质性肺疾病,2例为闭塞性细支气管炎[19]。由此可见,我国儿童肺移植的原发病类型与欧美人群也存在较大差异。
囊性纤维化为欧美人群常见的遗传性疾病,主要内科治疗方法有CFTR基因治疗、CFTR药物治疗、激活剂治疗、抗感染治疗等[20]。而根据相关报道分析,肺移植可以有效延长肺囊性纤维化患儿的生存时间以及生活质量,长期预后也较好[21]。在欧美人群中,囊性纤维化是儿童肺移植最常见的指征,在所有肺移植原发病中受者术后平均生存期最长[22]。目前肺囊性纤维化患者行肺移植的适应证为具备以下条件之一:(1)伴发急性呼吸衰竭并需无创通气;(2)耐药菌感染且病情反复、恢复慢;(3)营养不良难以纠正;(4)难治性气胸;(5)既往肺栓塞治疗史,仍伴有严重咯血[23]。
该病例讨论内容重点:(1)肺囊性纤维化为亚洲人群罕见病种,该患儿已确诊5年,入院前已接受相关内科治疗,仍反复出现感染,且此次入院伴发Ⅰ型呼吸衰竭,病情较重。肺囊性纤维化为欧美人群儿童肺移植最常见的原发病。国内此前偶有肺移植治疗囊性纤维化的报道[24],但均为成人肺移植病例。国内儿童肺移植治疗肺囊性纤维化的病例此前尚无明确文献报道,因此针对该患儿,需参考国际指南结合国内儿童肺移植相关经验,制定个体化治疗方案。本患儿无心功能异常,无需行心肺联合移植,最后决定行双肺移植治疗。(2)我国目前肺移植供者主要来源于脑死亡器官捐献,供者池中儿童比例较少,且各年龄段儿童胸腔体积存在较大差异,因此儿童受者要获得较为匹配的供肺较成人受者更为困难。该病例供者为德州市人民医院提供的1例12岁脑死亡女性儿童,供者与受者体型相近,供肺匹配度较高,无需进行人工修剪或肺叶移植。由于供肺取下后需从德州转运至无锡,转运时间较长,为尽量缩短供肺冷缺血时间,此次手术采用Clam-shell切口。(3)患儿伴发Ⅰ型呼吸衰竭,麻醉后评估肺动脉压力不高,单肺通气氧合尚可,因此术前未予ECMO辅助,但是术中仍密切关注患儿生命体征,做好ECMO、体外循环辅助等相关准备。(4)行儿童肺移植的患儿生理上与成人差异较大,且沟通较成人更为困难,术后并发症更加复杂,给术后维护带来了更大的挑战。肺移植术后第1个月为移植术后急性期,并发症主要为排斥反应和出血等。出血与术中使用ECMO以及体外循环辅助等有关,该患儿未予ECMO辅助,术中出血量800 mL,渗出较少,术后出血风险相对较小。术后超急性排斥反应通常与供、受者HLA抗体有关,该患儿HLA分型与供者匹配,排斥反应发生风险较小。(5)与其他器官移植相比,肺与外界环境相通,更容易受到相关因素影响,引起排斥反应[25]。肺移植术后需要进行免疫抑制治疗,儿童与成人免疫抑制方案无明显区别,但由于儿童药物清除率较高,通常需要给予更大剂量的免疫抑制剂,因此也可能会带来更大的不良反应[26]。该患儿术后免疫抑制剂实行个体化管理,逐渐加量,控制用药剂量,减轻不良反应。该患儿经过以上治疗后,恢复良好,顺利出院,术后3个月随访胸部CT无异常,长期预后仍需继续随访观察。
综上所述,肺囊性纤维化在我国属于罕见疾病,目前国内无儿童肺移植治疗肺囊性纤维化的相关报道。通过MDT讨论进一步了解、分析患儿病情,结合已有相关经验,制定了个体化治疗方案,加强了围手术期的监护管理,减少了移植术后并发症的发生风险,患儿预后良好,值得临床推广。
