移植肾T细胞介导的排斥反应的病理学
2021-03-17郭晖
郭晖
T细胞介导的排斥反应(T cell-mediated rejection,TCMR)是最常见的急性排斥反应类型[1-2],其明确诊断必须借助移植肾穿刺活组织检查(活检)病理学诊断。2019年Banff移植病理学诊断标准(Banff标准)根据免疫损伤病变的特征将TCMR分为急性TCMR(acute TCMR,aTCMR)和慢性活动性TCMR(chronic active TCMR,caTCMR)[3]。 其中移植肾aTCMR的基本病变包括肾组织间质内单个核炎症细胞浸润及肾小管炎和动脉内膜炎;caTCMR的基本病变包括慢性移植物血管病(chronic allograft vasculopathy,CAV)、肾间质纤维化或瘢痕化及肾小管萎缩(interstitial fibrosis and tubular atrophy,IFTA)区域内的间质炎症细胞浸润(interstitial inflammation in areas of IFTA,i-IFTA)和IFTA区域内的萎缩肾小管炎(tubulitis in areas of IFTA,t-IFTA)[4]。TCMR往往与抗体介导的排斥反应(antibody-mediated rejection,AMR)合并存在而共同造成移植物的免疫损伤,形成所谓的混合性排斥反应[5-6]。因此,通过本专题系列的介绍,不仅有助于临床医师详细了解移植肾Banff标准中TCMR的内涵,也可以更好地与AMR等其他并发症相鉴别,在肾移植术后临床管理中,可以借助移植肾活检病理学诊断及时发现和治疗早期、轻微的aTCMR,这也是预防其进展为caTCMR的关键。
1 TCMR的基本定义
TCMR是器官移植排斥反应的主要效应机制之一,也是最常见的急性排斥反应类型[1-2]。其发病机制为受者免疫系统中的抗原提呈细胞通过对移植抗原的提呈作用启动免疫识别,迟发型超敏反应性CD4+T细胞通过引发迟发型超敏反应性炎症而引发排斥反应,进而细胞毒T细胞(CD8+T细胞)通过直接接触及释放淋巴毒素发挥杀伤靶细胞的作用,造成免疫损伤。在这一过程中,常伴有巨噬细胞、自然杀伤(natural killer,NK)细胞、中性粒细胞和嗜酸性粒细胞等多种免疫细胞、炎症细胞及细胞因子的共同参与。实际参与TCMR的细胞类型众多,并非单一的T细胞,基于其免疫效应机制,实际上应称为细胞性排斥反应[7],但在Banff标准中,为了与AMR相对应,而特称为TCMR,在此需要予以注意。
目前最新的2019年Banff标准中,依据免疫损伤病变的特征将TCMR分为aTCMR和caTCMR 2种类型[3]。其中移植肾aTCMR的基本病变包括肾间质内单个核炎症细胞浸润及肾小管炎和动脉内膜炎;caTCMR的基本病变包括CAV、i-IFTA和t-IFTA[4]。CAV为反复、持续的aTCMR对动脉内皮细胞的免疫损伤进而导致动脉内膜增生及管腔狭窄,由于这一病变是特异性免疫损伤所致,因此其具有病理诊断caTCMR的特异性;而i-IFTA和t-IFTA不具有病理诊断特异性,需要排除其他可能导致类似病变的因素。
2 移植肾Banff标准中TCMR病理学的研究历程
2.1 第1届Banff移植病理学会议以及TCMR基本病变的确立
移植肾TCMR病变的研究贯穿于Banff移植病理学会议(Banff会议)及其Banff标准不断更新的整个历程中,并且扩展到包括移植肝、移植心脏、移植肺、移植胰腺和移植小肠等在内的各类移植器官TCMR诊断标准的研讨和更新之中[8-9]。
第1届Banff会议讨论的议题是基于会议的发起人Solez教授在其对移植肾计划性活检和移植肾急性肾小管坏死(acute tubular necrosis,ATN)的病理学研究中发现的移植肾间质内淋巴细胞浸润而展开的,进而形成了最初的病理学诊断专家共识[4,10-11]。其中初步的共识为移植肾aTCMR的诊断必须依据肾小管炎和动脉内膜炎2项基本病变,其移植肾活检组织间质内的淋巴细胞浸润虽是常见病变但并不具有诊断特异性,而在此基础上伴有不同程度的肾小管炎或动脉内膜炎才具有诊断意义。这一共识已成为Banff移植肾aTCMR病理学诊断的基石。在1991年第1届Banff会议研讨的基础上,经过随后2年时间的文献复习、个人交流和多个移植中心典型切片的循环阅片,进而于1993年在《Kidney International》上发布了首部移植肾Banff标准(1993年Banff标准)[4],成为Banff会议的第1个成果。1993年Banff标准主要的核心内容包括:(1)确定了移植肾穿刺活检标本的合格性要求;(2)建立了移植肾排斥反应病变的基本定义;(3)确立了移植肾排斥反应的类型及其程度分级;(4)初步建立了排斥反应病变程度的量化计分。这些基本内容不仅确立了移植肾Banff标准的基本内涵,也为其他移植器官活检病理学诊断标准奠定了基础框架。
2.2 TCMR基本病变量化评分的形成
移植肾Banff标准中对急性排斥反应病变的分级和对慢性病变的半定量量化评分主要借鉴及融合了既往的2项肾脏病变评分系统,包括美国国立卫生研究院(National Institute of Health,NIH)移植肾临床协作研究组(Collaborative Clinical Trials in Transplantation,CCTT)发表的急性排斥反应诊断标准(CCTT标准)和慢性移植物损伤指数(chronic allograft damage index,CADI)[12-13]。
CCTT标准于1995年由NIH经多中心研究后确立,将移植肾急性排斥反应依据其病理学表现分为间质-小管型排斥反应和血管型排斥反应2种基本类型,进而依据其中具体的病变程度划分为轻度、中度和重度3级,轻度者仅表现为间质-小管型排斥反应即肾组织间质内淋巴细胞浸润及肾小管炎,中度者在此基础上出现动脉内膜炎,重度者出现动脉全层的炎症甚至纤维素样坏死性动脉炎。1995年Banff会议参考了CCTT标准进而在1997年发布了1997年Banff标准[6],其将移植肾急性排斥反应依据其病理学特征予以程度分级,分为Ⅰ~Ⅲ级,其中Ⅰ级仅表现为移植肾皮质内炎症细胞浸润和肾小管炎,Ⅱ级为在Ⅰ级的基础上出现动脉内膜炎,Ⅲ级为在Ⅱ级的基础上出现动脉全层的炎症甚至动脉管壁平滑肌的纤维素样坏死。进而在Ⅰ级和Ⅱ级分型中分别再依据上述炎症细胞浸润的范围以及肾小管炎、动脉内膜炎的程度进一步分为ⅠA、ⅠB和ⅡA、ⅡB两个亚型(表1)。
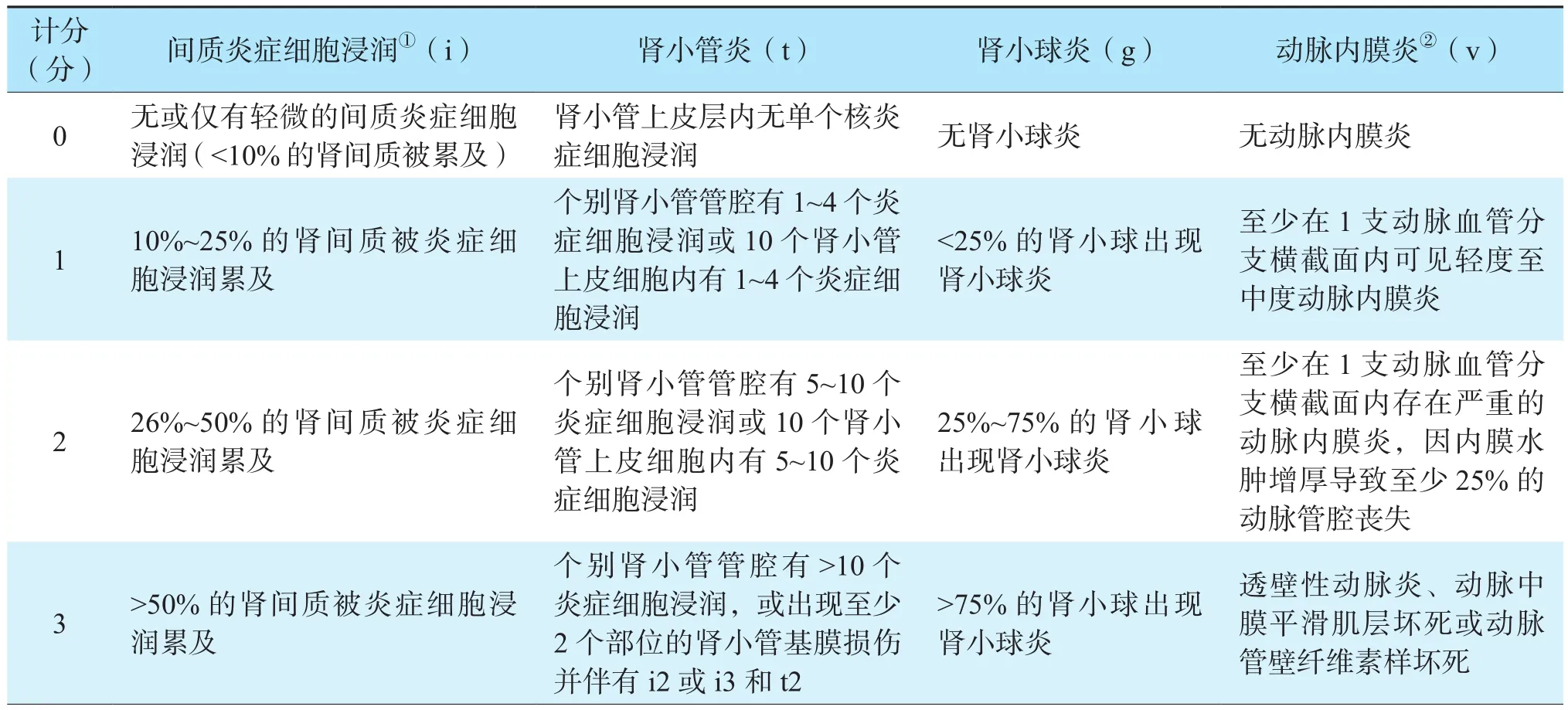
表1 移植肾急性病理学改变及其半定量计分Table 1 Acute pathological changes of renal allograft and its semi-quantitative scoring
CADI由Hayry等在1992年提出,其研究发现在大鼠肾移植模型中,移植肾慢性失功与其病理学改变中的8项病变相关,包括肾间质炎症、肾间质内多形核白细胞浸润、肾间质纤维化、肾小球毛细血管系膜基质增生、肾小球硬化、动脉内膜增生、肾小管萎缩和肾小管腔扩张。随后2年的临床研究也证实上述病变除肾间质多形核白细胞浸润和肾小管腔扩张以外,余下的6项病变可以预示移植肾慢性失功,该6项病变分别依据其病变程度量化计分为0~3分,并可将6项病变汇总计分为0~18分。进而经过1995年Banff会议讨论形成共识,应用CADI对移植肾肾小球、动脉血管、肾小管和肾间质的慢性病变予以半定量计分,以便更精确地对移植肾的慢性病变程度予以分级(表2)。

表2 移植肾慢性病理学改变及其半定量计分Table 2 Chronic pathological changes of renal allograft and its semi-quantitative scoring
上述Banff标准中的半定量量化评分融合了CCTT和CADI标准,可对移植肾排斥反应的急性和慢性病变程度予以精确地诊断,有利于排斥反应的针对性治疗和免疫抑制剂的临床应用研究。
3 移植肾Banff标准中TCMR的基本病变及其诊断分级
3.1 Banff标准中移植肾活检标本合格性的要求
最初的1993年Banff标准制订的移植肾穿刺活检标本的合格性要求为:穿刺活检组织应为移植肾皮质组织,其中至少应包含7只肾小球和1支动脉血管分支,在诊断结论中应明确注明肾小球和动脉血管分支的数量[4]。在1997年Banff标准中进一步将合格的活检标本要求提升为至少应含有10只肾小球和2支动脉血管分支,而含有7只肾小球和1支动脉血管分支仅为临界合格的标本[6]。对于穿刺活检组织标本切片和染色的基本要求包括:每份移植肾穿刺活检组织应切取7张包含多个连续的、不同切面的切片,其中3张行苏木素-伊红(hematoxylin-eosin,HE)染色、3张行过碘酸-雪夫(periodic acid-Schiff,PAS)染色及过碘酸六胺银(periodic acid-silver methenamine,PASM)染色,1张行Masson染色。其中HE染色便于进行整体的镜下观察;PAS染色可以清晰地显示肾小管基膜,有助于肾小管炎及其程度分级的诊断,亦便于观察肾小管萎缩、肾小球炎和肾小球毛细血管系膜增生等慢性肾小球病变,另外也有助于判断微动脉的透明样变;Masson染色便于观察移植肾间质纤维化和动脉内膜增生表现。虽然1993年Banff标准中并没有提及活检移植肾组织的IgA、IgG、IgM、C3、C1q、C5b-9等的免疫荧光染色,但免疫荧光染色对于移植肾的复发性或新发性肾病的诊断必不可少。在最初的1993年Banff标准中并未要求进行电子显微镜(电镜)诊断,但基于复发性或新发性肾病的诊断和近年来对C4d阴性AMR诊断的需要,电镜已经成为移植肾Banff标准中的必须环节,在2005年Banff标准中已经采用电镜诊断慢性AMR所致的肾小管周毛细血管基膜多层病变,在2013年Banff标准中明确要求采用电镜诊断[14],在2015年Banff会议中成立了电镜诊断工作组[15]。
3.2 移植肾aTCMR的基本病变及其程度分级
aTCMR是移植肾最常见的排斥反应类型,其主要的病理学特征为移植肾间质内有数量不等的单个核炎症细胞浸润,进而可见浸润的炎症细胞损伤移植器官的实质结构成分造成免疫损伤,形成2个基本病变,即肾间质内炎症细胞浸润及肾小管炎和动脉内膜炎。
3.2.1 移植肾间质内炎症细胞浸润和肾小管炎及其程度分级 移植肾间质内炎症细胞浸润的病理学特征为肾间质内可见数量不等的单个核炎症细胞浸润,浸润的细胞数量少时可呈微小局灶性或稀疏的散在浸润,数量多时可呈大量弥漫性浸润(图1)。肾间质炎症细胞浸润虽然不具有诊断特异性,但通常是aTCMR的首要表现,肾小管炎往往在移植肾组织内炎症细胞浸润的基础上出现。这里浸润的“单个核炎症细胞”是个总称,不仅包括T细胞和B细胞,也常包括巨噬细胞、NK细胞等,主要为大量CD8+T细胞,以区别于急性感染性炎症时以中性粒细胞为主的炎症细胞浸润。aTCMR中浸润的单个核炎症细胞数量越多、浸润范围越大,则aTCMR的程度越重。

图1 移植肾aTCMR的病理学表现(HE,×200)Figure 1 Pathological findings of aTCMR in renal allograft
历届移植肾Banff标准中均仅观察移植肾内非IFTA区域内的炎症细胞浸润及其程度,但进一步的研究逐渐明确,移植肾内包括了非IFTA区域和IFTA区域在内的整体炎症细胞浸润才能更全面地反映移植肾细胞性排斥反应损伤的本质以及免疫炎症的程度。因此,在2015年更新的Banff标准中,移植肾病变类型及其程度分级中增补了总炎症细胞浸润(total inflammation,ti)[15]。ti程度的分级依据为包括了非IFTA和IFTA区域在内的移植肾皮质组织内整体的炎症细胞浸润程度,可以客观地体现移植肾内炎症细胞浸润的情况。其计分为0、1、2、3分,即无、轻、中、重4个分级。其中“ti0”为整体肾皮质组织内未见炎症细胞浸润或仅为轻度肾间质炎症(炎症细胞浸润范围<总皮质组织的10%);“ti1”为炎症细胞浸润累及范围为10%~25%肾皮质组织内的间质;“ti2”为炎症细胞浸润累及范围为26%~50%肾皮质组织内的间质;“ti3”为炎症细胞浸润累及范围>50%肾皮质组织内的间质。这里需要注意,肾间质内炎症细胞浸润并不具有诊断aTCMR的特异性,必须进一步观察后续的肾小管炎病变。
移植肾肾小管炎是早期或轻度aTCMR的表现之一,只有进而出现的肾小管炎才具有诊断意义。肾小管炎的特征为皮质内的近曲小管和(或)近曲小管直部(直小管)的上皮层内有数量不等的炎症细胞浸润。肾小管炎程度的分级评分方法为以移植肾活检组织内观察和寻找到一个肾小管炎最严重的肾小管部位为依据,观察该肾小管管腔横截面内或其纵截面的10个连续的肾小管上皮细胞内的单个核炎症细胞浸润数量为准,并以“t”代表肾小管炎(tubulitis),计分0、1、2、3分,分别代表无、轻度、中度和重度肾小管炎,其中“t1”为肾小管截面或连续10个肾小管上皮细胞内有1~4个炎症细胞浸润;“t2”为肾小管截面或连续10个肾小管上皮细胞内有4~10个炎症细胞浸润;“t3”为肾小管截面或连续10个肾小管上皮细胞内有>10个炎症细胞浸润(图2)。

图2 移植肾aTCMR的肾小管炎病理学表现Figure 2 Pathological findings of tubulitis of aTCMR in renal allograft
3.2.2 动脉内膜炎及其程度分级 动脉内膜炎的病理学特征为动脉内膜上炎症细胞黏附浸润,引起免疫损伤进而导致内膜水肿增生及管腔狭窄,严重者可导致全层动脉管壁的炎症甚至动脉管壁纤维素样坏死[4]。动脉内膜炎病变是诊断免疫因素所致aTCMR的特异性病变,出现动脉内膜炎提示aTCMR程度较重,往往为中度至重度,出现纤维素样坏死时为重度aTCMR。这里还必须注意2点:其一,目前已明确动脉内膜炎绝非aTCMR所独有,在急性AMR时也可出现,需要结合急性AMR的病理学特征予以鉴别诊断[16-17];其二,在部分caTCMR病例中,在移植肾间质纤维化和肾小管萎缩等慢性病变的同时,通常可见肾小管炎等上述aTCMR的病理学特征,提示aTCMR仍在持续活动和进展,这种活动性aTCMR引起的炎症损伤是caTCMR的重要致病因素。
动脉内膜炎程度的评分方法为在移植肾活检组织内至少1支动脉或动脉血管分支存在炎症改变即可诊断并予以分级。其依据为观察该动脉内膜是否有炎症细胞浸润、动脉内膜水肿甚至动脉全层炎症或者管壁平滑肌纤维素样坏死,以“v”代表动脉血管,计分0、1、2、3分,分别代表无、轻度、中度和重度动脉内膜炎。其中“v1”为在移植肾穿刺活检组织内至少有1支动脉血管分支的横截面内可见轻度至中度动脉内膜炎;“ v2”为至少1支动脉血管分支横截面有严重的动脉内膜炎,即内膜水肿增厚导致至少25%的动脉管腔丧失;“v3”为至少1支动脉血管分支横截面出现了透壁性动脉炎、中膜平滑肌层甚至动脉管壁全层纤维素样坏死(图3)。
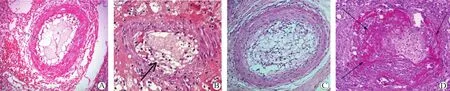
图3 移植肾aTCMR的动脉内膜炎病理学表现Figure 3 Pathological findings of endoarteritis of aTCMR in renal allograft
3.3 移植肾caTCMR的基本病变及其程度分级
在既往的Banff标准中,移植肾caTCMR的基本病变主要为CAV。近年来,在国际多中心研究和多次Banff会议研讨的基础上于2015年Banff会议上达成共识[15],即移植肾i-IFTA和t-IFTA也是高度提示caTCMR的病理学特征,继而在2017年和2019年Banff标准中均将i-IFTA和t-IFTA病变补充作为诊断caTCMR的重要病变依据[7,18-19]。当然,这里首先需要注意排除其他因素所致的慢性间质-小管病变,如病毒感染等[20-21]。
3.3.1 CAV及其程度分级 CAV是指移植肾内各级动脉血管分支因反复的免疫因素损伤、修复和增生导致动脉血管内膜明显增生及增厚、管腔狭窄甚至闭塞,造成移植肾组织慢性、持续性缺血,最终导致移植肾失功。在这一病变过程中还有血管内皮细胞活化、细胞因子产生、细胞增生与迁移等多种机制的参与。CAV是移植肾慢性排斥反应损伤的一部分,是慢性排斥反应在移植肾动脉血管上的局部表现,也是所有带血管的移植器官慢性排斥反应的特征性组织病理学表现。因此,也常将CAV等同于慢性排斥反应,借此依据其诊断慢性排斥反应。虽然CAV是caTCMR的特异性病变之一,但近年的研究也明确显示,其也可见于慢性活动性AMR,是两种排斥反应机制共同损伤的结果。其病变特征为移植肾内各级动脉血管分支内膜增生、增厚导致管腔狭窄甚至完全闭锁,移植肾实质组织缺血萎缩,进而纤维组织增生致移植肾广泛纤维化。
移植肾CAV病变主要依据动脉内膜增厚及其所致管腔狭窄的程度予以分级,以“v”之前冠以代表“慢性(chronic)”的“c”即“cv”代表慢性移植肾动脉血管病,其中依据动脉管腔横截面内有无内膜增厚以及内膜增厚所致的管腔狭窄程度(管腔面积丧失<25%、26%~50%或>50%),并计分0、1、2、3分,分别代表无、轻度、中度和重度CAV(图4)。
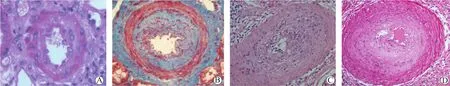
图4 移植肾caTCMR的CAV病理学表现Figure 4 Pathological findings of CAV of caTCMR in renal allograft
3.3.2 i-IFTA和t-IFTA及其程度分级 Banff会议对于i-IFTA和t-IFTA病变的认识,经历过由忽视到逐渐予以重视并最终纳入Banff标准的过程[22-23]。最初的Banff会议认为i-IFTA和t-IFTA不具有诊断价值,在移植肾活检组织的病理学诊断中应避开上述IFTA区域,而必须观察非IFTA区域才具有诊断意义,因此在早期,历届移植肾Banff标准中均未将i-IFTA纳入诊断内容。直到2015年Banff会议经过研讨达成共识,即i-IFTA是独立于AMR因素而存在的、与术后1年的移植肾功能以及移植肾长期存活预后有明确相关性的危险因素,i-IFTA病变较非IFTA区域内的炎症细胞浸润病变更能预示移植肾慢性失功[24],且其致病机制提示移植肾很可能处于低免疫抑制状态。因此,在最新的2017年和2019年Banff标准中均将i-IFTA和t-IFTA病变作为诊断caTCMR 的重要病理学依据。
i-IFTA的病理学特征为IFTA区域内的炎症细胞浸润(图5)。其程度分级依据IFTA内的炎症细胞浸润的范围大小,计分为0、1、2、3分,分别为无、轻度、中度和重度i-IFTA;其中“i-IFTA0”为IFTA区域内无炎症细胞浸润或者仅有极轻微或极少的炎症细胞浸润,或肾皮质的实质组织内IFTA范围<10%;“i-IFTA1”为10%~25%的IFTA区域内有炎症细胞浸润;“i-IFTA2”为26%~50%的IFTA区域内有炎症细胞浸润;“i-IFTA3”为>50%的IFTA区域内有炎症细胞浸润。对于移植肾被膜下局部的IFTA区域内的炎症细胞浸润不能作为判定该病变的依据。
图5 移植肾i-IFTA的病理学表现Figure 5 Pathological findings of i-IFTA in renal allograft
t-IFTA的病理学特征为移植肾皮质IFTA区域内的肾小管炎,由于IFTA区域内的肾小管多数情况下已经存在不同程度的萎缩,因此t-IFTA实则为IFTA区域内的萎缩肾小管炎,即轻度萎缩的肾小管上皮层内出现的炎症细胞浸润(图6),该萎缩肾小管是指轻度萎缩所致管腔直径较正常肾小管缩小(肾小管管腔直径萎缩<25%)。t-IFTA程度分级依据其移植肾皮质IFTA区域内的萎缩肾小管炎的程度,计分为0、1、2、3分,分别为无、轻度、中度、重度t-IFTA,其与前述肾小管炎的分级计分相似,即依据单个肾小管截面内或10个连续的肾小管上皮细胞内炎症细胞浸润的数量予以分级。其中“t-IFTA0”为无萎缩肾小管炎;“t-IFTA1”为轻度萎缩的肾小管截面内或连续10个肾小管上皮细胞内有1~4个炎症细胞浸润;“t-IFTA2”为轻度萎缩的肾小管截面内或连续10个肾小管上皮细胞内有5~10个炎症细胞浸润;“t-IFTA3”为轻度萎缩的肾小管截面内或连续10个肾小管上皮细胞内有>10个炎症细胞浸润;完全萎缩的肾小管不能作为诊断和分级判定的依据。

图6 移植肾t-IFTA的病理学表现Figure 6 Pathological findings of t-IFTA in renal allograft
i-IFTA 和t-IFTA病变的确立对于移植肾caTCMR的病理学诊断具有重要的意义,其不仅是对caTCMR病理学诊断中CAV这一单一病理学依据的补充,更从病理机制方面反映出caTCMR的免疫损伤是由持续的、未能及时诊断和治疗的aTCMR进展所致,因此在临床治疗中,对于aTCMR需要借助活检予以早期发现和积极的干预治疗,以保障移植肾的长期带功存活。同时需要注意,在2017年Banff标准中亦强调[18],i-IFTA 和t-IFTA病变并不具有诊断特异性,其也可见于BK病毒感染、肾盂肾炎、输尿管阻塞、复发性或新发性肾病甚至AMR等,在诊断和鉴别诊断中需要排除这些caTCMR以外的因素[25-27]。
4 小 结
移植肾TCMR是肾移植术后常见的排斥反应类型,其明确诊断必须借助移植肾穿刺活检病理学诊断。移植肾aTCMR的病理学特征为肾小管炎和动脉内膜炎;caTCMR的病理学特征除CAV以外,也包括i-IFTA和t-IFTA,并作为重要的病理学特征在2017年Banff标准中被确立。在移植肾活检组织TCMR的诊断中,可借助上述病变及其程度分级对早期发生的TCMR予以及时的诊断和有效的治疗,预防其进展为caTCMR,以保障移植肾和受者的长期存活。
