运动营养补充剂相关肾脏损害
2021-03-16吴晓梅综述谢红浪审校
吴晓梅 综述 谢红浪 审校
运动员常通过运动营养补充剂来提高运动表现,包括蛋白质、氨基酸及其衍生物(包括肌酸、谷氨酰胺、左旋肉碱等)、维生素和矿物质、激素类[包括雄激素合成代谢类固醇(androgenic-anabolic steroids,AAS)、睾丸增强剂等]。近年来对于“完美身材”的崇拜也使得运动补充剂的使用在健身爱好者中成为普遍现象。据2018美国全国大学体育协会的统计,23 028例美国大学生运动员广泛使用蛋白补充剂(41.5%),氨基酸及其衍生物(26.4%),含其他添加剂的多种维生素和矿物质(16.4%),AAS(0.2%),以及睾丸素增强剂(0.7%)[1]。近年来运动营养补充剂所引起的健康问题在国外备受关注。肾脏作为外源性物质代谢和排泄的重要场所,是运动营养补充剂最常殃及的器官之一。本文拟就常见的运动营养补充剂可能造成的肾脏损害进行简述。
雄激素合成代谢类固醇
睾酮及其合成的激素衍生物被统称为AAS。AAS可提高神经肌肉性能、增加肌肉纤维,被专业运动员和业余健身爱好者用于提高身体形象和运动表现。
美国2007年的统计数据显示67%的运动员曾使用AAS[2]。AAS滥用并不限于专业健美运动员。事实上,业余健身者在AAS用户中所占的比例最大。在美国,高水平运动员最常使用的AAS包括睾酮、司坦唑醇、诺龙和勃地酮,而在业余健美运动员中,勃地酮、诺龙、群勃龙和睾酮是最常见的[3]。最近的一项研究估计,有290~400万13岁至50岁的北美人曾使用AAS,其中32.5%的人出现了依赖性[4]。这些统计数字表明,AAS成瘾已经成为一个公共卫生问题[3]。
临床和病理表现AAS所导致的肾脏并发症通常发生于长期大剂量使用AAS后。肾脏损伤从单纯血清肌酐(SCr)、血尿氮(BUN)和尿酸的轻度短暂升高到继发于横纹肌溶解或肝损伤的急性肾损伤(AKI)(即胆汁管型肾病、胆固醇栓塞性肾病)不等。尿液检查也表现多样:从少~中等量或肾病范围蛋白尿至完全性肾病综合征,伴或不伴少量镜下血尿。
AAS所致肾损害病理表现亦具有多样性。El-Reshaid[5]等分析22例AAS相关肾损害患者的肾活检病理结果:8例为局灶节段性肾小球硬化(FSGS),4例肾血管硬化症,3例慢性间质性肾炎,2例急性间质性肾炎,2例肾钙质沉积症合并慢性间质性肾炎,1例新月体性肾炎,1例膜性肾病,1例硬化性肾小球肾炎。在随访期间,研究者发现诊断为FSGS的患者暴露于AAS的时间较长,发病时间更晚,预后更差。另一方面,间质性疾病,即急性间质性肾炎或者慢性间质性肾炎,暴露于AAS的时间较短,发病较早,且在停用AAS后病情稳定或者改善。
发病机制
肾小球损伤 继发性FSGS是AAS肾损害的常见病理表现,其机制可能为直接肾小球毒性,以及体质量增加(类似于肥胖)引起的肾小球高滤过。AAS的直接肾小球毒性体现为足细胞损伤:体外实验表明足细胞表达雄激素受体,而体内实验则证实内源性和外源性睾酮均可介导足细胞损伤和凋亡(骨架蛋白desmin表达上调和足细胞nephrin丢失[6])。另外, Shortliffe等[7]在幼年雄性大鼠中观察到,睾酮与膀胱和肾脏质量、膀胱平滑肌增加相关。外源性睾酮治疗者的肾脏中似乎肾小球数量较少但体积增大,也可引起肾小球高滤过。
肾小管损伤 Satoshi等[8]研究发现,内源性雄激素与提示肾近曲小管损伤的生物标志物的排泄量显著相关。该作者在切除睾丸的大鼠实验中观察到,生理剂量睾酮可使尿液中肾小管刷状缘上表达的酶类[如尿氨肽酶(LAP),γ-谷氨酰转肽酶(γ-GT),以及碱性磷酸酶(ALP)]含量增加,这些酶类是提示肾小管损伤的标志物。另外,尿液葡萄糖,胱抑素C以及β2微球蛋白等通过肾小管重吸收的分子含量也增加,提示AAS也可影响肾小管重吸收功能。
释放炎症因子 睾酮可能还参与促炎细胞因子如肿瘤坏死因子α(TNF-α)、白细胞介素(IL)-1β和IL-6的产生,这些细胞因子可介导肾脏炎症和慢性肾脏疾病(CKD)进展。Metcalfe等[9]证实内源性睾酮和外源性睾酮的使用,均显著增加了肿瘤坏死因子α(TNF-α)的产生和单侧输尿管梗阻期间肾脏的促凋亡和促纤维化信号,导致更多细胞死亡,加重肾小管间质纤维化和肾功能障碍。因此,TNF-α可能是参与AAS相关肾损害的关键细胞因子。
影响血压调节 研究显示,外源性睾酮参与了高血压的形成[10]。睾酮使肾动脉血压升高,可能是通过增强肾素-血管紧张素-醛固酮系统(RAAS)和上调内皮素而实现的,RAAS通过促进肾小管水钠重吸收而增加血压和水的潴留[11]。对雄性大鼠的实验研究表明,雄激素可增强血管紧张素Ⅱ诱导的肾血管反应,该反应部分通过上调Rho激酶信号通路[12],增加外周血管阻力,从而导致血压升高。而睾酮直接或间接上调的内皮素则可通过其表达在肾脏血管平滑肌细胞中的A型受体导致血管收缩。此外,Loh等[13]证实睾酮可介导近曲小管上水通道蛋白(aquaporins,AQP)-1和AQP-7,集合管上AQP-2、AQP-4和AQP-6上调,增加水的重吸收,最终导致大鼠平均动脉压升高。这些发现表明AAS可以通过多种途径导致高血压和CKD。
胆汁淤积和肾钙质沉着 研究证实,17-α-羟化雄激素(最常见的如司坦唑酮)均具有肝脏毒性,可导致胆汁淤积相关的AKI[14],与胆汁酸对肾脏的损害机制有关。此外,还有AAS引起高钙血症以及肾钙质沉着症的报道[15],其潜在发病机制尚不明确。
氧化应激 AAS可能通过产生活性氧和促进氧化应激在CKD的进展中发挥作用。Frakenfeld等[16]在大鼠实验中发现,AAS可扰乱大鼠肾脏的氧化还原稳态。雄性大鼠中,切除睾丸可减轻氧化应激介导的肾纤维化和输尿管梗阻后的蛋白尿[17]。睾酮可直接引起氧化应激,也可通过激活RAAS和内皮素(通过上调NADPH氧化酶)间接引起氧化应激(图1)[18]。
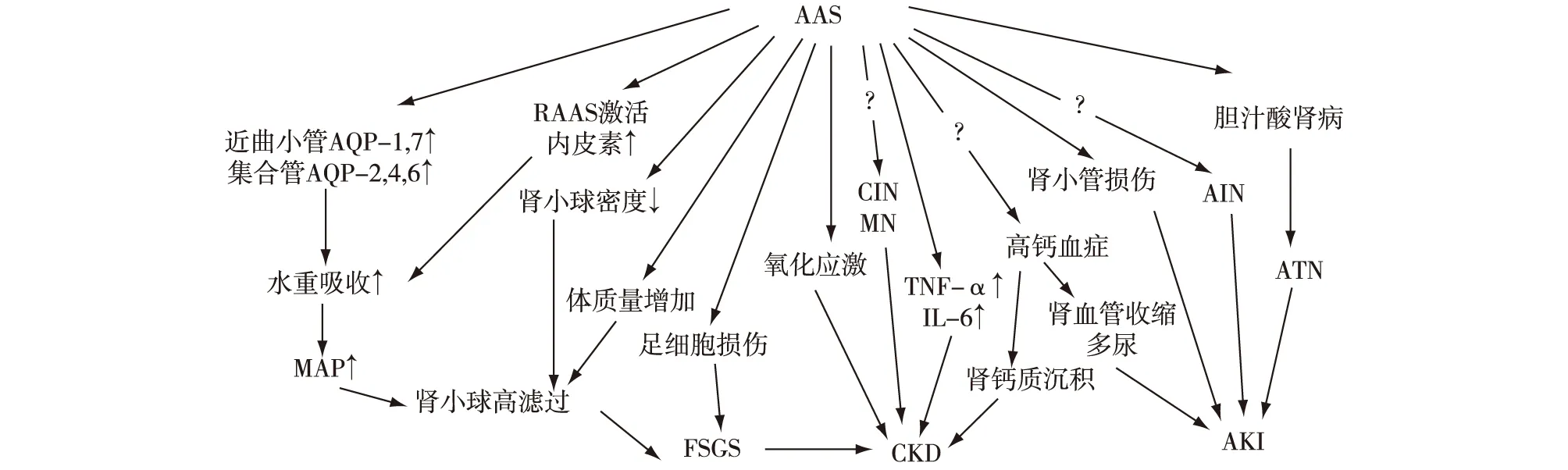
图1 AAS相关肾损害机制[6-18]AAS:雄激素类促合成代谢类固醇;AQP:水通道蛋白;RAAS:肾素-血管紧张素-醛固酮系统;CIN:慢性间质性肾炎;MN:膜性肾病;AIN:急性间质性肾炎;ATN:急性肾小管坏死;MAP:平均动脉压;FSGS:局灶节段性肾小球硬化;CKD:慢性肾脏疾病;AKI:急性肾损伤;TNF-α:肿瘤坏死因子α;IL-6:白介素-6;?:具体机制不明
肌内注射维生素补充剂
肌内注射补充的维生素ADE常用于治疗牛和马的维生素缺乏和感染,是含有脂溶性维生素A、D、E的兽用产品。该类药物不会促进肌肉肥大,但其本身填充在肌肉表面或皮下组织中,会造成一种视觉上肥大的结果。兽用维生素ADE剂量平均为5 ml/120d,而健身者们的使用剂量却远大于此。过度和长期肌内注射维生素ADE相关肾脏损害中AKI和CKD均有报道[19-20],从相对症状轻微和可逆性的AKI到终末期肾病不等。
高钙血症的发病机制Daher等[21]收集的16例维生素ADE相关肾损害病例中11例患者有高钙血症,9例有25羟维生素D[25(OH)D]水平增高,6例患者甲状旁腺水平(PTH)<10 pg/ml。这类患者经大量输液、皮质激素和袢利尿剂以控制钙离子水平和并发症,高钙血症逆转后,肾功能趋于改善[19-20]。因此高钙血症是维生素ADE诱发肾脏损害的主要发病机制。
肌内注射的维生素ADE中含有25(OH)D,可导致维生素D摄入过多。但事实上,研究发现,从注射维生素ADE到出现症状的潜伏期长达28个月,长于预期时间。另外注射充填物(如石蜡、硅胶和聚甲基丙烯酸甲酯等)也会引起类似的高钙血症和肾脏损害[22],与维生素ADE使用者不同的是,这些患者体内存在1,25(OH)2D水平增高,但25(OH)D水平正常或者偏低。因此肌肉注射剂中的25(OH)D可能不是引起高钙血症的唯一原因。肉芽肿的形成和肾外转化可能是另外的共同机制,即局部注射维生素ADE和化妆品均会在局部形成肉芽肿,这些肉芽肿可表达1-α-羟化酶,催化25(OH)D转化为其活性形式的1,25(OH)2D[23],从而增加肠道对钙的吸收,并提高血清钙水平。该类疾病患者使用糖皮质激素可降低血钙也间接证实了这一机制,因为其能有效降低与肉芽肿性疾病相关的高血钙症。
注射硅酮和聚甲基丙烯酸甲酯的患者发病平均潜伏期约为95个月,比维生素ADE的潜伏期更长,提示注射剂中25(OH)D的吸收可能加速症状的出现。
此外,维生素ADE继发的维生素A过多症也可导致高钙血症,其机制可能与破骨细胞的维生素A受体增加骨重吸收有关[24]。
高钙血症肾损害的机制高钙血症可通过多种机制引起肾损害:(1)高钙血症易引起恶心、呕吐导致脱水,肾前性血容量不足引起肾前性AKI;(2)钙离子直接作用于血管平滑肌导致可逆性血管收缩,减少肾血流量,从而导致肾前性AKI[25];(3)持续高钙血症可能通过钙敏感受体抑制Henle袢升支粗段氯化钠重吸收(损伤逆流机制)和下调AQP-2和AQP-3的表达(干扰尿液浓缩的能力)而导致获得性肾性尿崩症和多尿[26],导致肾前性AKI;(4)继发于高钙血症的高钙尿症也会导致超过溶解浓度的磷酸钙在Henle袢降支细段基底膜上形成Randall斑块,这些斑块向管腔或间质生长,各自作为钙-草酸盐黏附的锚定部位而引起肾结石或肾钙质沉着症[27],最终导致不可逆性损害,并易发展为CKD(图2)。

图2 肌内注射维生素ADE相关肾损害机制25(OH)D:25羟维生素D;1,25(OH)2D:1,25二羟维生素D;CKD:慢性肾脏病;AKI:急性肾损伤
氨基酸及其衍生物
肾脏通过调节氨基酸的合成、降解、滤过、重吸收和尿排出在氨基酸的稳态中起着重要的作用。然而,高蛋白转化率和慢性高蛋白摄入可影响肾脏的血液动力学,导致肾小球和肾小管肥大,进而引起肾小球硬化和间质纤维化,最终导致不可逆的肾脏形态学改变和终末期肾病。RAAS、胰岛素样生长因子1、前列腺素和一氧化氮已被确定为这些有害途径的主要介质[28]。因此氨基酸及其衍生物的肾脏安全性也需进一步评估。
肌酸肌酸是一种肌源性补充剂,能增加三磷酸腺苷(ATP)的产生,而ATP能增加肌肉收缩所需的能量。研究显示肌酸在力量训练,特别是短时间、高强度的训练中有一些益处,因此肌酸也越来越流行。
Davani-Davari等[29]在纳入了19项研究的Meta分析中,探讨了小剂量(≤20 g/d)或大剂量(>20 g/d)肌酸补充对健康人肾功能不同方面的影响。这些指标包括SCr和BUN,尿肌酐清除率,尿钠和钾、白蛋白排泄率,尿液甲胺和甲醛等肌酸代谢的潜在肾毒性副产物等。结果表明,短期和长期(5天到5年不等)补充肌酸对肾功能没有明显的临床不良影响。
然而,肌酸相关的肾毒性仍可见较多个案报道,包括2例患者超剂量和疗程使用肌酸后出现急性间质性肾炎。另一例患者摄入推荐剂量、疗程的肌酸后出现急性肾小管坏死[30]。3例患者在停用肌酸后肾脏功能完全恢复。虽然在健康受试者中长期使用肌酸补充剂并没有慢性肾脏损害的证据,但即使是按推荐剂量补充肌酸也有可能造成肾脏损害。
谷氨酰胺尽管既往研究显示健康运动员短期(数小时内20~30g)或长期(0.1 g/kg,4次/d,连续2周)补充谷氨酰胺均无明显不良反应。然而,Galera等[31]在一项随机、交叉、双盲研究中证实,中年受试者口服谷氨酰胺0.5 g/(kg·d),可使BUN和SCr升高,GFR下降。另外,有研究显示谷氨酰胺可引起糖尿病肾病大鼠肾小球硬化和SCr升高,其机制可能与IL-1β、IL-6等炎性细胞因子的过度表达有关[32]。然而在某些实验条件下,如脓毒症引起的AKI和顺铂肾毒性,谷氨酰胺被证实具有肾脏保护作用[33]。考虑到谷氨酰胺对肾脏结构和功能的潜在危害,在没有证据支持谷氨酰胺缺乏的情况下补充是无益的,甚至会损害肾功能,特别是对有相关基础疾病(如CKD或糖尿病)的运动员和健美运动员。
左旋肉碱左旋肉碱可改善血液透析患者因肉碱清除而出现的肌肉功能受损、伤口愈合减少、红细胞生成素抵抗性贫血和免疫功能异常,故在血液透析患者广泛使用。此外,左旋肉碱也被证实在CKD、AKI、糖尿病患者中有一定的积极作用[34]。其肾脏保护的机制包括抑制活性氧产生、自由基清除、抑制脂质过氧化、抑制细胞凋亡、抗炎作用、抑制细胞外基质重塑和解决肉碱缺乏。然而,左旋肉碱对运动员和健美运动员肾脏的风险和益处还未被评估。根据Liu等[35]进行的一项调查,大鼠口服0.3~0.6 g/kg的左旋肉碱8周后,体重和肾脏脂质水平均有下降。此外,左旋肉碱通过有机离子转运蛋白改变肾脏蛋白含量,可能导致肾功能障碍。因此,目前尚无任何明确证据可以评估运动员和健美运动员补充肉毒碱的肾脏安全性。
综上所述,运动营养补充剂的肾脏安全性需要受到重视,值得注意的是,有时候其肾脏损伤机制并非来自运动营养补充剂本身,而在于在缺乏医疗监督的情况下,对多种营养补充剂进行组合,或者超剂量的滥用。因此即使是相对安全的运动营养补充剂也必须按照推荐剂量和周期使用,并在使用期间监测肾脏功能。对于肾脏科医生,了解某些运动员常用的营养补充剂,确定其中有哪些成分以及其对肾脏的影响,对于解释肾脏损伤和有关此类物质的消费建议具有重要意义。
