不同温度和酸浓度下蔗糖转化反应速率的研究和对比
2021-03-14冯金涛姚翠霞
冯金涛,姚翠霞
(临沂大学化学化工学院,山东临沂 276000)
蔗糖广泛存在于许多植物中,是各种食品中常用的甜味剂,也是自然界中分布较广的非还原性二糖。蔗糖在酸或者蔗糖酶的作用下,水解生成葡萄糖和果糖,其水解产物具有还原性,该反应是化学动力学较早经过定量研究的反应之一。反应进行的快慢以及反应过程的机理研究是化学动力学的研究范畴。化学动力学的基本任务之一就是了解各种因素对化学反应速率的影响,为人们提供选择和掌控反应进行的主动权。在化学反应的动力学研究中,速率常数k是一个非常重要的物理量[1]。人们可以根据速率常数k的数值大小直接对反应的快慢进行判断。
1 材料与方法
1.1 试剂
蔗糖、二次蒸馏水、盐酸水溶液(1 mol/L和 3 mol/L)。
1.2 仪器与设备
WZZ-2S型自动旋光仪(上海仪电物理光学仪器有限公司)、水浴锅、分析天平、玻璃搅拌棒、具塞三角瓶、移液管、秒表和烧杯。
1.3 实验方法
本文分别配制不同浓度的酸和蔗糖溶液。以蔗糖溶液配制为例,先用分析天平称取15 g的蔗糖,放入100 mL烧杯中,再加入75 mL二次蒸馏水,得到质量摩尔浓度为0.58 mol/kg的蔗糖溶液。在酸的催化下,蔗糖转化为葡萄糖和果糖,在反应过程中,水分子的消耗相对于水的浓度来说是微不足道的,水的浓度可近似为恒定不变,因此该反应可以近似作为一级反应处理。根据一级反应及蔗糖转化反应的动力学特征,可得到反应系统的旋光度随反应时间t的函数关系,见式(1)。以ln(αt-α′)对t做直线,该直线斜率的相反数为所求反应的速率常数。反应速率受温度、浓度、催化剂和压力等因素的影响。在实验过程中,压力为当前大气压恒定不变,本文主要考虑温度和酸的浓度对蔗糖转化反应速率的 影响。
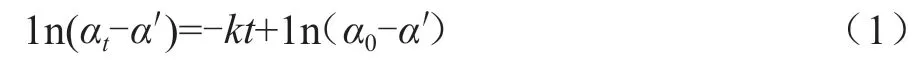
式中:α0为初始旋光度;αt为t时刻的旋光度;a'代表反应完全之后溶液的旋光度。实验过程中,为了减少温度不稳定对测量结果的影响,用移液管取30 mL蔗糖溶液置于100 mL具塞三角瓶中。移取30 mL HCl溶液于另一只100 mL具塞三角瓶中,将蔗糖溶液和盐酸溶液分别恒温水浴15 min,取出两只三角瓶,将盐酸和蔗糖溶液充分混合,将混合液装满旋光管。擦净后置于旋光仪中,盖上槽盖。实时监测反应体系的旋光度随时间的变化,每隔3 min记录1次数据,每组实验记录8次。反应过程中体系的温度由恒温水浴中的水循环通过旋光管外层套管实现。将剩余反应混合液置于60 ℃水浴中,恒温30 min加速反应,然后在实验温度下冷却10 min,按上述步骤测定其旋光度,其旋光度即为α’。
2 结果与分析
在温度为30 ℃,盐酸浓度为1 mol/L的条件下,通过实验数据绘制反应体系的旋光度随时间的变化曲线,如图1所示。图中2条拟合线分别来自同一型号的两台旋光仪。从数据处理结果可以看出,在相同的初始条件下,通过计算得到的蔗糖转化反应的速率常数分别为0.009 69 min-1和0.010 28 min-1。为了降低实验设备带来的系统误差,取2次实验的平均值作为相同条件下蔗糖转化反应的速率常数,其他温度及浓度条件下的速率常数均采用这种方法来处理。
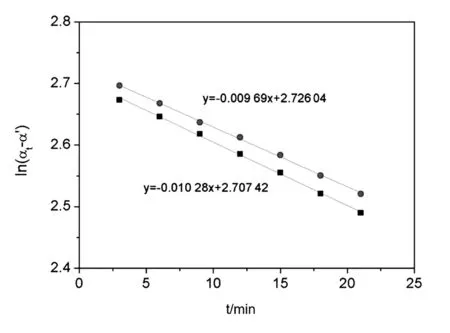
图1 不同温度和酸浓度条件下蔗糖转化反应数据处理对比图
2.1 温度的影响
(1)控制反应物盐酸的浓度为3 mol/L。当实验温度为20 ℃时,如表1所示,A组计算得到的速率常数为0.012 120 min-1;当反应温度为30 ℃时,B组计算得到的反应速率常数为0.039 675 min-1。由量子力学和统计热力学可知,分子有多种运动形式。分子的能量由分子的平动、振动、转动,电子的运动、核的运动等多种形式的能量构成。其中分子的平动能和转动能与温度的一次方成正比。温度越高,分子的平动能和转动能越高,因此反应物蔗糖分子的热力学能越高,反应速率增加。根据一级反应的动力学特征,蔗糖转化反应的半衰期可通过公式计算得到。根据反应速率常数计算得到的不同温度下蔗糖水解反应的半衰期分别为57.2 min和17.5 min。
通过2组实验对比发现,温度越高,蔗糖水解反应的速率常数越大,半衰期越小。温度升高10 ℃,蔗糖转化反应的速率常数增加至3.2倍。该结论符合van,t Hoff近似规则:即温度每升高10 ℃,反应速率大约增加2 ~ 4 倍[2]。阿伦尼乌斯根据大量的实验数据,总结出对于速率与温度呈指数关系的一类反应的温度影响速率常数的经验公式[3-5]。
Arrhenius方程为:
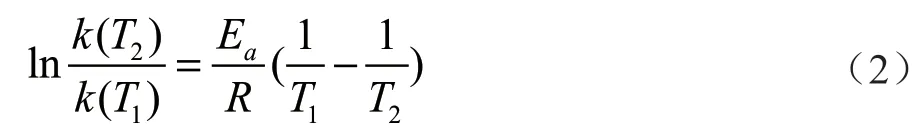
当盐酸的浓度为3 mol/L时,20~30 ℃该反应的活化能为87 617.5 J/mol。
(2)控制反应物盐酸的浓度为1 mol/L如表1所示。当实验温度为20 ℃时,C组中计算得到的速率常数为0.002 925 min-1;当反应温度为30 ℃时,D组计算得到的反应速率常数为0.009 985 min-1。根据反应速率常数计算得到的蔗糖水解反应的半衰期分别为236.9 min和69.4 min。通过实验对比发现,温度越高,速率常数越大,半衰期越小。温度升高10 ℃,蔗糖转化反应速率增加至3.4倍,与 3 mol/L浓度的盐酸组增长幅度相接近,同样符合van,t Hoff近似规则。根据阿伦尼乌斯经验式,当盐酸的浓度为1 mol/L时,20~30 ℃该反应的活化能为 90 715.517 6 J/mol。
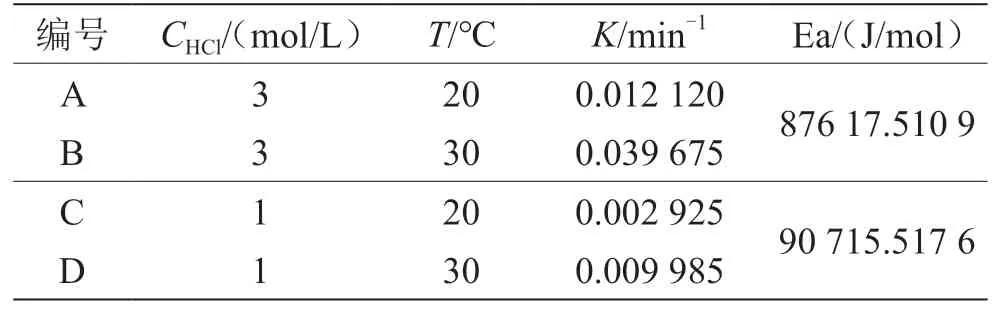
表1 不同温度、不同盐酸浓度下蔗糖转化反应的速率常数和活化能
为了衡量温度变化对速率常数的影响程度,进而对比不同实验的温度对反应速率的影响,本文定义了单位温度变量所引起的速率常数的改变量。当盐酸浓度为1 mol/L时,平均单位温度所引起的速率常数的变化率为0.000 706。当盐酸浓度为 3 mol/L时,平均单位温度所引起的速率常数的变化率 为0.002 756。
2.2 催化剂浓度的影响
控制实验温度为20 ℃,当反应物盐酸的浓度为3 mol/L,表1中A组计算得到的速率常数为 0.012 120 min-1;当反应物盐酸的浓度为1 mol/L时,C组计算得到的反应速率常数为0.002 925 min-1。 当温度保持20 ℃不变,将催化剂盐酸的浓度从 1 mol/L增加至3 mol/L,反应的速率常数增加4.1倍。控制实验温度为30 ℃,当反应物盐酸的浓度为3 mol/L,B组计算得到的速率常数为 0.039 675 min-1;当反应物盐酸的浓度为1 mol/L时,D组计算得到的反应速率常数为0.009 985 min-1。当温度保持30 ℃不变,将催化剂盐酸的浓度从1 mol/L增加至3 mol/L,反应速率增加4.0倍。通过对比发现,反应温度无论是20 ℃还是30 ℃,当催化剂酸的浓度增加相同浓度时,反应速率常数的变化率是一样的。
对于基元反应,活化能有明确的物理意义,就是将具有平均能量的反应物分子变成具有平均能量的活化分子所必须给予的能量称为活化能[6-9]。对于复杂反应,实验活化能没有明确的物理意义,仅仅是组成复杂反应的一些基元反应活化能的组合,其组合方式取决于表观速率常数与基元反应速率常数之间的关系。活化能的大小可以用参与反应的物质的化学键键能的大小进行估算。对于蔗糖转化反应,在纯水中反应速率极慢,反应的活化能较高。为使水解反应加速,常选择酸作为催化剂。相对于非催化蔗糖转化反应,催化剂酸的存在提供了一种能量上有利的反应机理,反应途径改变,从而使蔗糖转化反应能在可行的室温温度下进行。从两组数据对比可以看出,反应物盐酸的浓度从1 mol/L升高至 3 mol/L时,活化能降低,提高了活化分子的百分数,进而提高了反应速率。该结论再次证明催化剂能够改变反应途径,降低活化能,从而加速反应。
为了更直观地反映实验温度和催化剂浓度对反应速率的影响,图2为4种不同初始条件下蔗糖转化反应的速率常数数值,为了方便数值的比较,将速率常数k的数值扩大1 000倍显示在图中,并用k’表示,k’=k×103。当盐酸的浓度和实验温度同时提升时,蔗糖转化的速率会大幅度提升。
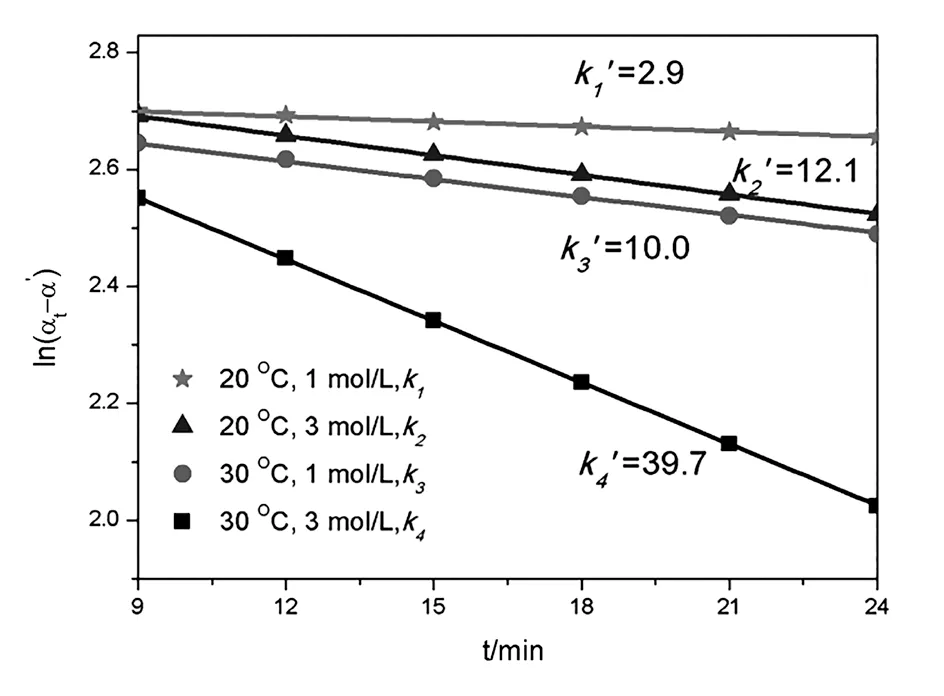
图2 不同条件下蔗糖转化的速率常数对比
3 结论与讨论
本文检测了蔗糖转化反应的速率常数在不同反应温度和催化剂浓度下的影响,并对所得到的速率常数进行活化能计算,得出以下结论,该反应符合van,t Hoff近似规则,控制催化剂浓度及温度能够有效降低蔗糖转化反应的活化能。
