海马p75神经营养因子受体在老年小鼠术后认知障碍中的作用
2021-03-09高玉竹纪木火周志强
高玉竹 , 纪木火 , 周志强
术后认知功能障碍(postoperative cognitive dysfunction,POCD)是麻醉手术后常见的中枢神经系统并发症[1],表现为记忆力、注意力、信息处理过程及认知灵活性下降等,尤多见于老年患者[2]。POCD严重影响其生活自理能力和生活质量,显著增加家庭与社会经济负担[1,2]。然而,目前有关POCD的发病机制仍不清楚。p75神经营养因子受体(p75 neurotrophin receptor,p75NTR),是导致众多神经退行性疾病神经行为异常的关键因素[3]。
研究表明,p75NTR参与成年小鼠炎症诱导的突触损伤及认知障碍[4],敲除p75NTR基因,可有显著上调海马神经元突触密度并改善小鼠认知功能[5,6]。然而,有关p75NTR信号通路在POCD中的作用尚不清楚。因此,本研究旨在探讨海马p75NTR在POCD中的作用及机制,为POCD的防治提供新的理论依据。
1 材料与方法
1.1 实验动物与材料 老年雄性C57BL/6小鼠(18~20月龄)30只,购置于常州卡文斯实验动物有限公司。采用随机数字法分为3组:对照组、手术组及手术+TAT(TAT-Pep5-Calbiochem,p75NTR抑制剂)组,每组10只。手术后第6天行条件性恐惧实验,第7天行场景性条件性恐惧实验。行为学训练之前30 min腹腔注射TAT(3 mg/kg;506181,Sigma)或等容量生理盐水。
1.2 POCD模型建立 将手术组小鼠置于透明半封闭呼吸环路麻醉箱中,箱外配有含二氧化碳吸附剂的回收装置。小鼠放入麻醉箱内前预充1.5%异氟醚+100% O2。待小鼠翻正反射消失后,取右侧卧位,保持呼吸道通畅,谨防误吸,维持麻醉30 min。麻醉箱中气体浓度由Vamos持续监测多参数麻醉气体监护仪进行连续监测。手术组小鼠在麻醉后迅速移至手术台,红霉素眼药膏涂抹眼部,将圆锥形面罩固定在小鼠口鼻部。用70%酒精消毒腹部,剪去腹部毛发,70%酒精再次消毒后取腹正中约1.5 cm切口。按顺时针方向,依次缓慢探查肠道、肝、脾、肾等腹膜腔脏器,随后将约3 cm的部分肠道轻轻外露并用拇指和食指轻轻摩擦约30 s,然后将其放回原腹膜腔,保证肠道的方向不发生转变,总探查时间约10 min。探查结束后用无菌丝线缝合肌肉筋膜及皮肤,术后伤口涂抹硫链丝霉素预防感染。皮下注射温生理盐水30 ml/kg,补充术中液体丢失;术后将小鼠放入通有100% O2的笼中,保温处理直至小鼠意识完全恢复。手术+TAT组小鼠手术操作同手术组,并在行为学训练30 min前给予腹腔注射p75NTR抑制剂TAT(3 mg/kg)。对照组小鼠除持续吸入相同时间100% O2外不进行任何处理。
1.3 旷场实验 术后第5天行旷场试验测试,旷场实验是用来评估动物的探索行为和焦虑行为。将实验小鼠置于40 cm×40 cm×40 cm的敞箱中心,自由探索5 min。使用自动监视系统(XR-XC404;上海欣软信息技术有限公司,上海)记录并分析中央格停留时间和活动总距离。在每次测试结束时,用75%的酒精进行矿场清洁,以消除气味干扰,充分晾干后继续实验。
1.4 条件性和场景性恐惧实验 本实验分为训练和测试阶段。术后第6天行条件性和场景性恐惧实验训练,将小鼠置于实验箱(32 cm×32 cm×45 cm)适应3 min后,给予30 s单频声音刺激(1 kHZ,80 dB,CS),然后给予2 s足底电击(1 mA,US)。24 h后将小鼠再次放入同一实验箱中,在不给予任何刺激情况下进行场景测试以评估僵直行为,记录小鼠5 min内的僵直(除呼吸运动外无其他任何行为活动的不动状态)时间。场景性恐惧实验结束2 h后,改变环境(实验箱底部放入分隔板,四壁粘贴不同形状、颜色塑料板等),在新场景中测试线索恐惧记忆,行条件性恐惧测试。给予小鼠连续3 min和训练时相同的声音刺激(180 s,70 dB,3000 Hz),同时记录3 min内小鼠的僵直时间。使用自动监视系统(XR-XC404;上海欣软信息技术有限公司,上海)记录并分析。通过监测小鼠僵直行为时间来评估认知功能障碍,在每次测试结束时,用75%的酒精进行矿场清洁,以消除气味干扰,充分晾干后继续实验。
1.5 Western blot检测 行为学结束后2 h,每组随机选择4只小鼠断颈处死,置于冰上取双侧新鲜海马组织。将海马标本置于添加蛋白酶抑制剂的低温裂解缓冲液中进行裂解,研磨组织,4 ℃离心(12000 r/min,10 min)取上清液。提取上清液后,使用Braford法定量蛋白浓度, 95 ℃煮5 min,使蛋白变性。电泳转膜,室温下5%脱脂奶粉封闭液中封闭1 h。加入一抗4 ℃过夜,次日TBST漂洗10 min×3次;二抗室温孵育2 h并漂洗3次,底物显色反应、曝光显影。采用Image J软件检测海马p75NTR、脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、原肌球蛋白受体B(tropomyosin receptor kinase B,TrkB)、环磷酸腺苷效应元件结合蛋白(cAMP-response element binding protein,CREB)、突触后致密蛋白-95(postsynaptic density protein-95,PSD-95)含量。一抗二抗货号下:p75NTR(55014-1-AP)、BDNF(ab108319)、PSD95(ab238135)、TrkB(ab187041)、pCREB(MABN1194)、GAPDH(60004-1-Ig)及二抗 (A0208、A0216)。
1.6 免疫荧光 采用免疫荧光技术比较CA1、CA3及DG区caspase-3阳性细胞数的变化。小鼠腹腔注射苯巴比妥钠(60 mg/kg)麻醉,经心灌注生理盐水,然后用4%多聚甲醛溶液灌注后取脑。4 ℃温度下30%蔗糖溶液中脱水过夜,OCT包埋后使用低温保持器将其切割成30 μm厚的切片。切片在室温下用5%小牛血清白蛋白封闭1 h,擦干后加一抗(caspase-3,AB3623,Millipore,1∶500),4 ℃过夜。用PBS洗涤3次后,加带荧光标记的二抗。二抗洗净后,使用含DAPI的抗荧光萃灭封片剂进行封片,然后在荧光显微镜下观察并采集图像。用Image J测量各切片的免疫荧光均值。
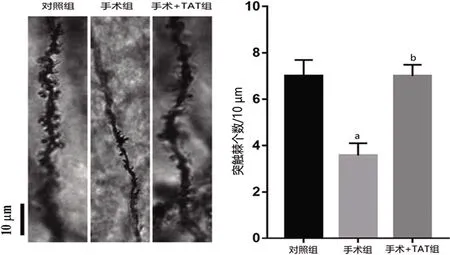
1.7 高尔基染色 采用FD快速高尔基染色试剂盒进行高尔基染色。行为学结束后2 h,每组随机选择3只小鼠,腹腔注射戊巴比妥钠(60 mg/kg),麻醉后断头取全脑,冲净大脑表面的血渍后,将大脑浸泡在浸渍液(10 ml溶液A+10 ml溶液B等体积混合)中,24 h后更换一次新的AB液后,室温避光保存24 d;随后转移至溶液C(15 ml)中浸泡,24 h后更换一次新的溶液C,室温避光保存 7 d。使用冰冻切片机切片,厚度为100 μm。室温晾干;PBS洗涤2×4 min。将脑片置于混合液(5 ml溶液D+5 ml溶液E+10 ml 双蒸水)中浸泡10 min。miliQ 水洗涤2×4 min。脑片复染(硫堇),PBS洗涤2×4 min。先后分别使用50%、75%和 95%乙醇对脑片进行梯度脱水一次,每次4 min。随后,无水乙醇脱水4×4 min,二甲苯透明3×4 min,中性树胶封片剂封片,通风橱晾干。Olympus(物镜20×和100×)拍摄海马CA1区神经元树突棘。使用 Image J 图像分析软件、Neuro J插件分析小鼠海马 CA1区神经元树突棘数目。
2 结 果
2.1 P75NTR含量 免疫印迹结果显示,与对照组比较,手术组动物海马P75NTR表达水平显著增高(P<0.05)(见图1)。
2.2 行为学变化 旷场实验中,各组动物在总探索路程、中央格停留时间无显著差异(P>0.05)。与对照组比较,手术组动物场景僵直时间均显著降低(P<0.05),手术+TAT组场景僵直时间较手术组而言显著增加(P<0.05)。3组实验小鼠条件性恐惧实验中声音僵直时间比较均无差异(P>0.05)(见表1)。
2.3 Caspase-3阳性细胞数 免疫荧光结果显示,与对照组比较,手术组小鼠海马各区caspase-3阳性细胞数显著增加(P<0.05);与手术组比较,手术+TAT组小鼠海马各区caspase-3阳性细胞数显著降低(P<0.05)(见图2)。
2.4 海马BDNF、PSD95、TrkB、pCREB含量 与对照组比较,手术组动物海马BDNF、PSD95、TrkB及pCREB表达显著降低(P<0.05);与手术组比较,手术+TAT组动物海马BDNF、PSD95及pCREB表达显著增加(P<0.05)(见图3)。
2.5 海马CA1区神经元树突棘 与对照组比较,手术组小鼠海马CA1区突触数目显著降低(P<0.05);与手术组比较,手术+TAT组小鼠海马CA1区突触数目显著增加(P<0.05)(见图4)。
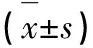
表1 旷场实验及条件性恐惧实验结果

与对照组比较aP<0.05

与对照组比较aP<0.05;与手术组比较bP<0.05,标尺=100 μm
与对照组比较aP<0.05;与手术组比较bP<0.05
3 讨 论
本实验结果表明,手术可引起老年小鼠场景性恐惧实验测试的僵直时间明显降低,提示海马依赖性恐惧记忆能力受损,表明POCD模型制备成功。此外,POCD老年鼠海马p75NTR表达水平显著上调,抑制p75NTR可使caspase-3阳性细胞数显著降低,BDNF、PSD95、TrkB及pCREB表达显著增加,同时海马神经元树突棘密度也显著增加,条件性恐惧实验测试的僵直时间显著增加。这些结果表明p75NTR在POCD中发挥关键作用。
研究发现,海马相关的学习记忆能力受突触可塑性调控,突触功能异常与神经退行性病变中的认知障碍的发生密切相关[7]。在神经退行性病变中,p75NTR是调控神经元凋亡、损伤突触可塑性的重要因素[8]。研究表明p75NTR以低亲和力与神经营养素结合,从而介导神经元存活、分化和髓鞘形成[9]。近年研究表明:p75NTR与神经营养素前体分子如脑源性生长因子前体以高亲和力结合,导致c-Jun氨基末端激酶和caspases的激活,该通路参与神经元凋亡[10]。p75NTR表达于海马神经元的细胞膜,是肿瘤坏死因子受体超家族的成员,是由黑色素瘤细胞系A785中分离出来的跨膜神经营养受体。在阿尔兹海默症模型小鼠的研究中发现,敲除p75NTR基因后,小鼠海马齿状回神经元树突棘密度显著增加,同时小鼠的学习记忆能力也显著改善[6]。在另一项研究中,使用p75NTR抑制剂,可显著改善老年小鼠在水迷宫实验中的学习记忆表现[11]。本实验结果与先前研究相似,POCD老年小鼠海马内p75NTR含量增加,海马区caspase-3阳性细胞数增多,细胞凋亡进程亢进,同时伴有学习记忆能力受损。抑制p75NTR信号通路,POCD模型老年小鼠海马区凋亡细胞减少,同时学习记忆能力改善。
记忆能力与突触可塑性均受神经营养因子及突触相关蛋白调节[12,13]。BDNF在中枢神经系统中分布广泛,促进神经元轴突和树突生长及突触的形成,调节学习记忆功能。BDNF通过激活TrkB上调细胞外信号调节激酶,促进转录因子CREB磷酸化,进而上调保护性蛋白,如BDNF、PSD95等基因的转录,促进神经元发生[14]。PSD-95作为突触后膜胞质面细胞骨架网内最主要的细胞骨架蛋白,是突触后致密物大小和突触强度的重要决定因素,在神经元发育、长时程增强及认知功能中均非常必要,在突触结构、功能和可塑性等方面也发挥重要作用[15]。而p75NTR发挥与BDNF相反的神经生物功能,p75NTR与proBDNF结合后促进神经元凋亡,抑制突触可塑性[16]。本研究中,可观察到POCD老年小鼠海马内BDNF、TrkB、pCREB表达显著下降,神经保护因子分泌减少,促使神经细胞功能障碍;同时伴有海马内PSD95的含量显著下调,CA1区神经元树突棘数量减少,出现记忆功能损伤。使用p75NTR抑制剂后,小鼠海马内BDNF、TrkB、pCREB及PSD95含量显著上调,同时改善小鼠的认知功能。这些结果表明,手术小鼠的记忆缺陷与神经营养因子和突触相关蛋白的表达失调有关,而抑制p75NTR可有效改善突触可塑性。
综上所述,P75NTR通过促进神经凋亡等机制介导神经元突触功能异常,进而导致POCD发生。通过阻断P75NTR途径,可以有效改善POCD。然而,我们未深入探讨p75NTR上调后通过何种机制影响神经因子表达,这有待后续进一步深入的研究。
