紫海胆人工育苗技术的改进
2021-03-05梁其旭张丽莉王国栋黄世玉钟幼平
梁其旭,张丽莉,王国栋,黄世玉,钟幼平
(1.集美大学水产学院,福建 厦门 361021;2.农村农业部东海海水健康养殖重点实验室,福建 厦门 361021)
0 引言
紫海胆(Heliocidariscrassispina)隶属棘皮动物门(Echinodermata)海胆纲(Echinoidea)拱齿目(Camarodonta)长海胆科(Echinometridae),是我国南方海域最重要的经济海胆[1]。海胆性腺味道鲜美,口感极佳,富含蛋白质和不饱和脂肪酸,并含有多糖、β-胡萝卜素和叶黄素等生理活性物质,食用、保健和药用价值较高,是一种高档的海产品[2-3]。近年来,随着市场的需求量增加,紫海胆的价格不断上升,而自然资源因过度捕捞而逐渐下降,因此发展紫海胆养殖受到重视。我国北方早已开展海胆养殖,中间球海胆(Strongylocentrotusintermedius)的生产性育苗和人工养殖已产业化,成为北方沿海水产养殖的新兴产业。中间球海胆繁殖盛期在9—11月[4],而紫海胆繁殖季节在5—8月。选择紫海胆作为南方的海水养殖品种,既可以弥补海胆市场的空档期,又有利于养殖产业的均衡健康发展。
从20世纪90年代末开始,我国有关科研单位相继成功进行了紫海胆人工育苗[5-9],但还存在着受精卵质量差、育苗成活率低、变态困难和苗种生产不稳定等问题[10]。本文拟改进紫海胆的人工育苗技术,旨在完善紫海胆育苗技术工艺,提高育苗存活率。
1 材料和方法
1.1 试验材料
1.1.1 紫海胆亲本
紫海胆亲本取自福建省漳州市东山海域,由潜水员采捕获得。挑选外表完整,壳径5~6 cm,体重90~110 g的个体作为备选亲本。
1.1.2 海水处理
育苗试验在集美大学海水试验场进行。育苗用水处理方法有3种:天然海水经沙滤和200目(74 μm)筛绢网袋过滤,称为常规海水;40 W紫外灯对8 m3海水消毒12 h,称为紫外线消毒海水;用0.01 μm孔径的滤膜过滤,称为超滤海水。育苗过程中海水水温为28.5~31.0 ℃,盐度为29.8~31.1,pH为7.8~8.2,溶解氧为5.9~6.4 mg/L。
1.1.3 育苗设施
以容积800 L、桶高1 m的蓝色圆形塑料桶为孵化桶。浮游幼体培育、底栖硅藻培育和亲本促熟均在3.0 m×4.0 m×1.5 m的水泥池进行。底栖硅藻培育和稚海胆采苗使用的是40 cm×33 cm的无毒透明PVC波纹板(以下统称采苗板),用塑料框架组装,每框10片。
1.1.4 饵料
1.1.4.1 微藻培养
育苗使用牟氏角毛藻(Chaetocerosmuelleri)和球等鞭金藻(Isochtysisigalbana)。培养条件为:培养液f/2,盐度(26.5±0.5),温度(25±1)℃,光周期(Light∶Dark)16L∶8D,光照强度1500 Lx。定期接种指数生长期的藻液以保持藻种的新鲜及活力,投喂以指数生长期末期的藻类细胞。
1.1.4.2 采苗板的准备
育苗前1周开始培养底栖硅藻。将采苗板经充分消毒洗刷后,平面朝上置于水泥池中,加入海水没过采苗板后再接种,接种半小时后将采苗板翻面,确保两个面都能附着藻种。培养期间微充气,3 d 换1次水,换水后施肥(加入尿素(15 g/m3)、磷酸二氢钾(2 g/m3)、柠檬酸铁(0.2 g/m3)和硅酸钠(2 g/m3)),使用遮阳网将光照控制在2000~3000 Lx。
1.2 试验方法
1.2.1 亲本培育及蓄养
亲本暂养于水泥池网箱中,连续充气,足量投喂海带和牡蛎,每日投饵1次,次日清理残饵,日投喂量为亲本体重的5%,培养水温控制在28 ℃。
促熟后的亲本若短期内不进行催产,可以将其培养温度降低至20~22 ℃,并在该温度下进行恒温培育,足量投喂海带。
1.2.2 催产与孵化
向亲本围口膜处注射浓度为0.5 mol/L的KCl(将3.7275 g KCl溶于100 mL双蒸水中)进行催产。依据海胆大小每只注射2~3 mL,注射后将亲本反口面朝下单独浸没在装有海水的烧杯中待其排放。性腺成熟个体在注射后5 min内即可排放精卵,收集1 h内产的卵子进行人工授精。利用沉性卵的特点,进行卵子质量筛选。即,在20 L的水桶中搅动卵子后再静置10~15 min,将上层海水慢慢倾倒出,反复2~3次后获得质量上乘的卵子。收集少许卵子放入100 mL烧杯中,逐滴加入精子,直至显微观察到每个卵子周围有5个左右精子,达到合适精子密度为止。再按此比例向所有卵子周围加入所需精子。人工授精时卵子密度为10~50个/mL,精卵接触后5 min即转移到孵化桶进行孵化。孵化温度为29.5 ℃,受精卵密度为10个/mL,孵化期间微充气。
1.2.3 浮游幼体培育
浮游幼体培育先后尝试了8次。
前5次使用常规海水在水泥池中育苗,称为常规海水育苗。用200目筛绢对孵化的幼体进行选优后,将上层幼体转移至培育水体中,并将密度控制在1个/mL内。自二腕幼体期开始投喂角毛藻,投饵量控制为1×104cell/mL。根据幼体发育情况逐步提高投饵量,四腕幼体期为2×104cell/mL,六腕幼体期为3×104cell/mL,八腕幼体期为4×104~5×104cell/mL。分早晚2次投喂。
第1次育苗不换水。之后4次育苗每日使用200目网箱换水1/2,并在每次投饵前镜检以确保饵料未被原生动物污染,以及投饵后2 h镜检观察幼体发育、摄食状况,再据以调节(增减)投喂的饵料密度。
第6次育苗使用紫外线消毒海水在孵化桶中进行,称为紫外线消毒海水育苗。幼体选优和投饵同前5次育苗。换水使用200目滤鼓,每日两次,每次1/2,桶底有死苗或碎屑堆积时用虹吸管进行吸污处理,并在六腕幼体期进行倒池。幼体密度在六腕幼体前控制在1个/mL,之后控制在0.5个/mL,幼体密度过大时采用200目手抄网进行分桶培育。
第7次育苗使用超滤海水在孵化桶中进行,称为小规模超滤海水育苗。幼体选优和调密度时使用经消毒的塑料桶带水移苗,每日换水1/3,并在八腕幼体期加投金藻,数量为角毛藻的1/2,总投饵量不变,分早中晚3次投喂。其余操作同第6次育苗。
第8次育苗使用超滤海水在水泥池中进行,称为大规模超滤海水育苗。幼体选优和投饵同第7次育苗。整个育苗过程不换水,幼体入池时水位60 cm,通过添加新水稀释幼体密度。入池7 d后,水位加至最高(130 cm),此时幼体密度调整采用虹吸法将底部幼体虹吸至新水泥池或直接抛弃,依据幼体密度在原池中加入适量新水。在幼体发育至Ⅳ期八腕幼体时将水位降至50 cm,排水过程中往200目网箱中放入气石充气,防止幼体黏附在网箱上。
1.2.4 采苗与稚海胆培育
当Ⅳ期八腕幼体占30%时投放采苗板。投放前采苗板用1.0×10-6的敌百虫浸泡6 h以上,用干净海水浸泡3次,每次30 min,再用海水冲洗后使用。在幼体未全部完成变态前,每日仍然需要投喂4×104~5×104cell/mL的单胞藻。幼体全部完成变态后采用流水培养,每天流水量为200%,有污物堆积时要进行局部吸污。每周按1.1.4.2方法对底栖硅藻进行施肥,维持底栖硅藻的繁殖与稚海胆生长同步。
1.2.5 中间培育
当30%稚海胆发育至3 mm时,将采苗板连苗一起移至网箱中进行培育,投喂以江蓠、紫菜和石莼等大型海藻。网箱放置在20 m3的水泥池中,每周换水一次,每次1/3。
2 结果
2.1 亲本的促熟及蓄养
种胆暂养两周后,解剖观察发现,大部分亲本性腺饱满,占比达到14%~16%。注射0.5 mol/L KCl后,亲本排放率达到90%。通过镜检可观察到:卵子外形饱满呈圆形,精子活动能力强,受精率达到95%,孵化率达到85%。
6月份将促熟后的亲本放置在温度为20~22 ℃水体中培养,于8月和11月分别进行催产,50%的亲本能成功排放卵子、精子。
2.2 浮游幼体的生长发育
在水温28~29 ℃下,从受精卵发育至稚海胆最快只需13 d(见表1)。受精后,7 h孵化为棱柱幼体(见图1a),体长平均为135 μm,具有浮游能力;12 h发育至二腕幼体(见图1b),体长平均为206 μm,前侧腕突出,此时可明显看见胃,消化系统基本完善,可以进行摄食;1 d即将发育至四腕幼体(见图1c),体长平均为300 μm,前侧腕伸长,可见口后腕突起;2 d时前侧腕和口后腕伸长,四腕幼体形态发育成型(见图1d),体长平均为476 μm;4 d时左右两侧出现后背腕,代表发育至六腕幼体(见图1e),体长平均为779 μm;5 d时步入八腕幼体阶段,体长平均为876 μm,根据形态可将八腕幼体细分为4个期,此时口前腕的出现代表发育至 Ⅰ 期八腕幼体(见图1f);6 d时出现前、后肩片,运动能力增强,此时是 Ⅱ 期八腕幼体(见图1g);7 d时,胃左侧出现前庭复合体,代表着发育至Ⅲ期八腕幼体(见图1h);10 d时,前庭复合体增大挤压了幼体原来的胃,幼体进入Ⅳ期八腕幼体(见图1i)。
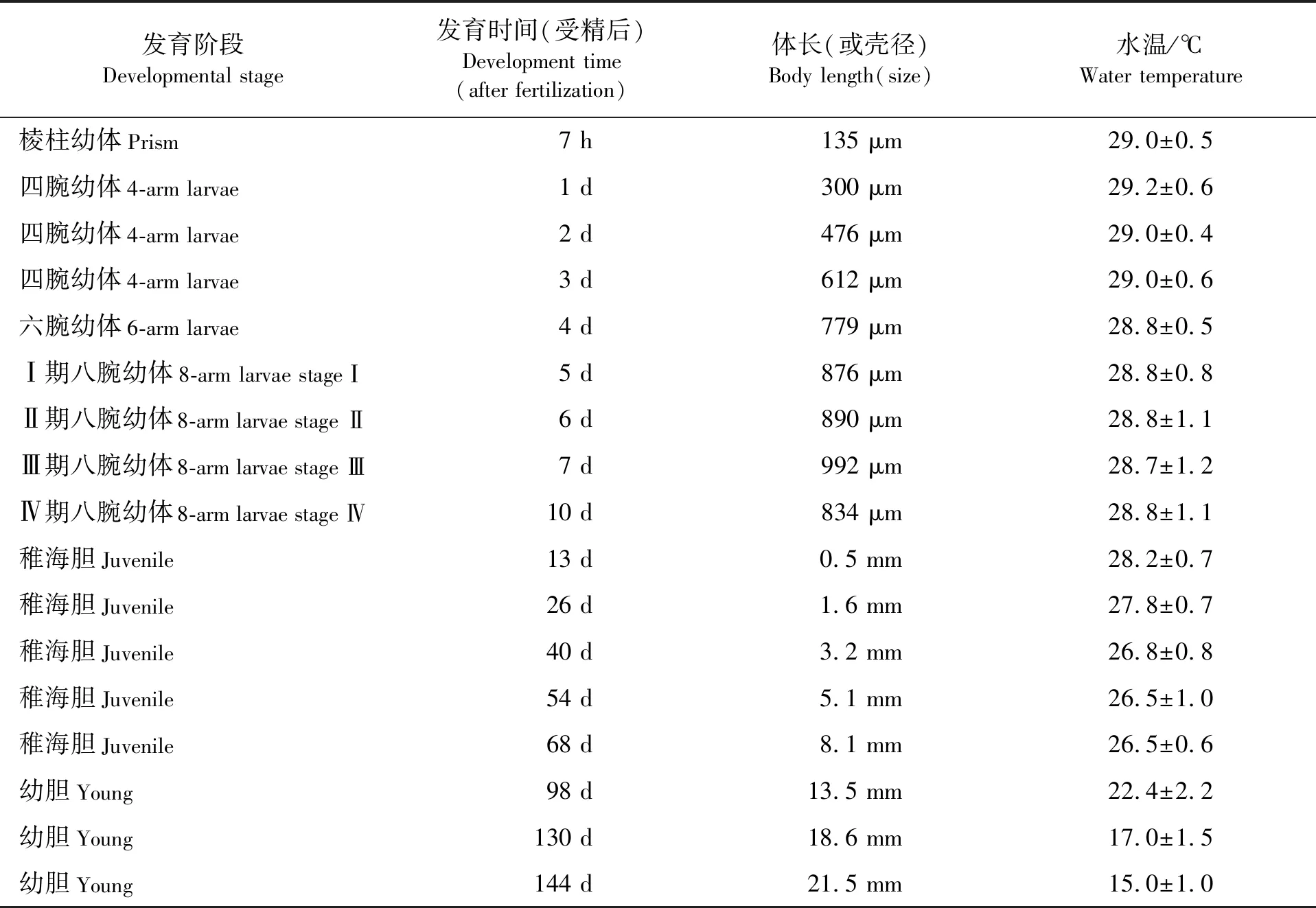
表1 紫海胆幼体发育过程Tab.1 Development of Heliocidaris crassispina
2.3 浮游幼体的变态
在12 d时,幼体管足伸出(见图2a),可附着在采苗板上进行变态(发育较好的幼体在1 d内可完成变态);八个腕的表皮组织向基部收缩(见图2b);全部腕脱落,体呈半球形(见图2c);幼棘组织长出(见图2d);伸出5个管足,幼棘组织伸长(见图2e);多处棘伸出,大部分幼棘(棘末端分叉)长大成棘,完全变态成稚海胆,大小为500 μm左右,其后2~3 d出现亚里士多德提灯,俗称口器(见图2f、g、h)。


2.4 育苗效果
2019年5月25日—2019年9月15日共进行了6次育苗试验。其中使用常规海水的都不能育成苗。前4次由于在六腕幼体期水质较差,水体中原生动物大量滋生,幼体全部烂腕沉底死亡。第5次有幼体能发育至八腕幼体期,但维持1 d后也全部死亡(见表2)。第6次催产获得1.08×106个受精卵,经10 d培育后发育至Ⅳ期八腕幼体(见图3),其中大部分Ⅳ期八腕幼体经3~4 d浮游后变态成稚海胆,稚海胆再经50~60 d培育,共获得2.5~8.48 mm的稚海胆2.51×104个,受精卵成苗率为2.30%(见表2)。
2020年6月17日—2020年8月15日又进行2次育苗试验。第7次育苗催产获得4.40×105个受精卵,由于在Ⅳ期八腕幼体时密度过大(未及时进行分苗),加上投放采苗器时间过晚,最终获得稚海胆约3 000个,受精卵成苗率为0.68%(见表2)。第8次育苗催产获得1.34×107个受精卵,经10 d 培育后发育至Ⅳ期八腕幼体(见图4),大部分Ⅳ期八腕幼体经3~4 d浮游后变态成稚海胆,受精后68 d稚海胆总数为3.32×105个,受精卵成苗率为2.48%(见表2)。
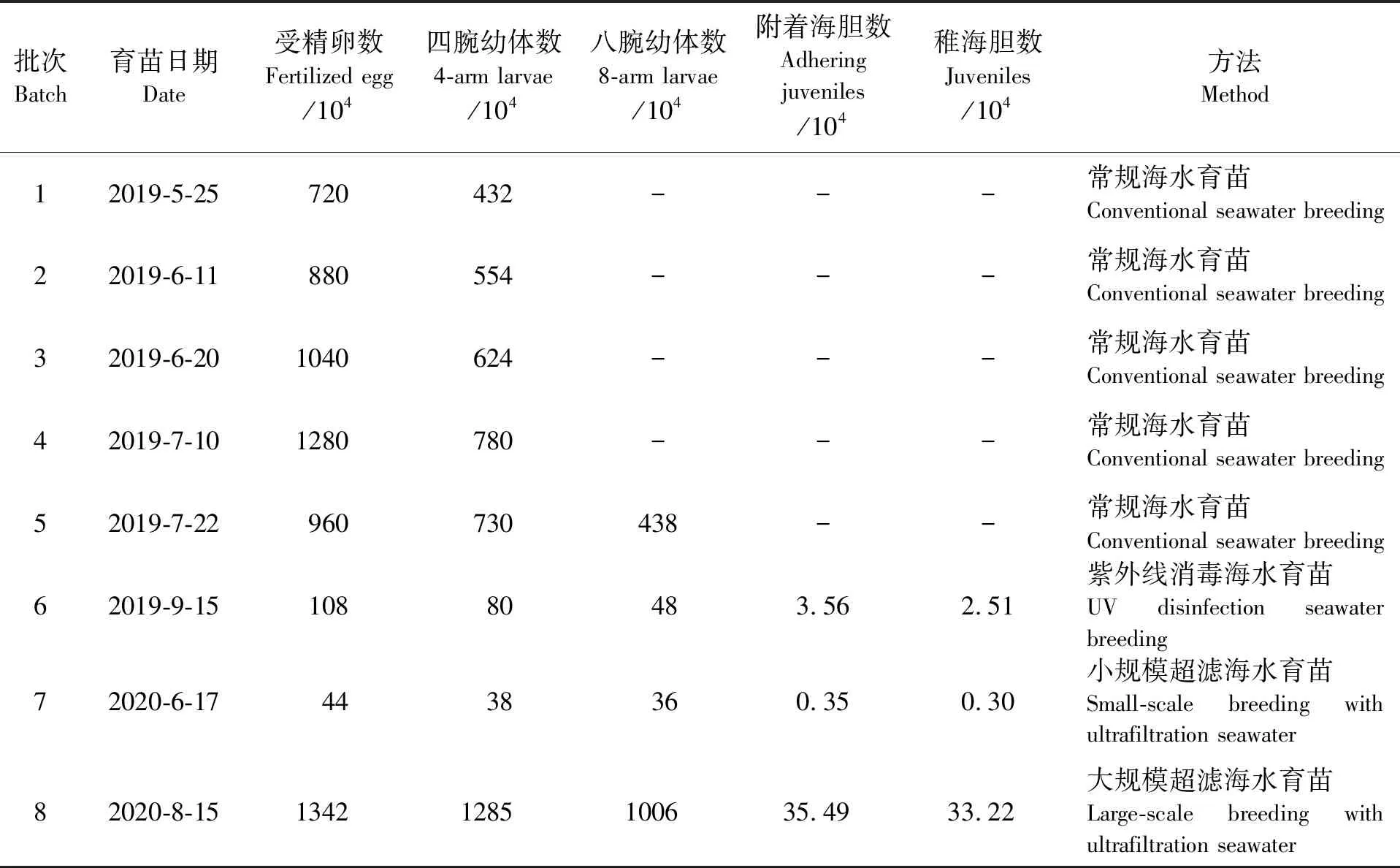
表2 紫海胆育苗结果Tab.2 Results of breeding Heliocidaris crassispina

3 讨论
目前我国可食用的海胆主要有中间球海胆、马粪海胆(Hemiceutrotuspulcherrimu)、光棘球海胆(Strongylocentrotusnudus)、紫海胆和白棘三列海胆(Tripneustesgratilla)。前三者为冷水性海胆,后两者为暖水性海胆。从20世纪80年代起,我国学者先后对这几种海胆进行了人工繁育技术的研究并取得成功[11-15]。相较之下紫海胆幼体浮游期最短,可减少苗种培育工作强度,提高生产效率,具有较好的发展潜力。
3.1 亲本促熟及蓄养
水温与饵料是影响海胆性腺发育的主要环境因素[15]。李正良[16]的研究表明紫海胆在28 ℃下生长较好,丁玉龙等[17]的研究表明投喂海带和贻贝能促进中间球海胆的性腺发育。本研究将亲本培育水温控制在28 ℃,并足量投喂以海带和牡蛎,两周后进行催产,其排放率较高(该结果与梁永成等[8]的相一致),且经促熟的亲本的配子受精率和孵化率都较好,能够解决野捕海胆中性腺发育不同步、受精率低和畸形卵多等问题,且催产后的亲本经蓄养还能继续使用[6]。
紫海胆产卵量可达400万~600万个,少量亲本即可满足育苗生产的需求[18]。促熟的亲本会在短期内自然排放,造成浪费。本研究将促熟后的亲本放置于20~22 ℃的水体中进行培养,育苗时注射KCl即可催产,能保证在8—11月获得配子,不仅提高了育苗生产的效率,还能在反季节获得配子。
3.2 幼体培育
紫海胆在高温季节繁殖,育苗水体和微藻培养极易被原生动物污染。使用常规处理海水不能成功育苗,可能是因为海水中含有少量原生动物孢子,加上饵料质控不严格会携带原生动物,导致在六腕幼体阶段原生动物大量滋生。原生动物过多时发现幼体下沉进而大量死亡,究其原因可能是:1)原生动物会分泌有害物质[19],从而影响幼体的运动并毒害幼体;2)幼体误食原生动物引起消化不良导致营养供给不足。即使第2~5次育苗中采取换水并严格控制微藻质量,效果也不佳。使用紫外线消毒海水育苗,严格控制微藻质量和密度,弃用被污染的藻液,幼体存活率有所改善,能完成整个育苗过程。使用超滤海水进行幼体培育获得较好的效果,两次幼体发育至八腕幼体的存活率都高于70%,相较于前人育苗结果[5-9],存活率得到显著提升。说明使用超滤海水能够保证育苗水体的水质,降低原生动物的污染,这是解决当前我国近海海域水质富营养化极易滋生原生动物的关键。
在前期育苗试验中发现使用筛绢网选优和大量换水极易造成幼体腕的损伤,从而导致幼体大量死亡。而在小规模超滤海水育苗中改用塑料桶带水移苗和减少换水量能保证幼体较高的存活率。在实验室进行的小水体幼体培育试验表明,在使用超滤海水且不换水、无增氧条件下,紫海胆四腕幼体可在1000 mL的烧杯中发育至稚海胆,而使用常规海水的四腕幼体在3 d后死亡。因此在大规模超滤海水育苗试验中,本研究没有进行换水。不更换海水可以减少工作量,减少饵料流失,继而降低生产成本;同时也避免了对幼体的损伤,有助于提高存活率。但是随着幼体增长,需要添加新水来调节密度。种群密度过大会抑制幼体生长发育,浮游能力也会受到影响,个体间腕容易交叉纠缠导致死亡[20]。少量多次投喂饵料有助于饵料密度保持平稳,减少有害物质的产生[21]。
3.3 幼体的附着和变态
本研究发现紫海胆幼体变态速度快慢不一,相当一部分幼体在采苗板投放1周后还浮游在水中。这部分浮游的幼虫胃面积较小,营养积累尚不充分,尚不具备变态的能力。这表明浮游期的管理尚需改进,要着重加强幼体营养供给。席世改[22]的报道表明,以金藻和角毛藻混合(1∶1)投喂的幼体的发育速度略优于只投喂角毛藻的。但本研究在八腕幼体阶段加入金藻的投喂,发现幼体发育速度差异不大。Castilla等[23]的研究表明拟球海胆(Paracentrotuslividus)幼体摄食含高碳水化合物的红胞藻(Rhodomonassp.)可提高自身脂肪含量,有助于变态顺利进行[24]。在将来紫海胆育苗中可尝试投喂含高碳水化合物的饵料。
虽然采苗时本研究将水位降至50 cm,但是最上层波纹板与水面还有15 cm的水层,上层幼体接触采苗板机会较少,这可能也影响了幼体的变态。育苗车间光线分布不均匀也可能是幼体聚集在水面上层迟迟不变态的原因之一。鲍育苗池深度适中便于遮光,适宜进行海胆采苗。
3.4 稚海胆培育期间应注意的问题
紫海胆幼体变态过程不能摄食,能量供给完全依赖浮游期的营养积累。变态后第2~3 d出现口器并开始摄食。这时口器咀嚼力弱且消化能力和运动能力较差,因此采苗板上的底栖硅藻为稚海胆的最适开口饵料。如果稚海胆不能获得充足的饵料供给会发生死亡,因此稚海胆培育过程中要注意观察稚海胆的摄食情况和波纹板上底栖硅藻的覆盖程度。通过施肥来维持底栖硅藻生长,且后期可以补充新的采苗板增加底栖硅藻的供给,并辅助投喂以螺旋藻粉或磨碎的江蓠。稚海胆壳径发育至3 mm后,口器咀嚼力增强,可以附着在大型海藻上进行摄食。此时的底栖硅藻营养难以满足稚海胆的发育,可连同板一起移入网箱中养殖,投喂以江蓠、紫菜和海带等大型藻类。
在后3次稚海胆中间培育过程中都出现个体差异较大的现象,同一批稚海胆大个体壳径可达2 cm,小个体壳径才3 mm左右。这可能是由变态快慢造成的,也可能是稚海胆营养积累差异造成的。将来可将变态速度较快和生长速度快的个体收集培养,作为下一代的亲本使用,进行速长优良品质的培育。
