九龙江口水体碱性磷酸酶活性及其对磷循环的影响
2021-03-05欧光南黄水英何碧烟
李 明,陈 露,欧光南,黄水英,何碧烟
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.集美大学港口与海岸工程学院,福建 厦门 361021;3.福建省海陆界面生态环境重点实验室,福建 厦门 361102;4.厦门大学环境与生态学院,福建 厦门 361102)
0 引言
自然水体中的磷循环深受研究者关注,因为磷是所有生物进行能量传输和生长所必需的营养元素,但是磷营养的过剩也会导致水体富营养化,破坏生态系统平衡。水体中磷的存在形态包括颗粒态总磷(particulate total phosphorus,PTP)和溶解态总磷(dissolved total phosphorus,DTP)。PTP主要来源于外源输入[1],DTP主要来源于外源输入和内源释放,可细分为DOP和DIP。长期以来,对河口、近岸水体磷循环的研究主要集中在磷的源-汇平衡[2]以及物理化学过程对不同形态的磷之间分布的影响,包括颗粒物对磷酸盐的吸附-解吸[3]、金属氢氧化物还原过程中磷酸盐的释放[4]以及沉积物-水界面磷酸盐的扩散和通量等[5-6]。相对而言,对DOP的生物有效性及其在河口、近岸系统中的循环研究仍然较少[7]。


1 材料与方法
1.1 样品采集
搭乘厦门大学科考船“海洋2号”,分别于2018年11月(秋季)和2019年2月(冬季)对九龙江口水域进行了2个航次的调查,沿着盐度梯度设置10个站位(见图1)采集水样,选择代表性站位A5、A6、A7、A8采集表层(距水面0.5 m)和底层(距水底0.5 m)水样,其余站位只采集表层水样。水样使用5 L Niskin采水器采集,装于塑料采样瓶中(瓶子经稀盐酸浸泡过夜,然后用超纯水淋洗到中性,之后于50 ℃烘干),置于4 ℃冷藏,运回实验室后马上进行后续处理。温度(T)通过 SBE-917 自容式CTD 在原位测定,盐度(S)采用便携式多参数水质分析仪 (WTW Multi 340i/SET)现场测定。用于溶解态APA测定的水样经0.45 μm醋酸纤维素滤膜过滤后冷藏,一周内完成分析。DOP和DIP测定所用的水样经0.45 μm醋酸纤维素滤膜过滤后,滤液在-20 ℃冷冻保存,一个月内完成测定。
1.2 样品测定
1.2.1 DAPA、PAPA和TAPA的测定
TAPA采用Kwon等[25]的分光光度法进行测定,过程如下:取20 mL未经过滤的海水,加入1 mL 1 mol/L Tris-HCl缓冲溶液和0.5 mL 10 mmol/L磷酸苯二钠溶液,置于37 ℃水浴反应6 h。再加入1 mL质量分数为0.3%安替吡啉溶液和1 mL质量分数为0.5%铁氰化钾溶液,继续反应15 min,定容至25 mL,离心分离,上清液在510 nm处测定从磷酸苯二钠水解释放的苯酚含量,以单位时间单位体积内苯酚的产量作为评定APA的指标,从而计算得出酶的活性。DAPA用经过0.45 μm的滤膜过滤的滤液,采用同样的方法进行测定。PAPA通过TAPA减去DAPA求得。
1.2.2 DTP和DIP的测定
1)DTP的测定 采用过硫酸钾加热消解,把有机磷转化为正磷酸盐,所生成的磷酸盐浓度采用钼酸铵分光光度法测定[26]。基本步骤如下:水样经0.45 μm滤膜过滤后,取25 mL滤液加入350 μL 50 g/L的过硫酸钾溶液,在95 ℃水浴锅中恒温消解3 h,取出水样冷却至室温,再依次加入0.5 mL 100 g/L的抗坏血酸溶液和0.5 mL钼酸铵混合液,振荡均匀,测得的是DTP。
2)DIP的测定 取25 mL滤液,未经消解直接测定,测得的是DIP。
DOP由DTP减去DIP得出。每一个样品重复3次,取平均值。
1.3 数据处理
采用SPSS 17.0软件中斯皮尔曼相关系数分析APA与各环境参数之间的相关性。使用Excel 2007中的单因素方差分析法比较秋季和冬季各组参数测定值之间的差异,采用F检验的方法判断两者的差异性程度。
2 结果
2.1 水环境参数的变化
航次调查期间九龙江口的水环境参数见表1。根据九龙江多年平均径流量数据[27],11月和2月的月平均径流量分别为176.8 m3/s和183.6 m3/s,二者相差不大,同处枯水期。2018 年11月(秋季)和2019年2月(冬季)航次调查期间,九龙江口水体的盐度变化范围分别为 0~30.2和0.1~27.0。河口上游,2个季节的盐度差别不大;河口下游,秋季盐度高于冬季,2个季节的盐度差异主要是受潮汐影响。秋季和冬季的水温变化范围分别为20.5~21.8 ℃和16.9~18.8 ℃,秋季温度明显高于冬季。秋季和冬季的Chl-a质量浓度变化范围分别为1.5~11.5 mg/m3和2.4~6.7 mg/m3,除了A5站底层Chl-a浓度秋季明显高于冬季外,其余站位2个季节差别不显著。秋季和冬季的SPM变化范围分别为21.7~636.7 mg/L和17.4~68.7 mg/L,秋季显著高于冬季,这可能是因为秋季采样期间是大潮,强烈的潮汐作用导致沉积物再悬浮,使得秋季SPM显著高于冬季。

表1 航次调查期间九龙江口水体温度、盐度、SPM、Chl-a、细菌丰度和径流量的变化范围Tab.1 Range of temperature,salinity,SPM,Chl-a,bacterial abundance and river discharges in the Jiulong River Estuary during the cruises
2.2 磷浓度的时空分布
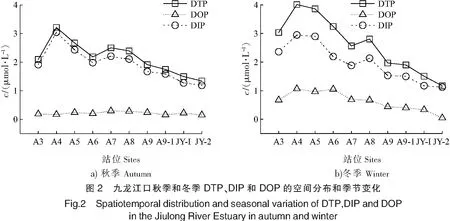
九龙江口表层水体DTP、DIP和DOP浓度变化如图2所示。由图2可见:秋季 DTP的浓度范围介于1.34~3.21 μmol/L,平均值为(2.16±0.57)μmol/L,其浓度沿河口下游方向先升高,在A4站浓度达到峰值,之后浓度逐渐下降,到河口下游的JY2站浓度降至最低值;冬季DTP的浓度范围介于1.17~4.01 μmol/L,平均值为(2.61±0.96)μmol/L,略高于秋季,但DTP浓度的分布特征与秋季基本一致。九龙江口秋季和冬季DTP的主要成分都是DIP,秋季DIP平均占DTP的(89.6±2.7)%,冬季占(77.3±7.3)%,远远高于DOP的含量(秋季为(10.4±2.6)%,冬季为(22.7±7.3)%)。DIP的浓度范围秋季在1.19~3.04 μmol/L,冬季在1.12~2.95 μmol/L,明显高于陈水土等[19]在该区域的测定值,但与颜秀利等[18]报道的数值相近,说明九龙江口DIP的浓度比30年前有显著的升高。DOP的浓度比DIP低得多,其浓度范围秋季为0.15~0.30 μmol/L,冬季为0.05~1.06 μmol/L,与30年前的测定值相比变化不明显[19]。

2.3 APA的时空分布
九龙江口表层水体TAPA的空间变化显著(见图3),整体上呈现河口上游高、下游低的变化趋势。秋季TAPA在85.5~755.4 nmol/(L·h),最高值出现在河口上游的A5站,最低值出现在河口中游的A9站,在河口下游的JY1站有所升高。冬季TAPA在7.5~639.8 nmol/(L·h),其分布模式与秋季基本相似,最高值也出现在A5站,最低值出现在河口下游的JY2站。从垂直分布(见图4)来看,秋季除了A6站底层TAPA(876.5 nmol/(L·h))明显高于表层(261.3 nmol/(L·h))外,其余站位相差不明显;冬季4个站位表层TAPA均略高于底层,但总体上差异不显著(P>0.05)。从季节变化看,秋季TAPA平均值为(339±242)nmol/(L·h),冬季平均值为(259±194)nmol/(L·h),秋季整体高于冬季,但差异不显著(P>0.05)。


为了解AP的来源,分别测定了颗粒态(>0.45 μm)和溶解态(<0.45 μm)APA,结果见图5。由图5可见,秋季九龙江口水体中AP主要以颗粒态存在,PAPA对TAPA的贡献率最小值为70.1%,最大值达到97.3%,平均为(84.9±9.5)%。冬季情况比较特殊,在河口的上游以PAPA为主,而在河口中下游则以DAPA为主,冬季整个河口PAPA的平均贡献率为(54.1±26.4)%,DAPA的平均贡献率为(45.9±26.4)%。秋季PAPA对TAPA的贡献明显高于冬季,可能主要是因为秋季九龙江口悬浮颗粒物SPM的浓度显著高于冬季,且细菌丰度也显著高于冬季(见表1),使得附着在颗粒物上的细菌对TAPA的贡献明显高于冬季。
2.4 APA与环境因子的相关性
DAPA、PAPA与各环境因子间的斯皮尔曼相关性结果见表2。由表2可见,DAPA与DOP、DIP呈极显著正相关,与盐度呈极显著负相关,与Chl-a正相关但不显著,与SPM不相关;PAPA与DIP、SPM呈显著正相关,与盐度呈极显著负相关,与Chl-a正相关但不显著,与DOP不相关。综上分析,DAPA和PAPA都与DIP呈极显著正相关,可见DIP浓度升高并没有抑制AP的合成。相反,由于DIP浓度升高刺激藻类和细菌的生长繁殖,反而导致合成更多的AP。由此可见,环境因子对DAPA、PAPA的影响不尽相同。如前所述,由细菌和藻类分泌的碱性磷酸酶有2种形式:一种是外向酶,它是一种与细胞膜结合的酶,即与酶的生产者保持紧密联系[9],常以颗粒态存在;另一种是释放到周围环境中胞外酶,它主要以溶解态存在。可见,PAPA主要反映的是外向酶的活性(虽然颗粒物的表面也可能吸附溶解态的酶),因此与颗粒物SPM关系紧密。

表2 九龙江口PAPA、DAPA与环境参数的斯皮尔曼相关性Tab.2 Spearman correlation coefficient of PAPA and DAPA with environmental parameters in the Jiulong River Estuary
3 讨论
3.1 九龙江口AP的来源

Bogé等[30]在研究水体中的磷对AP分泌的调控作用中指出,仅凭DIP的浓度高低来判断抑制或促进AP分泌过于笼统,还应考虑水体中DOP浓度的影响。越来越多的研究表明[31-33],APA不仅与磷营养水平有关,还与有机碳、氮的供给有关,并受氮磷比值(N/P)的控制,在高N/P比值的水体中往往观测到相应高的APA。此外,一系列的培养实验也证明,添加无机氮和有机氮能显著影响细菌APA活性和DOP的降解[32]。九龙江口上游溶解无机氮浓度很高,枯水期其浓度超过300 μmol/L,且DIN/DIP比值高达100~150[18],水体处于富营养水平,磷在富营养化水体中处于快速产生和快速消耗的循环状态,需要大量的AP促进磷循环,这可能是导致九龙江口上游DAPA和PAPA异常高的原因。另外,九龙江口上游水体有机物含量高[34],为细菌提供了丰富的碳源,从而促进了细菌分泌更多的AP来降解利用有机物。可见,在富营养水平的河口,底物DOP对AP的诱导作用比产物DIP的抑制作用可能更为重要。
由九龙江口APA与环境因子的相关性分析(见表2)还可以看出,PAPA与Chl-a呈不显著正相关(r=0.284,P>0.05),与SPM呈极显著正相关(r=0.507,P<0.01)。说明,与浮游植物相比,附着在颗粒物上的微生物可能是PAPA更重要的贡献者,这一推论可以从九龙江口相对较高的细菌丰度得到印证[28]。
3.2 AP与磷循环的关系
以前的研究普遍认为,河口磷的迁移转化主要受控于悬浮/沉降颗粒物的吸附-解析过程,因此相关的研究也主要集中在矿物颗粒对DIP的吸附-解吸作用以及金属氢氧化物还原过程中DIP的释放[2-3,35],而微生物矿化有机磷对河口DIP再生的潜在贡献长期以来都没有受到足够的重视[9]。从DIP的分布(见图2)可以看出,在九龙江口上游的A4~A5站存在DIP的明显添加,颜秀利等[18]也曾报道九龙江口活性磷(即本文中的DIP)在中低盐度区存在明显的添加,并利用物质收支模型估算出九龙江口DIP的添加量约占河流输入总量的30%。河口DIP的添加可能受多种过程调控。首先,从河流到河口,随着水体离子强度不断增大,吸附在淡水颗粒物上的无机磷在淡水和海水的混合边界不断被解吸出来。文献报道[3,36],在吉伦德河口和塞纳河口,这一过程主要发生在盐度为5~15区域。然而,在九龙江口,SPM与DIP并没有相关性(见表2),这表明颗粒磷的解吸可能不是九龙江口DIP添加的主要过程。其次,由潮汐和河流径流驱动的沉积物的再悬浮也可能刺激颗粒态磷的吸附-解吸过程,并可能诱导附着在悬浮沉积物上的细菌增强AP的合成[37]。此外,九龙江口DIP与DAPA呈现极显著(P<0.01)的正相关关系(见表2),说明微生物通过AP催化DOP矿化,可能对九龙江口DIP的添加有重要贡献。
4 结论
1)九龙江口TAPA的空间分布特征表现为河口上游淡水端高,河口下游海水端低,表层水体略高于底层水体。TAPA季节变化规律表现为秋季高于冬季。
2)秋季AP主要以颗粒态存在,PAPA对TAPA的贡献占绝对优势,冬季溶解态AP和颗粒态AP共存,PAPA和DAPA对TAPA的贡献率相当。
3)溶解态AP主要受DOP诱导而产生,并受河-海水混合影响,颗粒态AP除了来自浮游植物外,附着在颗粒物上的细菌可能是更重要的来源。
4)在DIP浓度显著高于通常认为抑制AP合成阈值的九龙江口,AP的活性仍可以达到相当高的水平。可以推测,在富营养水平的河口,底物DOP对AP的诱导作用比产物DIP的抑制作用可能更为重要,预示着有机磷的微生物矿化作用可能是河口DIP的重要来源。
致谢
感谢国家自然科学基金(41576085)、福建省自然科学基金(2019J01699)对本研究的支持。感谢福建省海陆界面生态环境重点实验室(厦门大学)组织的九龙江河口-厦门湾共享航次提供的样品采集的平台。感谢厦门大学海洋监测与信息服务中心提供论文分析所需的温度、盐度、叶绿素a、总悬浮颗粒物数据的整编和共享服务。
