晚期原发性肝癌综合治疗后黄疸的诊治及鉴别1例报告
2021-03-03谢思,杨明,黄缘,魏来
谢 思, 杨 明, 黄 缘, 魏 来
1 清华大学附属北京清华长庚医院 肝胆胰中心 肝胆内科, 清华大学临床医学院, 北京 102218;
2 清华大学附属北京清华长庚医院 肝胆胰中心, 清华大学临床医学院, 北京 102218
原发性肝癌是目前我国第4位常见恶性肿瘤及第2位肿瘤致死病因[1],因其起病隐匿、缺乏特异性症状,大部分患者确诊时已处于疾病中晚期,无手术切除或肝移植机会,需接受介入治疗、放射治疗、分子靶向药物治疗及免疫治疗等相结合的综合疗法。胆红素升高是中晚期肝癌治疗过程中的常见现象,可受疾病状态及治疗方法等多种因素影响,临床中难以鉴别,诊断失误常导致病情延误。现将1例晚期原发性肝癌综合治疗后黄疸的临床诊治及鉴别报道如下。
1 病例资料
患者男性,59岁,因“发现肝占位3个月,眼黄、尿黄半个月”于2019年8月20日入住清华大学附属北京清华长庚医院。患者3个月前行上腹部增强MRI及PET-CT示“肝脏多发占位,门静脉主干及左支、肝左静脉瘤栓;上下腔静脉旁、胸骨后、肝门部、腹盆腔淋巴结转移;左侧锁骨、右侧髂骨转移”,查肿瘤标志物:AFP 518 ng/ml、CA19-9>1000 U/ml,诊断“原发性肝癌”,于2019年5月24日起予仑伐替尼12 mg,1次/d,口服;2019年6月5日起针对肝脏局部肿瘤(6MV-X照射,IMRT,DT 30Gy/10F)及左侧锁骨转移灶(6MV-X照射,3CDRT,DT 30Gy/10F)行放射治疗;2019年6月21日起予信迪利单抗200 mg,1次/3周,静脉输注。患者于入院前半个月出现眼黄、尿黄及全身皮肤黄染,大便颜色变浅呈陶土样,入院前4 d(2019年8月16日)查肝功能:ALT 58 U/L、AST 90 U/L、ALP 292 U/L、GGT 187 U/L、TBil 110.4 μmol/L、DBil 73.02 μmol/L、Alb 31.9 g/L。入院查体:全身皮肤及巩膜明显黄染;腹膨隆,腹壁柔软,无压痛、反跳痛及肌紧张,未触及包块,肝脏肋下及剑突下未及,Murphy’s征阴性,肝区无叩击痛,移动性浊音阳性;双下肢对称性可凹性水肿。实验室检查:血常规正常;肝功能及肿瘤标志物结果详见表1;抗-HBe、抗-HBc阳性,HBsAg、抗-HBs、HBeAg及HBV DNA阴性,HCV及HAV、HEV抗体阴性。上腹部增强MRI示(图1):肝门区左右肝管及肝总管局限性狭窄,壁增厚,肝内胆管中度扩张;磁共振胰胆管成像示(图2):胆道梗阻,梗阻点位于肝门,考虑肝门部外压性改变。初步诊断:原发性肝癌(BCLC分期 C期),梗阻性黄疸,药物性肝损伤、放射性肝损伤可能。
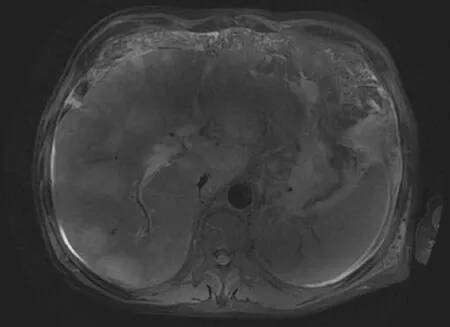
图1 上腹部增强MRI(T2WI)

图2 磁共振胰胆管成像

表1 肝功能及肿瘤标志物变化
患者入院后停用仑伐替尼及信迪利单抗,予甲强龙抗炎、保肝降酶、利胆退黄等治疗,效果不佳,于2019年8月22日行超声引导下肝穿刺活检术,2019年8月27日行数字减影血管造影术下经皮肝穿刺胆道引流(percutaneous transhepatic biliary drainage, PTBD)(图3),术后复查胆红素下降,后再次升高,于2019月9月2日调整胆道引流管位置后胆红素呈下降趋势。患者因个人原因放弃继续治疗而出院。出院前肝穿刺活检病理结果示(图4):肝小叶结构尚可,肝细胞弥漫性水样变,大小泡混合性脂肪变性,少许肝细胞淤胆伴假腺样结构形成,肝细胞点灶坏死;肝窦内混合性炎细胞浸润,泡沫样组织细胞增生;汇管区扩大,纤维组织增生,纤维间隔形成,大量中性粒细胞、少许淋巴细胞、组织细胞浸润,小叶间胆管形态不规则,胆管上皮形态不一,部分空泡变,大量细胆管增生,轻度界面炎;考虑大胆管梗阻,药物性肝损伤待除外。

图3 经皮经肝胆管造影

图4 肝穿刺活检病理结果(HE染色,×100)
2 讨论
黄疸是晚期原发性肝癌的常见临床表现,通常由肿瘤广泛浸润肝实质、肝门侵犯和/或肝硬化所致的肝衰竭等引起。其中,1%~12%的原发性肝癌患者表现出明确的梗阻性黄疸,可能由肿瘤直接侵犯胆道、胆道癌栓、胆道出血或肿瘤/淋巴结转移压迫胆道所致[2]。本例患者有梗阻性黄疸典型症状,TBil明显升高,以DBil为主,影像检查可见肝门区胆管局部狭窄伴肝内胆管扩张,梗阻性黄疸诊断不难明确。肿瘤及胆道结石为梗阻性黄疸的常见原因,本例患者复查AFP及CA19-9较前升高,影像检查未发现胆道结石,考虑肿瘤进展所致梗阻性黄疸可能性大。内镜下逆行胆道引流术及PTBD是原发性肝癌梗阻性黄疸的两种主要治疗方法,通畅引流可为抗肿瘤治疗提供机会并延长生存期[2]。本例患者行PTBD后胆红素下降。值得注意的是,该患者肝穿刺活检病理可见汇管区大量中性粒细胞浸润,需考虑胆道感染可能,但因患者无发热、腹痛及炎症指标升高等表现,未予抗感染治疗。Yu等[3]对694例恶性梗阻性黄疸患者胆汁培养及药敏试验结果进行了回顾性研究,发现42.9%患者胆汁培养阳性,最常见的致病菌为粪肠球菌(11.9%)、大肠杆菌(9.9%)、肺炎克雷伯菌(8.2%)、表皮葡萄球菌(5.5%)、肠球菌(5.3%)及阴沟肠杆菌(4.7%),而仅22.3%的患者有胆道感染临床表现,提示无感染症状的恶性梗阻性黄疸患者也应积极完善胆汁培养,必要时予抗感染治疗。
药物性肝损伤在临床上常表现为胆汁淤积和胆红素升高。仑伐替尼是不可切除晚期肝细胞癌的一线治疗方法,其最常见的肝脏毒性不良反应为高胆红素血症(14.9%,≥3级6.5%)及AST升高(13.7%,≥3级5.0%),从用药至出现肝脏毒性不良反应的中位时间为6.4周[4],若出现3~4级肝脏毒性不良反应则需暂停用药。本例患者于仑伐替尼用药后出现胆红素显著升高,RUCAM评分3分,存在仑伐替尼肝脏毒性可能。免疫检查点抑制剂(immune checkpoint inhibitors, ICI)相关肝脏毒性(免疫相关性肝炎)主要表现为转氨酶升高,伴或不伴胆红素升高,中位发生时间为首次用药后5~18周,对糖皮质激素治疗应答良好[5-6]。尽管有学者认为ICI相关肝脏毒性亦可用RUCAM评分评估,但由于其机制特殊,RUCAM评分对其诊断价值可能尚需更多研究验证。本例患者在信迪利单抗用药后8周出现肝损伤,存在ICI相关肝脏毒性可能。该患者入院时已存在严重肝损伤,即使尚不能明确是否为仑伐替尼或信迪利单抗所致,也应暂停上述药物治疗。章琼燕等[7]对ICI治疗后肝功能异常的组织病理学分析显示,ICI相关肝脏毒性病理学主要表现为均匀分布于肝小叶内及汇管区的炎性病变,以淋巴细胞为主,伴有不同数量的组织细胞、中性粒细胞、浆细胞及嗜酸性粒细胞;ICI与酪氨酸激酶抑制剂(如仑伐替尼等)联合使用发生严重肝损伤的概率增加,可进一步出现肝细胞桥接坏死、大片坏死,伴显著界面性肝炎。而本例患者肝穿刺活检病理表现为肝窦内混合性炎细胞浸润,汇管区大量中性粒细胞、少许淋巴细胞、组织细胞浸润,轻度界面炎,不支持肝损伤为仑伐替尼或信迪利单抗所致。且本例患者停用仑伐替尼及信迪利单抗后,应用糖皮质激素治疗仍不能阻止疾病进展,表现为胆红素进行性升高和难以纠正的低蛋白血症,提示肝损伤可能为胆道梗阻及肿瘤进展所致。此外,该患者停用抗肿瘤药物时肿瘤标志物已较前升高,病情进展,不除外耐药可能,待梗阻性黄疸缓解、肝功能恢复后,需重新评估抗肿瘤治疗。
对肝内肿瘤进行放射治疗也可出现不同程度的放射性肝损伤(radiation-induced liver damage, RILD),预后较差。RILD通常发生于放射治疗后4~12周,典型RILD表现为非癌性腹水、肝肿大及ALP升高;非典型RILD表现为黄疸及转氨酶升高[8]。RILD的典型病理表现为受照区肝小静脉闭塞症[9],可分为4个阶段:急性放射性肝炎期,多出现在照射后1个月内,主要表现为肝内小静脉及肝窦扩张、充血及出血;肝纤维化前期,多出现在照射后1~3个月内,主要表现为汇管区、肝窦及中央小静脉周边胶原纤维增多,肝细胞点状坏死;肝纤维化期,常见于照射后半年,肝内大量纤维组织增生,肝细胞呈片状坏死,肝窦壁及小血管壁进一步增厚;肝硬化期,多发生于照射后9~12个月[10]。本例患者于放射治疗后10周出现肝损伤,存在RILD可能,但患者肝穿刺活检病理无肝内小静脉及肝窦扩张、充血及出血,无肝窦及中央小静脉周边胶原纤维增多等表现,暂可除外RILD。
综上所述,黄疸在中晚期肝癌中非常常见,且与预后不良相关。对其较易鉴别的原因,如梗阻性黄疸等,应及时完善相关检查明确并处理;对其不易鉴别的原因,如药物性肝损伤、RILD等,可进一步通过对治疗的反应加以明确,必要时需完善肝穿刺活检病理协助鉴别。明确黄疸原因后应尽快予以对症治疗,肝功能恢复后进一步评估后续抗肿瘤治疗方案,避免延误病情。
作者贡献声明:谢思采集数据,分析及解释数据,起草文章;杨明对文章的知识性内容作批阅性审阅,材料支持和指导;黄缘负责指导,支持性贡献;魏来对文章的知识性内容作批阅性审阅、指导和支持性贡献。
