安罗替尼在肝癌中耐药的差异mRNA筛选
2021-03-03谷俊谋王立博曾德俊陆勤伟梁若鹏王维杰朱荣涛孙玉岭
谷俊谋, 王立博, 曾德俊, 陆勤伟, 董 凯, 梁若鹏, 王维杰, 朱荣涛, 孙玉岭,2,3
1 郑州大学第一附属医院 肝胆胰外科, 郑州 450052; 2 郑州大学 肝胆胰疾病研究所, 郑州 450052;
3 郑州市肝胆胰疾病基础与临床研究重点实验室, 郑州 450052
原发性肝癌是一种常见的恶性肿瘤,具有起病隐匿、进展迅速、恶性程度高、治疗难度大等特点[1]。索拉非尼作为晚期肝癌的一线治疗药物,能有效延长大多数患者的生存期[2]。但是,对于一些耐药的患者,索拉非尼很难取得良好的成效。安罗替尼是一种新型小分子多靶点酪氨酸激酶抑制剂,能有效抑制血管内皮细胞生长因子受体(vascular endothelial growth factor receptor,VEGFR)、Met等激酶,可以抑制肿瘤及其血管的生成和生长[3]。目前包括非小细胞肺癌、结直肠癌等多种癌症的临床试验正在开展[4]。通过与其他酪氨酸激酶进行比较发现,安罗替尼对VEGFR2的抑制作用显示出极高的选择性[5]。但是安罗替尼在肝癌中的研究目前较少,尤其是关于其耐药方面的研究更是少有报道。本研究主要通过培养建立对安罗替尼耐药的肝癌细胞并通过ceRNA芯片进行比较,最后筛选出可能存在的与耐药相关的mRNA。为今后的临床和科研工作提供基础。
1 材料与方法
1.1 材料 人肝癌细胞Huh7购自美国模式菌种收集中心;安罗替尼试剂购自正大天晴药业集团;CCK8试剂盒购自日本同仁公司;DMEM培养基、胎牛血清(FBS)、0.25%胰蛋白酶均购自GIBCO公司;引物由擎科生物公司合成;培养细胞总RNA提取试剂盒购自百序生物科技有限公司;细胞裂解液购自碧云天生物科技有限公司;SBC Human (4*180K) ceRNA芯片购自上海伯豪生物有限公司;PrimeScriptTMRT Reagent Kit购自日本TAKARA公司;2X PowerUp SYBR Green Master Mix购自武汉塞维尔科技有限公司。
1.2 方法
1.2.1 培养细胞 以45 ml DMEM培养液中添加5 ml FBS和溶于50 μl DMSO中不同浓度的安罗替尼为培养液;细胞置于37 ℃、5%CO2、85%~90%湿度的恒温培养箱中。每天至少观察细胞1次,当细胞生长状态良好、密度达到90%时进行传代。
1.2.2 Huh7耐药细胞的建立 采用大剂量冲击联合低剂量诱导的方法筛选耐药细胞,取处于对数期的人肝癌细胞Huh7置于终浓度为0.5 μmol/L安罗替尼的DMEM完全培养液中进行培养。密切观察1 d,若细胞状态不好,及时更换成不含安罗替尼的DMEM完全培养液来调整细胞的状态。若细胞状态好则常规更换培养液,正常消化传代,当细胞完全适应后,将细胞置于2 μmol/L 安罗替尼的DMEM完全培养液中培养24 h来进行大剂量冲击。逐步提升药物浓度,直至Huh7细胞可以在药物浓度为6 μmol/L的DMEM完全培养液中可以正常增殖传代,并且在不添加药物培养2周后,仍可以在药物浓度为6 μmol/L的DMEM完全培养液中正常增殖传代,经过6个月的培养,获得对安罗替尼耐药的细胞Huh7/R,并将其维持在含2 μmol/L的安罗替尼培养液中。
1.2.3 CCK8细胞增殖实验 取消化好的处于对数期的肝癌细胞Huh7和Huh7/R,调整细胞浓度为3×104~5×104/ ml,向96孔板内每孔加入100 μl细胞悬液。设置空白组、对照组与实验组,每组设置5个复孔;边缘用PBS填充;于空白组与对照组中加入100 μl不含安罗替尼的培养液,实验组分别加入100 μl不同浓度安罗替尼的培养液;1~2 h后,取出96孔板置于全自动酶标仪中,测定450 nm光吸收值;测出的对照组吸收值以接近1最为理想;根据每孔所得的光密度值来计算增殖抑制率;增殖抑制率=(对照组OD-实验组OD)/(对照组OD-空白组OD)×100%。
1.2.4 ceRNA芯片筛选差异基因 采用试剂盒的操作步骤对正常肝癌细胞Huh7和耐药肝癌细胞Huh7/R进行RNA的初步提取;对提取的RNA进行纯化;纯化后的RNA进行反转录和荧光标记;对杂交后的芯片进行洗涤和扫描;对差异的mRNA进行Go和KEGG pathway富集分析。
1.2.5 实时荧光定量(real-time PCR)反应 用RNA提取试剂盒对处于对数期的正常肝癌细胞株Huh7和耐药肝癌细胞株Huh7/R进行RNA的提取。按照PrimeScriptTMRT Reagent Kit说明书将RNA进行反转录成cDNA。以GADPH作为内参,按照2X PowerUp SYBR Green Master Mix说明书进行real-time PCR反应,条件为:95 ℃预变性30 s,而后进行40个循环(95 ℃ 15 s,60 ℃ 10 s,72 ℃ 30 s)。引物序列5′-3′:BIRC2(上游引物-CATAGTAGCTTGTTCAGTGGT,下游引物-CTCTAGAATTAAGAGGGTTTGGAG),ABCC2(上游引物-GGACACTCTTACAGGGTGAC,下游引物-GGATCAGGATCTGGAATCCG),MAPK8(上游引物-GATGTTTACATAGTCATGGAGCTC,下游引物-TACTGGGCTTTAAGTCCCG),BIRC7(上游引物-CTCCTTCTATGACTGGCCG,下游引物-CCTCACCTTGTCCTGATGG),GADPH(上游引物-TCAAGATCATCAGCAATGCC,下游引物-CGATACCAAAGTTGTCATGGA)。
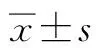
2 结果
2.1 肝癌细胞的抑制率 正常肝癌细胞24 h的IC50为(2.99±0.93)μmol/L,耐药肝癌细胞的24 h IC50为(27.85±1.42)μmol/L。通过公式:耐药指数=耐药细胞IC50/亲本细胞的IC50,计算出耐药肝癌细胞相对于正常肝癌细胞对安罗替尼的耐药指数为9.31(图1)。
2.2 差异mRNA的筛选 芯片的数据来自R/bioconductor的数据包clusterProfiler,使用Fisher精确检验,筛选标准为term/GO上差异的基因数目不小于2,P<0.05。研究发现共有2790个差异mRNA,其中上调mRNA有611个,下调mRNA有2179个(图2)。
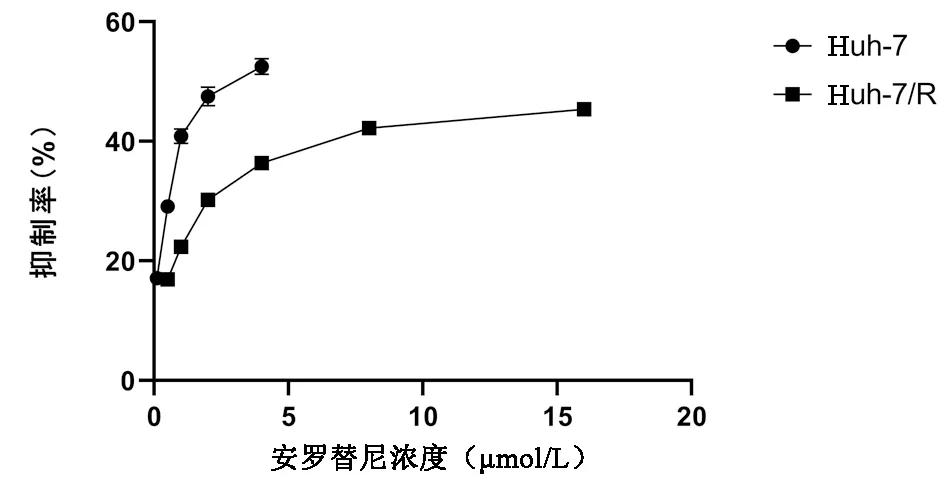
图1 CCK8法检测安罗替尼对Huh7和Huh7/R的抑制作用

图2 差异mRNA热图见二维码
2.3 Go和KEGG pathway分析 通过分析term/GO发现差异基因分布最多的3个基因集为cell、cell part和cellular progress(图3)。KEGG中基因改变最多的通路为信号传导通路(图4)。

图3 正常肝癌细胞与耐药肝癌细胞差异基因的GO富集分析图

图4 正常肝癌细胞与耐药肝癌细胞差异基因的KEGG pathway分析图
2.4 前10个差异mRNA 通过缩减P值筛选出10个差异最大的基因分别为BIRC2、BIRC7、ABCC2、MAPK8、MAP2K6、SERPING1、MX1、RPP30、UTP14A、KLHL13。通过文献检索,发现有4个基因可能与耐药有关,分别是:BIRC2、BIRC7、ABCC2、MAPK8。其中BIRC2、ABCC2、MAPK8表达水平下降(P值分别为0.0014、0.0012、0.011 8),BIRC7的表达水平增加(P<0.001)。
2.5 real-time PCR验证差异表达mRNA 利用传统的real-time PCR对这BIRC2、BIRC7、ABCC2、MAPK8 4个mRNA进行了再次验证,并通过GraphPad Prism 8软件进行处理,结论与芯片一致(t值分别为10.74、32.65、18.34、2.80,P值分别为0.000 4、0.000 1、0.000 1、0.044 8)(图5)。

注:a,BIRC2;b,ABCC2;c,MAPK8;d.BIRC7。
2.6 生存分析 对4个差异最大的mRNA进行生存分析,其中BIRC7的高表达与MAPK8的低表达对应显著减少的累积生存率(P值分别为0.022 0、0.005 6)(图6)。

注:a,BIRC2; b,ABCC2; c,MAPK8; d,BIRC7。
3 讨论
肝癌治疗方法主要有肝切除术、肝移植、局部射频消融术、经肝动脉化疗栓塞术(TACE)、放疗和系统治疗等[6]。但是由于肝癌起病隐匿,很多患者发现时已处于肝癌晚期。安罗替尼作为一种新型的小分子酪氨酸激酶抑制剂,目前有研究[7-9]表明原发性肝癌患者在TACE术后行安罗替尼治疗安全有效,并且不良反应可以耐受,这为患者带来了新的希望。然而,一旦出现安罗替尼耐药,晚期患者的治疗将面临更大的困难。
本研究通过大剂量冲击联合低剂量诱导的方法成功培养出对安罗替尼耐药的肝癌细胞,并通过ceRNA芯片对耐药肝癌细胞与正常肝癌细胞进行测序比较发现共有差异mRNA 2790个,其中上调mRNA有611个,下调mRNA有2179个。通过Go和KEGG pathway分析发现,差异mRNA分布最多的3个基因集为cell、cell part和cellular progres,KEGG中基因改变最多的通路为信号传导通路。通过缩小P值筛选出差异性较大的10个mRNA中有4个mRNA与耐药和细胞生长与死亡有关,分别为BIRC7、BIRC2、ABCC2、MAPK8。
杆状病毒IAP重复序列7(BIRC7)是最近发现的一个凋亡抑制蛋白家族成员。BIRC7的过表达与凋亡、化疗和放疗抵抗力增加、肿瘤复发和患者生存率下降有关[10-11]。杆状病毒IAP重复序列2(BIRC2)与BIRC7同属凋亡抑制蛋白家族。在NF-κB的调控中发挥关键作用[12-13],同时,抗凋亡基因BIRC2和BIRC3是潜在的致癌基因染色体9A1扩增子的驱动因子,可以增强肿瘤细胞的活性并抑制其凋亡[14]。有研究[15]表明BIRC2不仅可以抑制HIV1的转录,还可被Smac模拟物靶向作用以促进病毒潜伏期的逆转。ABCC2包含32个外显子,其中4个主要在肝脏中表达[16-17],与Dubin-Johnson综合征和遗传性胆汁淤积性疾病有密切关系。研究[18]表明ABCC2与苯妥英钠、卡马西平、丙戊酸钠、拉莫三嗪、托吡酯和左乙拉西坦等抗癫痫药物的耐药机制相关。MAPK8,也称为c-Jun N末端激酶,是MAPK8家族中的一员[19],可以通过MAPK信号通路介导对替莫唑胺的抗性和胶质母细胞瘤细胞凋亡[20]。
综上所述,通过分析安罗替尼耐药的肝癌细胞与正常肝癌细胞的基因表达差异,从中筛选出了10个差异最大的mRNA,进一步研究发现,在耐药细胞中BIRC2、ABCC2、MAPK8表达水平下降,而BIRC7的表达水平增加;其中BIRC7高表达以及MAPK8低表达均与肝癌患者的生存率降低相关,而BIRC2与ABCC2的表达水平与肝癌患者生存率没有显著相关性,这对以后的实验和临床工作存在一定的借鉴意义。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:谷俊谋负责课题设计,资料分析,撰写论文;王立博、曾德俊、陆勤伟、董凯、梁若鹏、王维杰、朱荣涛参与收集数据,修改论文;孙玉岭负责拟定写作思路,指导撰写文章并最后定稿。
