游离脂肪酸诱导的肝细胞脂肪变性对巨噬细胞极化的影响
2021-03-03李晓芸倪茜茜
李晓芸, 倪茜茜, 华 静
上海交通大学医学院附属仁济医院 消化内科, 上海 200001
非酒精性脂肪性肝病(NAFLD)是除外乙醇、药物等其他明确因素导致的以肝细胞内脂肪过量沉积为主要特征的一种代谢应激性肝损伤,与胰岛素抵抗和遗传易感性密切相关[1]。体内外高脂环境诱导的肝细胞内脂质过量沉积可诱发代谢-炎症反应。作为肝内天然免疫的关键细胞,巨噬细胞具有高度异质性和可塑性,在不同微环境刺激下可活化为经典活化型(M1型)和替代活化型(M2型),分别发挥促炎和抗炎作用[2]。既往研究[3]发现不同脂肪酸诱导的巨噬细胞M1/M2型极化改变能直接影响肝细胞脂质代谢。反之,脂肪变性的肝细胞能否对巨噬细胞极化及相关炎症通路产生直接影响?因此,本研究建立小鼠原代肝细胞脂肪变性体外模型,通过条件共培养体系探究脂肪变性的肝细胞对巨噬细胞极化的影响,并基于经典的炎症通路Toll样受体(TLR)4/核因子(NF)-κB蛋白活化情况探讨可能的作用机制,为NAFLD的防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物和细胞 10只健康雄性8周龄C57BL/6小鼠购自本院实验动物中心,实验动物生产许可证号:SCXK(苏)2018 - 0008;实验动物使用许可证编号:SYXK(沪) 2011-0121。小鼠巨噬细胞株RAW264.7购自中国科学院细胞库。
1.1.2 主要试剂 棕榈酸 (palmitic acid,PA)、油酸(oleic acid,OA)、Ⅰ型和Ⅳ型胶原酶、台盼蓝染料购自美国Sigma公司;D-Hanks液、DMEM培养液、胎牛血清购自美国Gibco公司;Ⅰ型鼠尾胶原购自上海创赛科学仪器有限公司;油红O染料购自阿拉丁试剂(上海)有限公司;甘油三酯(TG)试剂盒、总胆固醇(T-CHO)试剂盒、游离脂肪酸(free fatty acid, FFA)检测试剂盒购自南京建成生物工程有限公司;IL-6、IL-1β、TNFα ELISA试剂盒购自eBioscience公司;Trizol试剂、逆转录试剂盒、PCR试剂盒购自Takara公司;PCR引物购自上海生工生物工程股份有限公司;各兔抗鼠单克隆抗体购自美国Abcam公司和美国Cell Signaling Technology公司。
1.2 方法
1.2.1 小鼠原代肝细胞的分离与培养 8周龄正常饮食小鼠予4%水合氯醛0.01 mg/L麻醉后打开胸腹腔,24G穿刺插管下腔静脉,予D-Hanks液灌注,至肝脏呈土黄色后继以含0.025%Ⅰ型胶原酶和0.05% Ⅳ型胶原酶的DMEM灌注,至肝组织变软后取下剪碎置于含胶原酶的溶液中37 ℃水浴消化,100 μm无菌筛网过滤,获得细胞悬液,并离心获得肝细胞。台盼蓝染色检测细胞活率>85%,调整细胞浓度至2×106个/ml,接种于铺有 Ⅰ 型鼠尾胶原的培养皿中,以含10%胎牛血清的培养液于37 ℃、5% CO2的恒温培养箱中静置培养6 h,洗去未贴壁细胞。
1.2.2 体外FFA处理原代肝细胞 原代分离的肝细胞培养6 h后换液,将细胞分为对照(NC)组和混合FFA处理组。PA和OA以1∶2 (PA:0.33 mmol/L,OA:0.66 mmol/L)比例配制终浓度为1 mmol/L的FFA混合液[4],以含FFA的DMEM+1%BSA培养液孵育肝细胞,正常NC组肝细胞以DMEM+1%BSA培养液培养,置于37 ℃、5%CO2的恒温培养箱内培养6 h和24 h,收集培养24 h后的细胞培养上清液,过滤得到相应的条件培养液 (conditioned medium,CM),分别为CM-FFA、CM-NC。
1.2.3 肝细胞CM孵育巨噬细胞株RAW264.7 RAW264.7细胞株传代后调整细胞浓度至1×105个/ml,接种于6孔板。分别以CM-NC和CM-FFA孵育巨噬细胞株RAW264.7,置于37 ℃、5%CO2的培养箱中培养6 h和24 h后收集细胞待测。
1.2.4 油红O染色检测肝细胞内脂质沉积 FFA孵育肝细胞24 h后,去上清液,磷酸盐缓冲液清洗细胞2次,4%多聚甲醛固定细胞15 min,油红O避光染色30 min,60%异丙醇冲洗2 s,蒸馏水清洗30 s,苏木素染色25 s,明胶封片。光学显微镜下观察细胞内脂质沉积情况。
1.2.5 肝细胞内脂质、上清液中细胞因子水平和残余脂肪酸浓度的测定 收集肝细胞培养24 h后的细胞蛋白和培养上清,分别用试剂盒检测肝细胞内TG和T-CHO含量,ELISA法检测肝细胞培养上清细胞因子水平,采用试剂盒测定FFA孵育肝细胞24 h后上清残余脂肪酸的浓度,具体步骤按试剂盒说明测定。
1.2.6 Real-time PCR检测基因表达 收集正常NC和FFA孵育6 h后的肝细胞和巨噬细胞,用Trizol法提取细胞mRNA,逆转录合成cDNA,分别行Real-time PCR检测肝细胞脂质代谢相关基因和巨噬细胞M1/M2型基因表达,引物序列见表l。Real-time PCR的反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环。以β-actin作为内参照基因,用2-△△CT法计算目的基因mRNA的相对表达量。
1.2.7 Western Blot检测蛋白表达 收集肝细胞CM孵育 24 h后的巨噬细胞,以细胞裂解液(购自中国碧云天公司)抽提细胞总蛋白。取蛋白样品行SDS-PAGE电泳,湿法电转至 PVDF 膜,5%脱脂牛奶封闭2h,分别加入兔抗鼠TLR4抗体(1∶1000)、兔抗鼠NF-κBp65抗体(1∶1000)、兔抗鼠磷酸化NF-κBp65(p-NF-κBp65)抗体(1∶1000)、兔抗鼠NF-κB抑制因子(IκBα)抗体(1∶1000)、兔抗鼠磷酸化IκBα(p-IκBα)抗体(1∶1000)、兔抗鼠β-actin抗体(1∶5000),4 ℃孵育过夜;洗膜,加入辣根过氧化物酶偶联的羊抗兔第二抗体(1∶10 000),室温孵育l h;洗膜,加入ECL发光剂显色,置暗盒X线曝光,常规显影、定影。采用Image J对结果进行灰度定量分析。

表1 Real-time PCR引物序列表
1.3 伦理学审查 本研究方案经由上海交通大学医学院附属仁济医院实验动物伦理委员会审批,批号:RJ2018-0930,符合实验室动物管理与使用准则。
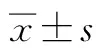
2 结果
2.1 FFA对肝细胞脂质沉积的影响 油红O染色检测显示,NC组肝细胞内仅见少量脂滴沉积,FFA孵育可诱导肝细胞内大量脂滴沉积(图1)。肝细胞内脂质含量测定显示,FFA孵育后肝细胞内TG含量和T-CHO含量均显著增加(P值均<0.05)(表2)。
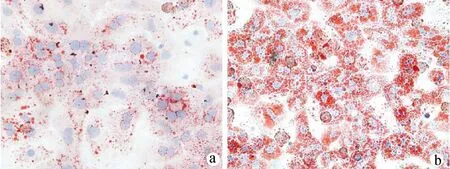
注:a,NC组;b,FFA组。
2.2 FFA对肝细胞脂质代谢相关基因mRNA表达的影响 Real-time PCR结果显示,FFA显著上调脂质合成基因SREBP1C和FASN 的mRNA表达(P值均< 0.05),并降低脂质分解基因ACOX1 和CPT1A mRNA表达(P值均<0.05)(表2)。

表2 两组肝细胞内脂质沉积及脂质代谢相关基因相对表达量的比较
2.3 FFA对肝细胞分泌细胞因子的影响 以脂多糖(LPS)刺激作为诱导肝细胞炎性细胞因子表达的对照,ELISA检测结果显示,FFA孵育后肝细胞培养上清中炎性细胞因子IL-6、IL-1β和TNFα的水平明显增加(P值均< 0.01)(表3)。

表3 FFA对肝细胞分泌细胞因子的影响
2.4 FFA诱导的肝细胞CM对巨噬细胞M1/M2型极化基因表达的影响 Real-time PCR结果显示,与CM-NC组相比,FFA孵育的CM-FFA显著增加巨噬细胞M1型基因iNOS2、TNFα和IL-6 mRNA表达(P值均<0.01),降低M2型基因IL-10 mRNA表达水平(P<0.01)。为了明确肝细胞CM中残余FFA对巨噬细胞极化的直接影响,本研究测定了培养上清中残余FFA浓度(0.22 mmol/L),并设定以此浓度FFA直接孵育巨噬细胞(低浓度FFA组)。结果显示,与CM-NC组相比,低浓度FFA对巨噬细胞M1型及M2型基因的表达均无显著影响,说明培养上清中残余FFA对巨噬细胞极化没有直接影响(表4)。

表4 3组巨噬细胞M1/M2型极化基因相对表达量的比较
2.5 FFA诱导的肝细胞CM对巨噬细胞TLR4/NF-κB通路相关蛋白表达的影响 Western Blot 检测结果显示,CM-FFA显著增加巨噬细胞TLR4、p-NF-κBp65和p-IκBα的蛋白表达水平(P值均<0.05)(图2,表5)。
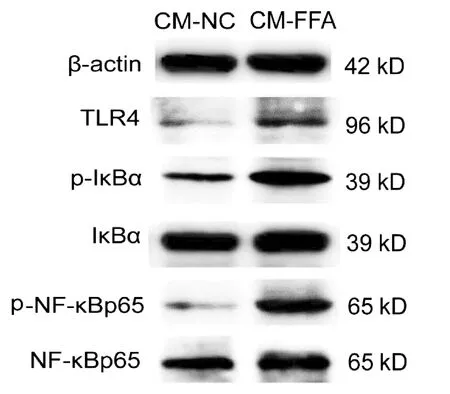
图2 Western Blot检测FFA诱导的肝细胞CM对巨噬细胞TLR4/NF-κB通路相关蛋白表达的影响
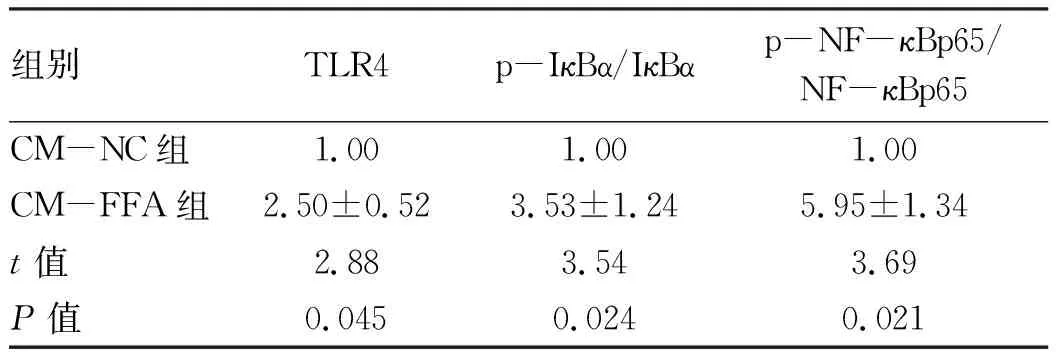
表5 两组巨噬细胞TLR4/NF-κB通路相关蛋白相对表达量的比较
3 讨论
NAFLD发病机制较为复杂,涉及到经典的“二次打击”学说和目前普遍接受的“多重打击”学说[5]。近年认为,脂质代谢紊乱相关的肝脏脂质过量沉积和天然免疫紊乱相关的慢性系统性炎症反应是NAFLD发生进展中的两个关键环节。
FFA不仅是细胞代谢的重要能量来源, 在调节糖、脂代谢和胰岛素敏感性等方面也发挥重要作用。既往研究[6]发现,FFA水平升高不仅导致肝脏胰岛素抵抗,同时也会刺激肝脏分泌TNFα和IL-6等促炎因子,激活NF-κB炎症通路。PA和OA是体内常见的FFA,以PA为代表的长链饱和脂肪酸可增加肝细胞脂毒性。Gómez-Lechón等[4]研究表明,以1 mmol/L浓度的FFA(PA∶OA=1∶2)孵育肝细胞24 h为体外建立肝细胞脂肪变性模型的最适条件。因此,本研究以同样配比及浓度的FFA孵育小鼠原代肝细胞,结果表明,FFA诱导小鼠原代肝细胞明显脂质沉积,细胞内生成TG及T-CHO水平显著增加,FFA促使肝细胞脂质合成相关基因SREBP1C和FASN的表达显著上调,脂质分解基因ACOX1和CPT1A的表达显著下调。并且,脂肪变性的肝细胞能分泌较高水平的炎性细胞因子(IL-6、IL-1β和TNFα)。这些研究结果提示,FFA不仅促进了肝脏脂质过量沉积和代谢异常,也可直接诱发肝细胞炎症反应。因此,肝细胞作为体内重要的脂质代谢异常和炎症反应的枢纽场所,在NAFLD进展中发挥重要的始动作用。
巨噬细胞,包括肝内固有的Kupffer细胞和外周血募集的巨噬细胞,是肝内天然免疫的关键细胞,在NAFLD发生发展中起重要作用[7]。清除肝内活化的Kupffer细胞则可减轻肝脏脂肪变性、促炎性单核细胞的浸润和胰岛素抵抗[8]。体内外高脂环境下巨噬细胞/Kupffer细胞与肝细胞间存在密切相互作用,两者间“对话”对NAFLD的发生发展具有重要的意义。笔者的既往研究[3,9]也发现饱和脂肪酸诱导的M1型巨噬细胞极化可促进肝细胞脂质合成,肝细胞内脂肪过度沉积是NAFLD最为显著的特征[10],尽管脂肪变性的肝细胞具有一定的炎症反应性,但目前鲜少有研究关注脂肪变性的肝细胞对巨噬细胞极化的影响。在本研究中,笔者通过建立脂肪变性的肝细胞CM与巨噬细胞的共培养体系,探索脂毒性肝细胞对巨噬细胞极化的影响和可能的作用机制。研究结果显示,FFA诱导的脂肪变性的肝细胞培养上清可显著上调巨噬细胞M1型基因表达,抑制部分M2型基因表达,促进巨噬细胞M1型活化。为了排除FFA孵育肝细胞的CM中残余脂肪酸对巨噬细胞极化的直接影响,本研究测定了培养上清中的残余FFA浓度,发现FFA孵育肝细胞24 h后上清中残余FFA浓度较低,仅0.22 mmol/L,此低浓度的FFA对巨噬细胞的极化没有显著的直接影响。本研究结果提示脂肪变性的肝细胞能通过分泌炎症因子调节巨噬细胞极性改变。
TLR4作为TLRs最重要的亚型之一,可特异性识别细菌LPS,参与调节机体免疫功能、细胞凋亡、炎性反应等过程[11-12]。激活的TLR4经过构象改变和二聚体化,招募MyD88等配体,随后激活下游的NF-κBp65。NF-κB是一种与炎症反应密切相关的核因子,当 NF-κB的作用受到抑制时,巨噬细胞可从M1型向M2型转化[13]。本研究表明,脂肪变性的肝细胞可显著增加巨噬细胞TLR4、p-IκBα和p-NF-κBp65的蛋白表达水平,这说明脂毒性肝细胞可直接促进巨噬细胞TLR4/NF-κB炎症信号通路的活化。因此,可以推测,FFA诱导的脂肪变性肝细胞可能通过分泌多种促炎性细胞因子,作为损伤相关分子模式与巨噬细胞膜表面TLR4受体相结合,招募下游相应配体,促使IκB磷酸化,进一步激活NF-κBp65磷酸化,产生炎性介质,诱导巨噬细胞向M1型极化改变。
综上所述,FFA诱导的肝细胞脂肪变性通过分泌炎性细胞因子、激活巨噬细胞TLR4/NF-κB炎症通路,促进巨噬细胞向M1型极化,从而推动NAFLD的发展。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:李晓芸、华静负责课题设计,撰写论文;倪茜茜参与收集数据,资料分析;华静负责拟定写作思路,指导撰写文章并最后定稿。
