利用CRISPR/Cas9慢病毒载体构建敲除大鼠肝星状细胞COX-2基因的细胞模型
2021-03-03阳学风易世杰周克兵龙建武
彭 敏, 曹 婷, 阳学风, 易世杰, 傅 念, 周克兵, 龙建武
南华大学附属南华医院 消化内科, 湖南 衡阳 421002
肝纤维化是一系列慢性肝损伤导致的病理生理过程[1],它是发展为肝硬化的必经过程。目前认为,肝星状细胞(HSC)的活化是肝纤维化发生的中心环节,因此,通过抑制HSC活化可以达到逆转肝纤维化的目的[2]。环氧合酶(cyclooxygenase,COX)是花生四烯酸合成前列腺素的关键限速酶[3],包括COX-1、COX-2和COX-3三个亚型,COX-2属于诱导型酶。国内外大量研究[4]证明,COX-2参与肝损伤炎症反应,促进肝纤维化发展病程,也调节HSC活化及增殖,参与进一步肝损伤。已有相关研究[5-9]报道表明,抑制COX-2表达,能够下调HSC活化和增殖,可能成为逆转肝纤维化的策略。目前COX-2和肝纤维化关系的研究主要集中在COX-2抑制剂或siRNA干扰技术上,至今没有文献报道完全敲除HSC中COX-2基因对HSC功能的影响及机制。近年来随着CRISPR/Cas9技术的兴起,使通过CRISPR/Cas9技术对COX-2基因进行敲除成为一种新的研究方向。基于CRISPR/Cas9系统相比于RNAi技术更容易获得稳定的表型变化,而且具有设计简便、易于操作及特异性高的优势[10]。因此本实验通过构建慢病毒表达载体,利用CRISPR/Cas9技术敲除HSC的COX-2基因,以期获得能稳定传代的COX-2基因缺陷的细胞模型,为今后研究COX-2基因缺陷的HSC功能及机制提供实验基础,为临床上治疗肝纤维化提供新策略。
1 材料与方法
1.1 实验材料 HSC-T6细胞购自中科院上海细胞库,293T细胞购自南京科佰生物科技有限公司,Lenti-CAS9-puro质粒、Lenti-NC-EGFP质粒、GV371质粒、p Helper 1.0载体,p Helper 2.0载体、Primer(R&F)、dsDNA oligo、TOP10感受态均购自上海吉凯基因化学技术有限公司,Lipofectamine TM2000购自美国Invitrogen公司,基因组 DNA 抽提试剂盒购自TIANGEN公司,基因敲除和突变检测试剂盒购自吉盛医学公司。
1.2 实验方法
1.2.1 COX-2-sgRNA表达载体构建 (1)293T细胞培养:①细胞复苏;②细胞传代;③细胞冻存。(2)sgRNA靶点序列的选择与合成:①靶序列选择。根据上海吉凯基因化学技术有限公司设计3条COX-2-sgRNA干扰靶点序列,sgRNA-1:5′-AAATGTGACTGTACCCGGAC-3′;sgRNA-2:5′-CATGATTGAATTCCGAAGGA-3′;sgRNA-3:5′-TTTCACCGTAGAATCCAGTC-3′。②寡核苷酸单链合成:以上述靶序列为基础,设计合成3对寡核苷酸单链,其两端加入BbsI位点。(3)引物退火形成带黏性末端的双链:将引物干粉溶解于退火缓冲液中,95 ℃水浴15 min,冷却至室温,稀释200倍后使用。(4)sgRNA表达载体酶切重组:通过酶切连接反应体系进行酶切连接反应,结束后将形成的重组质粒直接转化。(5)重组质粒转化、测序:取n支TOP10感受态,进行培养,待菌落长出后,挑取8个大的单克隆菌落于15 ml的液体培养基,送公司进行测序。(6)质粒提取:参照E.Z.N.A Endo-free plasmid mini kit试剂盒说明书标准方法制备,所得DNA溶液-20 ℃保存或直接用于下一步实验。(7)病毒包装:①病毒转染;②病毒的收获及浓缩;③病毒滴度的测定(荧光法)。使用荧光显微镜观察转染效果,图片均使用Pixera Camera图像分析系统采集。
1.2.2 CRISPR/Cas9慢病毒转染HSC-T6细胞及活性检测 (1)准备目的细胞:HSC-T6细胞的复苏、传代和冻存同前所述293T细胞的培养方法。(2)细胞转染:①Lenti-Cas9-puro病毒转染HSC-T6细胞,构建稳定表达Cas9蛋白的HSC-T6细胞,收集细胞标记为HSC-T6-Cas9细胞,进行下一步实验。②Real-time PCR检测Cas9病毒转染HSC-T6细胞后的表达情况:提取总RNA,逆转录获得cDNA(按照Promega公司提供的逆转录试剂盒操作步骤进行)将得到的产物cDNA -20 ℃保存备用,最后进行Real-time PCR,LV-Cas9-Puro基因的引物由广州市锐博生物科技有限公司设计合成,引物序列如表1,按比例配置反应体系(12 μl体系),反应结束后通过制作熔解曲线确认为单峰曲线,基因表达量用相对定量分析法。(3) HSC-T6-Cas9细胞的冻存、复检:qPCR检测结果合格后进行HSC-T6-Cas9细胞冻存,至少冻存6支,冻存2~3 d,任意复苏1支,显微镜下观察复苏细胞状态。(4)Lenti-COX-2-sgRNA-EGFP病毒转染HSC-T6-Cas9细胞:①在上一步实验的细胞基础上,将细胞分为3组,分别为KO1组(Lenti-COX-2-sgRNA-1病毒转染组)、KO2组(Lenti-COX-2-sgRNA-2病毒转染组)、KO3组(Lenti-COX-2-sgRNA-3病毒转染组),加入相对应的Lenti-COX-2-sgRNA-1、Lenti-COX-2-sgRNA-2、Lenti-COX-2-sgRNA-3病毒进行感染。同时设立NC组(Lenti-NC病毒转染组)、CON组(HSC-T6细胞)。②感染72 h左右,在荧光显微镜下观察细胞中绿色荧光的表达状况,估计荧光率;③分别用含1 μg/ml puromycin的培养液培养传代细胞,得到COX-2基因敲除的HSC-T6-COX-2-/-混合细胞,分别标记为HSC-T6-COX-2-/--1细胞、HSC-T6-COX-2-/--2细胞、HSC-T6-COX-2-/--3细胞,并收集细胞做下一步检测。(5)Lenti-NC-EGFP病毒转染HSC-T6细胞:根据MOI值,感染Lenti-NC-EGFP病毒,在荧光显微镜下观察细胞中绿色荧光的表达情况,估计荧光率,收集细胞做下一步检测,标记为HSC-T6-NC细胞。
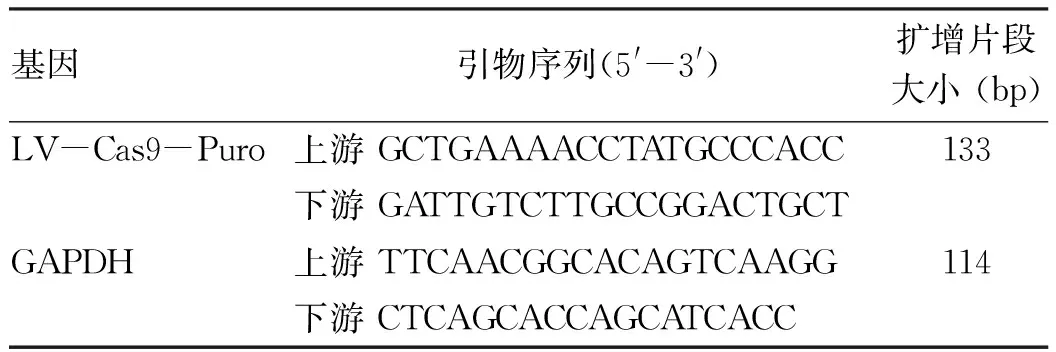
表1 LV-Cas9-Puro基因的引物序列
1.2.3 CRISPR/Cas9系统对COX-2靶点的敲除活性检测 (1)混合细胞克隆pool检测:①提取各基因组DNA;②PCR引物设计,按照引物设计通用原则,由上海吉凯公司设计合成(表2);③按比例配置反应体系,PCR反应程序反应后获得杂交DNA产物;④PCR结束后,取3 μl进行电泳检测。(2)Cruiser酶切检测:在灭菌PCR管中配制PCR产物2~3 μl、Detecase Buffer 2 μl、Detecase 1 μl、ddH2O至10 μl,45 ℃反应20 min后,立即向上述10 μl体系内加入2 μl终止液(Stop Buffer),然后进行2%琼脂糖凝胶电泳检测。(3)蛋白水平检测:①蛋白抽提;②SDS-PAGE;③免疫印迹(湿转);④抗体杂交;⑤X光显影。
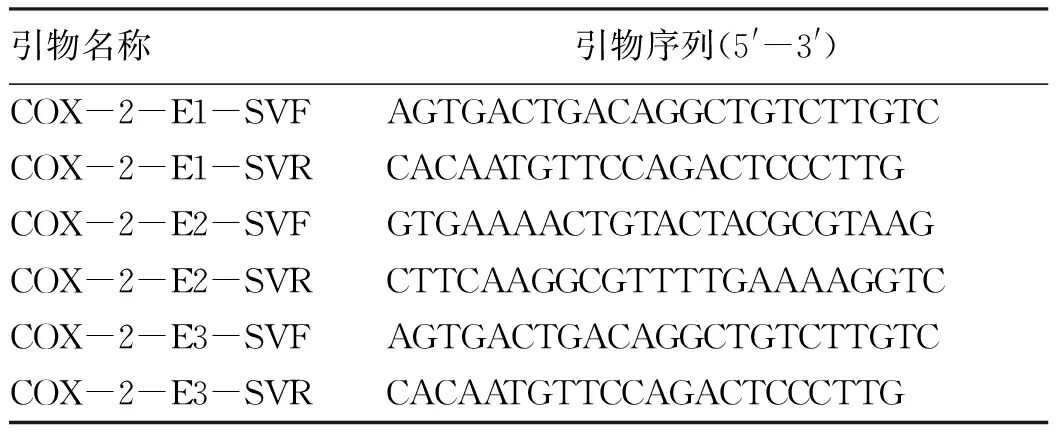
表2 PCR引物序列
2 结果
2.1 COX-2-sgRNA表达载体构建 根据公司设计3条sgRNA,在其两端加入BbsI位点,化学合成设计序列并退火形成带有黏性末端的双链,将其连接到经BbsI限制性核酸内切酶切割形成的线性化GV371表达载体上,经转化扩增载体的表达,并将转化子测序验证。测序结果显示,COX-2-sgRNA-1、2、3序列均成功插入目的载体,且序列完全正确。证实COX-2-sgRNA表达载体构建成功(图1)。

注:a,COX-2-sgRNA-1; b, COX-2-sgRNA-2; c,COX-2-sgRNA-3。
2.2 病毒滴度的测定 在倒置显微镜及荧光显微镜下观察加入病毒不同稀释倍数的293T细胞荧光表达情况显示,荧光细胞数量随病毒稀释倍数增加而减少,按照滴度计算公式:细胞数量×感染效率/感染体积,计算出COX-2-sgRNA-1的病毒滴度为8×108,COX-2-sgRNA-2、COX-2-sgRNA-3的病毒滴度为1×109(图2)。

图2 不同稀释倍数COX-2-sgRNA慢病毒感染293T细胞的荧光表达情况(×100)
2.3 细胞转染实验
2.3.1 puromycin筛选HSC-T6-Cas9细胞 Lenti-Cas9-puro病毒为抗性基因标记,如果转染入细胞,于感染48~72 h后,换用含puromycin的培养基筛选细胞,细胞存活即为阳性感染,图3为puromycin筛选前后HSC-T6-Cas9细胞状态及荧光表达情况。与CON组对比,筛选前后HSC-T6-Cas9细胞状态好,未出现大量死亡现象。

注:左右分别是同一视野下光学显微镜图片和荧光显微镜图片。a,CON组;b,puromycin筛选前HSC-T6-Cas9细胞;c,puromycin筛选后HSC-T6-Cas9细胞。
2.3.2 Real-time PCR检测Cas9病毒转染HSC-T6细胞后的表达情况 收集转染获得的HSC-T6-Cas9细胞以及CON组细胞,分别提取LV-Cas9-Puro mRNA,利用Real-time PCR检测获得各组基因循环阈值,并绘制各基因在各组样品中的相对定量直方图。结果显示:CON组和HSC-T6-Cas9细胞组目的基因的相对表达量分别为1.00±0.02、541.93±105.76,提示HSC-T6-Cas9细胞中LV-Cas9-Puro mRNA表达高于CON组细胞,差异具有统计学意义(t=12.995,P<0.01)(图4、5)。

图4 扩增曲线
2.3.3 HSC-T6-Cas9细胞冻存后复检 经Real-time PCR检测HSC-T6-Cas9细胞中LV-Cas9-Puro mRNA表达丰度明显高于CON组,将HSC-T6-Cas9细胞冻存2~3 d后复苏,在显微镜下观察,结果显示:复苏细胞状态较好(图6),提示冻存细胞合格,稳定表达Cas9蛋白的HSC-T6细胞构建成功。

图5 熔解曲线

注:左右分别是同一视野下光学显微镜图片和荧光显微镜图片。
2.3.4 Lenti-COX-2-sgRNA-EGFP病毒转染HSC-T6-Cas9细胞 COX-2-sgRNA质粒为荧光标记,如果转染入细胞,于感染72 h 左右,荧光显微镜下观察,细胞会出现绿色荧光。随机选择10个视野,计算阳性细胞与总细胞之比作为质粒转染效率指标。图7为各组病毒转染72 h荧光显微镜图片。KO1、KO2、KO3、NC组细胞均可见绿色荧光,转染效率在80%以上,说明病毒转染成功,并且puromycin对细胞无杀害作用。CON组未见绿色荧光出现。
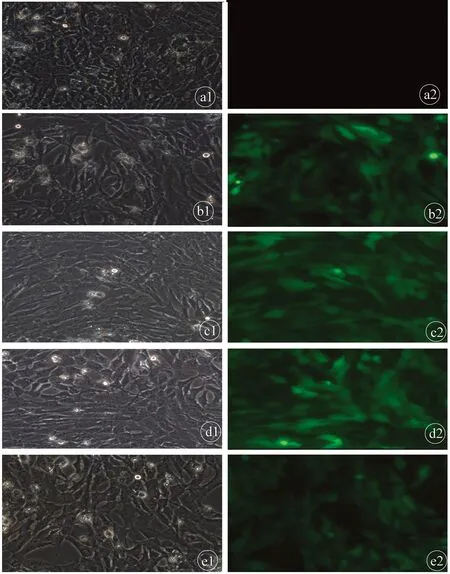
注:左右分别是同一视野下光学显微镜图和荧光显微镜图。a,CON组;b,KO1组;c,KO2组;d,KO3组;e,NC组。
2.4 CRISPR/Cas9系统对COX-2靶点的敲除活性检测
2.4.1 Cruiser酶切检测 为了研究CRISPR/Cas9系统对靶点的敲除作用,本实验通过将构建好的Cas9蛋白表达载体和sgRNA表达载体转染细胞。72 h后提取基因组,在敲除靶点上下游设计引物,通过PCR扩增出包含敲除靶点的一条目的片段,取部分行电泳检测,利用Cruiser酶切检测其敲除效率(图8)。从结果可以看出,针对COX-2靶基因所设计的CRISPR/Cas9慢病毒表达载体能在靶点起作用。作用于KO1组靶点序列引物COX-2-E1-SVF/R,扩增片段长为369 bp,酶切片段长分别为120 bp、249 bp;KO2组靶点序列引物COX-2-E2-SVF/R,扩增片段长为383 bp,酶切片段长分别为251 bp、132 bp;KO3组靶点序列引物COX-2-E3-SVF/R,扩增片段长为369 bp,酶切片段长分别为123 bp、246 bp。而CON组与NC组未出现酶切条带,提示无突变位点。KO1、KO2、KO3靶点有活性,且KO2活性较佳,选用KO2组进行后续蛋白水平验证。
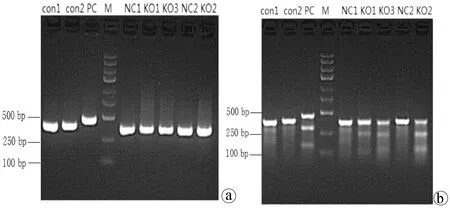
注:a,酶切前;b,Cruiser酶切后。
2.4.2 蛋白水平验证 分别于转染72 h、96 h提取CON、NC、KO组中的COX-2蛋白,利用Western-Blot检测COX-2蛋白质表达情况。结果显示:KO组与CON组、NC组比较,COX-2蛋白质表达明显下调,灰度值差异具有统计学意义(P值均<0.01)(表3,图9、10)。

表3 转染72 h、96 h各组COX-2蛋白质相对表达情况
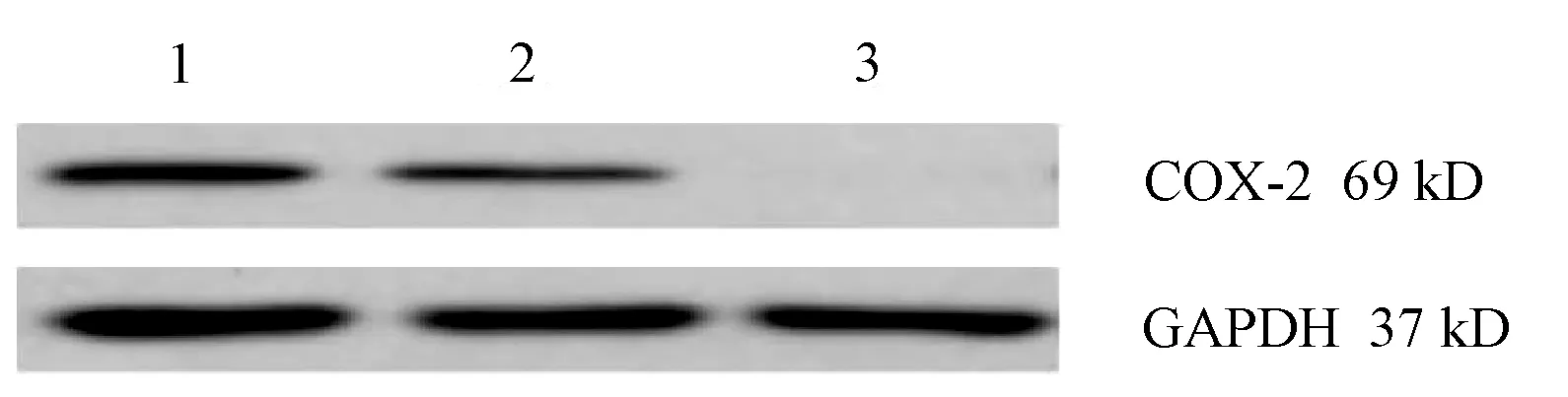
注:1,CON组;2,NC组;3,KO组。

注:1,CON组; 2,NC组; 3,KO组。
3 讨论
HSC活化被普遍认为是肝纤维化发生的关键环节,是肝纤维化治疗的重要靶点,将抗纤维化药物靶向递送至HSC,减少药物非特异性作用引起的副作用,是目前抗纤维化药物开发的重要策略[11]。同时COX-2参与调节HSC活化和增殖,参与肝纤维化发病进程。最新研究[12]表明,COX-2的结构和构象的变化可动态监测肝病的进展,但目前COX-2和肝纤维化关系的研究主要集中在COX-2抑制剂或RNAi技术上,这些技术存在特异性不高、不能获得稳定传代的细胞株等缺陷,因此需要一种高效、特异性强、稳定的基因编辑技术,人为敲除细胞内相关基因的部分片段,从而获得能稳定传代的COX-2基因缺陷的HSC进行后期的功能研究。
慢病毒以RNA为模板,先在反转录酶的作用下合成cDNA,再以此为模板合成双链DNA,通过整合酶作用,整合在宿主细胞的染色体上,可以长期表达[13]。CRISPR/Cas9系统作为第3代基因组编辑工具,与第1代锌指核糖核酸酶和第2代转录激活样效应因子核酸酶相比,该系统由sgRNA识别靶位点,具有低成本、简便、精确、高效等优势。CRISPR/Cas9技术为各物种和多种细胞的基因组编辑开拓了选择途径。到目前为止,CRISPR/Cas9技术已经成功用于小鼠、斑马鱼、酵母、拟南芥、小麦、大米以及哺乳动物细胞等。
最初人们是利用电穿孔、核转染与脂质体的方式将Cas9和sgRNA转入细胞内[14-16],但利用电穿孔的方法进行转染对细胞损伤较大,达不到理想的转染效果。病毒载体如逆转录病毒载体、慢病毒载体[17]、腺病毒载体等能提高基因组编辑的效率,在体外应用比较广泛[18]。所以本实验采用慢病毒载体将sgRNA、Cas9导入HSC-T6细胞,构建COX-2基因敲除的HSC-T6细胞模型。本实验成功构建了3个慢病毒载体经测序验证,结果显示,COX-2-sgRNA-1、2、3序列均成功插入目的载体,且序列完全正确。证实COX-2-sgRNA表达载体构建成功。使用荧光定量法检测出各组病毒滴度均在1×108以上。将Cas9慢病毒分别转染至HSC-T6细胞,使用puromycin筛选、Real-time PCR检测以及冻存后复检,结果显示,利用CRISPR/Cas9技术,即使不进行单克隆筛选,也能永久敲除COX-2基因,相比较RNAi而言更有优势。
本实验构建了针对COX-2靶基因的CRISPR/Cas9慢病毒表达载体,成功转染HSC-T6细胞,获得能稳定传代的Cas9蛋白的HSC-T6细胞和COX-2基因缺陷的HSC-T6-COX-2-/-细胞,为后期的功能研究提供良好的工具和手段,为临床上治疗肝纤维化提供新策略。在此基础上,本课题组会继续研究COX-2基因敲除后HSC-T6细胞的增殖、凋亡、衰老、自噬等功能的变化,并探讨其作用机制,争取将COX-2对HSC-T6细胞作用的具体机制阐述清楚。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突,特此声明。
作者贡献声明:彭敏、曹婷、阳学风负责课题设计,资料分析,撰写论文;易世杰、周克兵、龙建武参与收集数据,修改论文;傅念、阳学风负责拟定写作思路,指导撰写文章并最后定稿。
