非肥胖型非酒精性脂肪性肝病的病因及治疗进展
2021-03-03李洋洋谢正元
李洋洋, 谢正元
南昌大学第二附属医院 消化内科, 南昌 330006
非酒精性脂肪性肝病(NAFLD)在全球的发病率呈逐年上升趋势,根据BMI可分为肥胖型NAFLD和非肥胖型NAFLD。在亚太地区,BMI>25 kg/m2被定义为肥胖,而在欧美等西方国家BMI>30 kg/m2被定义为肥胖。NAFLD亦经常见于BMI正常的人群[1]。早在2017年,Naderian等[2]进行的一项基于超声的研究发现,非肥胖人群中NAFLD的患病率为17.5%。然而超声检查不能评估非酒精性脂肪性肝炎(NASH)的存在,可能低估了NAFLD的真实患病率,因此其实际患病率可能更高。Zeng等[3]的一项调查研究发现,即使腰围正常,在非肥胖中国成年人中NAFLD也不罕见。除此之外,Ye等[4]进行的荟萃分析发现,全球NAFLD人口中约40%被归类为非肥胖,其中近五分之一是瘦人,非肥胖和瘦人组均具有大量的长期肝脏和非肝脏并发症。非肥胖型NAFLD和肥胖型NAFLD均存在代谢紊乱[5],且非肥胖型NAFLD患者发生心血管疾病的风险更大[6]。因此,本文将对非肥胖型NAFLD的病因及治疗进展作一综述。
1 非肥胖型NAFLD的危险因素
目前研究表明,生活方式、遗传因素、环境、种族因素等均可导致非肥胖人群NAFLD的发生(图1),这一点在亚太地区尤为明显。但目前非肥胖型NAFLD的病因及发病机制仍不清楚,需要大量的实验数据和临床实践的积累。
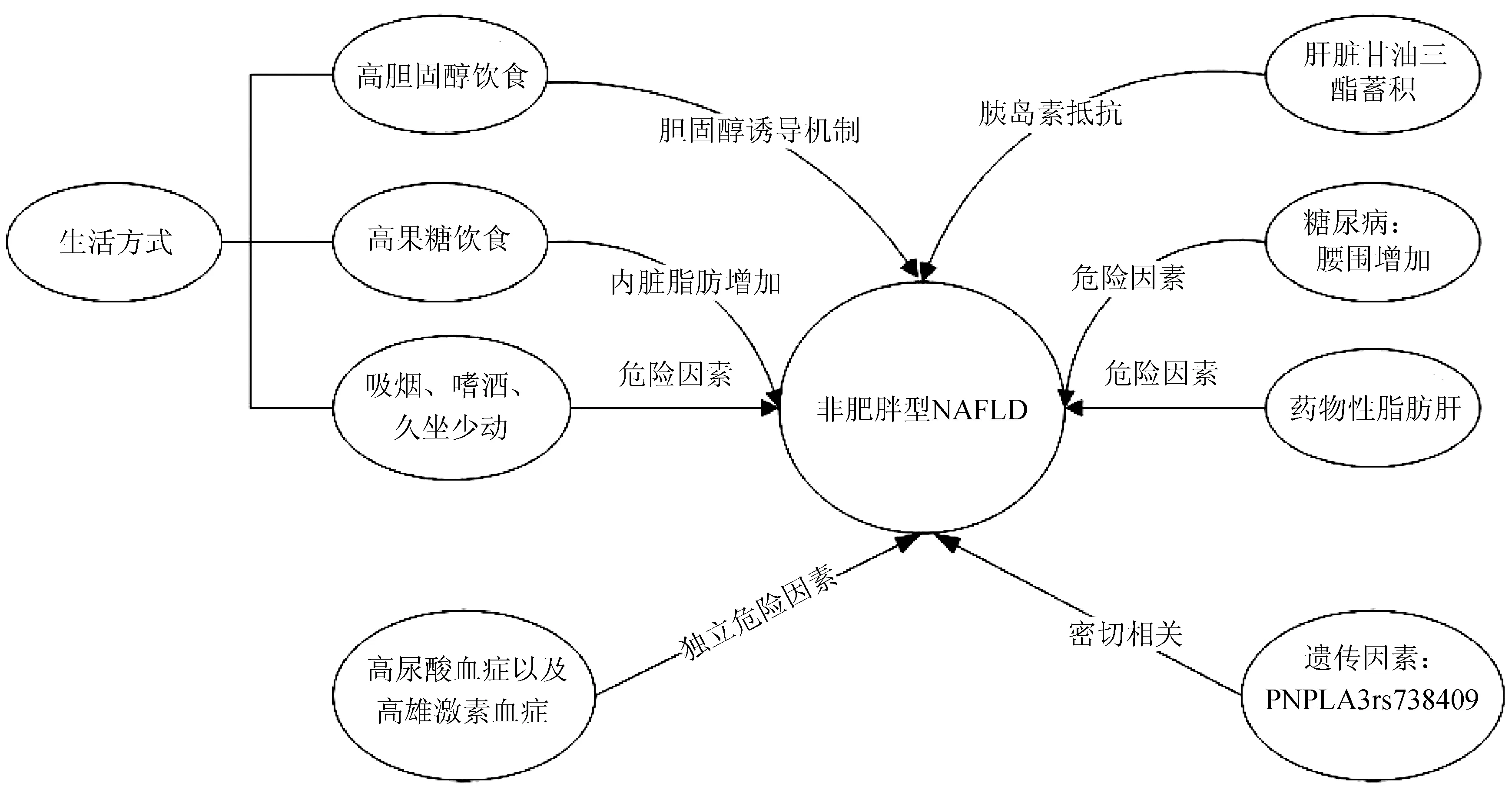
图1 非肥胖型NAFLD的危险因素
1.1 肝脏甘油三酯蓄积 胰岛素抵抗在NAFLD发生及发展中起到关键作用。关于这一点已被人们普遍接受,即使在非肥胖和瘦人个体中也是如此[7]。有研究[8]表明非肥胖型NAFLD更有可能出现胰岛素抵抗。Gonzalez-Cantero等[9]研究表明胰岛素抵抗与NAFLD独立相关,与腰围或BMI并无关系,并通过回归分析发现肝脏甘油三酯含量才是胰岛素抵抗最重要的决定因素。在非肥胖型NAFLD的发生及发展过程中,肝脏甘油三酯蓄积增加更有可能导致胰岛素抵抗的发生。
1.2 遗传因素 含Patatin样磷脂酶域蛋白3(PNPLA3)是编码脂肪细胞表达脂肪酶的相关基因。近期,许多研究发现PNPLA3基因型与非肥胖型NAFLD发生、发展密切相关。2016年,Honda等[10]发现在非肥胖型NAFLD中,PNPLA3rs738409GG基因型所占比例较高,明显高于肥胖型NAFLD。并通过进一步研究发现,rs738409GG基因型与肝脏小叶炎症、肝细胞肿胀及NAFLD活动评分密切相关。随后,许多研究[11-12]相继发现,非肥胖型NAFLD中rs738409的风险等位基因(G等位基因)频率高于肥胖组,并在NAFLD的发展中起着关键作用。而目前PNPLA3rs738409基因具体作用机制尚不清楚,有待进一步研究。
1.3 生活方式 近年来许多研究表明,生活方式如高胆固醇、高果糖饮食,吸烟、嗜酒及久坐少动等均与非肥胖型NAFLD发病密切相关。流行病学研究表明,在NAFLD中,肥胖患者的总能量、脂肪(包括多不饱和脂肪酸)及碳水化合物膳食摄入量明显高于非肥胖患者及健康志愿者,而非肥胖患者胆固醇摄入量明显高于肥胖患者。因此,高胆固醇饮食可能会导致非肥胖型NAFLD的发生。Tu等[13]提出的胆固醇诱导机制表明,游离胆固醇、胆固醇酯和胆酸升高与鞘磷脂和磷脂酰胆碱代谢变化相关,并共同驱动及诱导非肥胖型NAFLD的发生及发展,这为解释高胆固醇饮食对非肥胖型NAFLD/NASH患者的影响提供了第一批代谢物参考资料。而高果糖饮食可以使机体产生脂质,并促进炎症,果糖在细胞内迅速磷酸化,导致细胞内ATP耗竭、尿酸产生及随后的细胞损伤[14]。在非肥胖NAFLD患者中,果糖摄入发挥着更大的作用。特别是对于瘦人型或营养缺乏却患有NAFLD的人群来说,虽然脂质果糖摄入相对较少,但相比而言,果糖摄入量是一个更容易改变的环境因素。对此类人群,基因多态性起着更为重要的作用,它会使过量的卡路里更易转化为肝脏脂肪,而在非肥胖型NAFLD的发展过程中,内脏脂肪是较全身脂肪或腰围更重要的风险因素[15-16]。此外,也有大量流行病学证据表明吸烟、嗜酒、久坐少动等均与非肥胖型NAFLD发病密切相关。因此,养成良好的生活饮食习惯及加强体力活动有助于预防NAFLD的发生。
1.4 糖尿病 糖尿病与NAFLD的发生及发展密切相关,约半数糖尿病患者有NAFLD[17]。近期,对于患有糖尿病的非肥胖人群,杨春伟等[18]发现,85 cm≤腰围<90 cm组发生新发NAFLD的风险是腰围<78 cm组的1.97倍,腰围≥90 cm组发生新发NAFLD的风险是腰围<78 cm组的2.19倍;在糖尿病非肥胖人群中,腰围≥85 cm很有可能是新发NAFLD的危险因素。其发生机制可能为糖尿病患者存在胰岛素抵抗和胰岛素绝对或相对不足,由于高胰岛素血症抑制了脂肪酸氧化,使脂肪沉积在肝细胞引起脂肪肝。或是由于胰岛素缺乏,血浆脂蛋白清除能力降低所致。因此,糖尿病患者更易发生脂肪肝。
1.5 高尿酸血症 近年来,许多研究证据表明,血尿酸(SUA)升高与NAFLD的发生及发展有关。Zheng等[19]根据脂肪肝的超声分级探讨SUA与非肥胖型NAFLD的关系时发现,在中国内地95 924例成年人受试者中,7503例(8.16%)非肥胖者患有NAFLD,6967例(7.58%)轻度脂肪变性,536例(0.58%)中重度脂肪变性。在这些非肥胖受试者中,脂肪肝患者的SUA水平显著高于非脂肪肝患者,而中度和重度脂肪肝患者的SUA水平显著高于轻度脂肪肝患者。其结果表明SUA水平与非肥胖型NAFLD发生和发展呈正相关,并由此推测SUA可以作为一种简单、非侵入性的方法来随访非肥胖型NAFLD患者。目前其具体机制尚不清楚,还需要进一步临床干预试验来探究降低SUA水平是否会产生有利影响。
1.6 高雄激素血症 Kim等[20]采用前瞻性研究方法比较患有和未患有多囊卵巢综合征(polycystic ovary syndrome,PCOS)的非肥胖女性中NAFLD的患病率。其肝脏超声检查结果显示,非肥胖PCOS女性NAFLD患病率显著高于非PCOS女性(5.5% vs 2.8%,P=0.027);而在调整了年龄和BMI后,PCOS与非肥胖型NAFLD相关(OR=2.62,95%CI:1.25~5.48)。因此,PCOS合并高雄激素血症确实是一个值得考虑的新危险因素。
1.7 药物性脂肪肝 非肥胖人群中,过多服用胺碘酮类药物抑制脂肪酸的β氧化并抑制呼吸链,导致脂质过氧化发生脂肪肝。另外,大剂量使用皮质激素数周后,可使脂肪分解,血浆中游离脂肪酸增多而导致脂肪肝。
2 非肥胖型NAFLD治疗进展
目前针对非肥胖型NAFLD主要的治疗方法有药物、生活方式干预等。近些年来,还有许多新颖的治疗方式如胆汁酸抑制剂、益生菌制剂、降胆固醇类药物及胰岛素增敏剂等也备受人们关注(图2)。
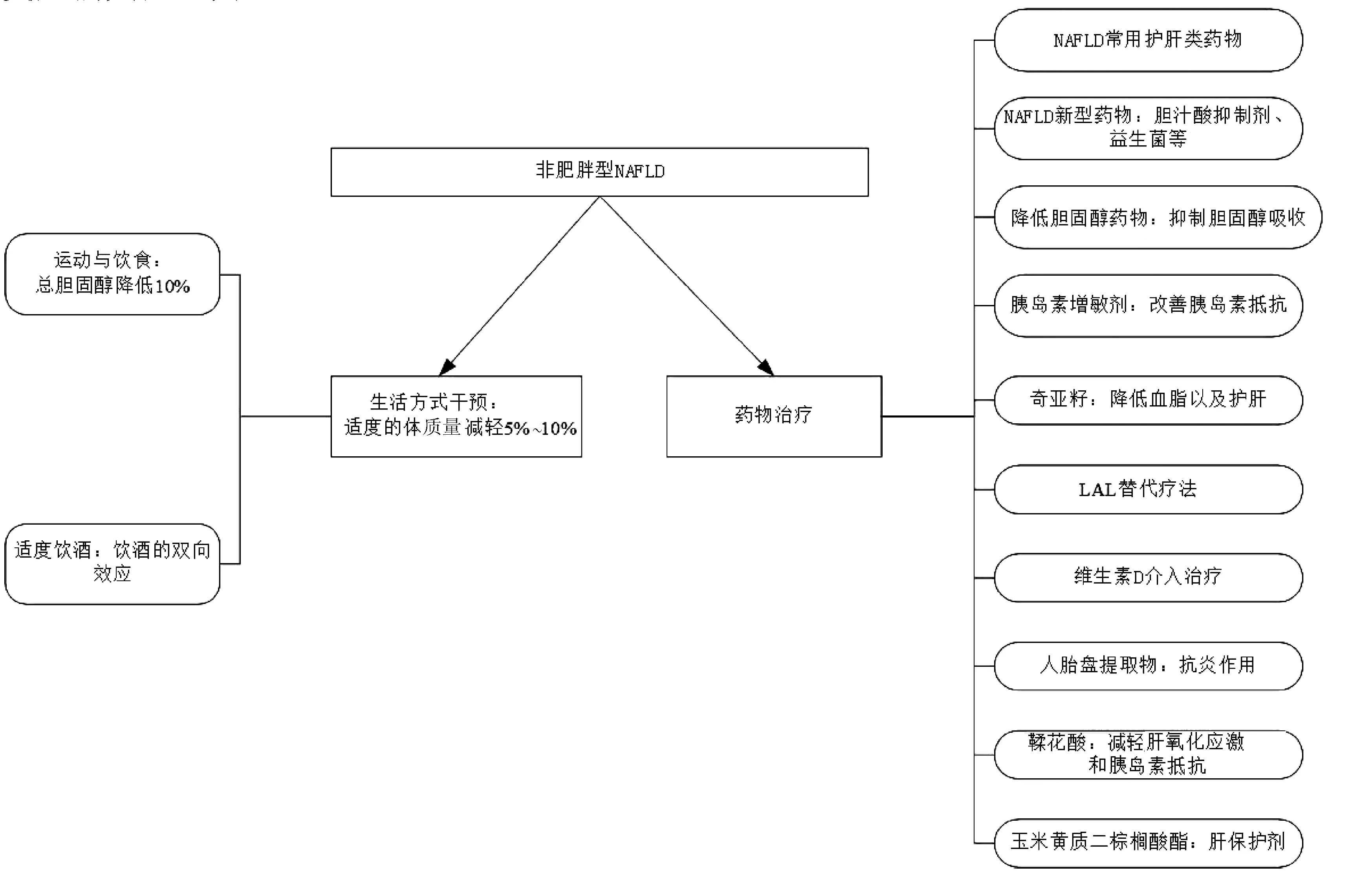
注:LAL,溶酶体酸性脂肪酶。
2.1 生活方式干预
Wong等[21]发现,非肥胖型NAFLD进行生活方式干预后,67%的患者可以得到缓解。大多数患者可以在体质量下降3%~10%的情况下实现NAFLD的缓解。生活方式干预对非肥胖和肥胖患者都能有效地治疗NAFLD。从长远来看,非肥胖患者通过减轻体质量缓解NAFLD的效果更明显。因此,对于非肥胖患者,适度的体质量减轻5%~10%可能就有明显的疗效。
2.1.1 运动与饮食 适当的运动及饮食调整可以减轻非肥胖型NAFLD患者的体质量。随着体质量的减轻,特别是内脏脂肪的减少,会明显改善患者的代谢紊乱,如高脂血症和胰岛素抵抗。有证据[22]表明,适当运动及饮食调整能有效降低患者肝脏的脂肪变性,并且总胆固醇降低10%可作为改善的无创性预测指标。
2.1.2 适度饮酒 早期研究表明,过量饮酒是导致肝脏脂肪变性和肝损伤的原因之一。近年来的研究却发现,饮酒对脂肪肝的发展有双向影响。2015年,Takahashi等[23]研究发现在非肥胖受试者中,大量饮酒组(每天>50 g酒精摄入量)的脂肪肝患病率明显高于少量饮酒组(每天<20 g酒精摄入量)和中度饮酒组(每天20~50 g酒精摄入量);而中度饮酒组患病率低于其他两组。该结果表明,在非肥胖人群中,大量饮酒虽是脂肪肝的一个危险因素,但适度饮酒可能对脂肪肝有预防作用。临床中,对于治疗有习惯性饮酒的非肥胖型NAFLD患者,考虑到这种双向效应是很有必要的。但酒精在胰岛素抵抗和脂肪肝中的作用及作用机制仍存有争议,还有待进一步研究。
2.2 药物治疗
2.2.1 NAFLD常用药物 国内常见的抗脂肪肝辅助类药物包括多烯磷脂酰胆碱、甘草酸制剂、双环醇、熊去氧胆酸、腺苷蛋氨酸、还原型谷胱甘肽、水飞蓟素(宾)及维生素E等[24]。这类药物对细胞膜结构及细胞代谢具有较好的稳定作用,能抵抗肝细胞的坏死,减轻脂肪肝变性,修复损伤的肝细胞,保护肝脏。近年来,国内辅助护肝治疗药物在不断更新,多种机制治疗脂肪肝的联合用药已成为趋势。这类药物同样适用于非肥胖型NAFLD的辅助护肝治疗,但其对于非肥胖型NAFLD的疗效还需要更多的实验探究。
2.2.2 NAFLD新型药物 近期,许多研究发现肠道-肠道微生物-肝轴可能在NAFLD的病因中起着重要作用,并进而发现胆汁酸抑制剂及益生菌能显著改善体质量、循环代谢异常、肝脏炎症和纤维化以及由高脂饮食引起的肠屏障损害,能极大的延缓NAFLD的进程。目前,基于调节胆汁酸的药物,包括法尼醇X受体(FXR)和G蛋白胆汁酸受体(GPBAR)1以及顶端钠依赖性胆汁酸转运蛋白(ASBT)抑制剂。这些药物如奥贝胆酸等均表现出逆转脂肪性肝炎和纤维化的功效[25-26]。而肠道菌群参与人类生理学的许多方面,现已被认为在健康中起着关键作用。基于肠道菌群的药物如益生菌补充剂,有证据[27]表明能改善肝脂肪变性和肝纤维化,且没有发现重大不良反应。肠道菌群改变和脂联素变异性可能是NAFLD进展的驱动力,靶向肠道菌群(例如通过施用益生菌)可能会通过脂联素延迟NAFLD进程[28]。目前虽无在非肥胖型NAFLD中使用胆汁酸抑制剂及益生菌的临床指南,但这些药物对非肥胖型NAFLD确实有着巨大的潜在治疗价值。未来的研究对于评估此类药物在非肥胖型NAFLD患者中的疗效很有必要。
2.2.3 降低胆固醇药物 许瑞华等[29]发现依折麦布能较好地改善肝功能酶学指标、肝脏脂肪变性及调节胆固醇代谢,从而提高非肥胖型NAFLD患者的临床治疗效果。在此之前,Enjoji等[30]回顾8例依折麦布治疗非肥胖型NAFLD患者1年的随访资料发现,虽然脂肪肝的超声检查结果在1年内没有明显改善,但其血清ALT水平在6个月内显著降低,并且4例患者的ALT水平达到正常范围(<30 U/L),同时血清总胆固醇和低密度脂蛋白-胆固醇至少降低了10%。胆固醇吸收抑制剂依折麦布可以改善肝功能障碍,延缓脂肪肝进展,可能为非肥胖型NAFLD提供了一种新的治疗方法。
2.2.4 胰岛素增敏剂 现有的研究[31]已证实在非肥胖2型糖尿病合并NAFLD患者治疗中应用胰岛素增敏剂,可明显改善肝脏组织学及肝功能酶学指标,并且这可能为脂肪肝治疗提供新的方向,进而对肝细胞炎症、坏死和纤维化甚至肝衰竭的发生有重要的预防意义。
2.2.5 奇亚籽 奇亚籽富含α-亚麻酸和酚类物质。近些年来,由于其潜在的药理作用,备受人们关注。Fernández-Martínez等[32]以非肥胖小鼠为动物模型,添加奇亚籽为实验组,添加常规饲料为对照组。结果显示,与对照组相比,实验组小鼠肝脏重量显著减轻。进一步研究发现,长期服用奇亚籽,可预防脂肪性肝炎,并降低实验组小鼠的血脂。该作用可能与α-亚麻酸和酚类物质有关。因此,在非肥胖型NAFLD患者饮食中加入奇亚籽可能会改善肝脏脂肪变性,预防肝硬化或肝癌。
2.2.6 酶替代疗法 LAL是参与脂质代谢的关键酶,负责水解胆固醇酯和甘油三酯。LAL缺乏可表现为脂肪肝、转氨酶水平升高、肝肿大和血脂异常。然而LAL缺乏常常被人们忽略。Burton等[33]应用酶替代疗法治疗3期试验发现,用α-海贝脂酶替代治疗严重LAL缺乏患者20周后,经MRI评估,几乎所有接受治疗的患者其肝脏脂肪含量都显著降低。该结果表明,酶替代疗法可能也适用于LAL缺乏或LAL活性降低的非肥胖型NAFLD患者。对非肥胖型NAFLD患者进行LAL活性检测,针对他们使用LAL替代疗法可能会极大的降低其肝脏脂肪含量。
2.2.7 维生素D 维生素D在调节肝脏脂肪流动方面起着至关重要的作用,较高的维生素D水平对非肥胖型NAFLD有保护作用。曲玉蕾等[34]发现NAFLD患者血清维生素D及骨密度明显低于正常人,对NAFLD并发骨质疏松症进行合理的早期筛查,以提高NAFLD患者的预后及生活质量。在此之前,也有许多研究[35-37]发现,补充维生素D和骨化三醇可显著降低血清ALP和GGT水平,并且延长疗程,增加维生素D剂量可能会取得更积极的结果。因此,维生素D补充剂在一定程度上可降低非肥胖人群NAFLD的患病率,并改善肝脏脂肪病变,提高患者的预后。
2.2.8 人胎盘提取物 人类胎盘提取物富含酶、核酸、维生素、氨基酸、类固醇、脂肪酸和矿物质。其具有多种功能,包括抗炎功能、抗氧化效果和促进肝再生等。早在2015年,Shimokobe等[38]分析了4例完成24周人类胎盘提取物疗程的非肥胖型NAFLD患者转氨酶(AST和ALT)及其肝脏组织学改变情况。发现使用人类胎盘提取物治疗8周后,转氨酶水平明显低于治疗前;12周和24周后,转氨酶活性下降至略低于治疗前水平。然而,当进一步观察这4例患者的肝脏组织学改变时发现,仅1例肝细胞气球消失。虽然人类胎盘提取物治疗对肝组织学影响不大,但血清转氨酶(AST和ALT)水平较治疗前显著降低。人类胎盘提取物治疗仍有望改善患者的转氨酶活性,成为治疗非肥胖型NAFLD的候选药物。
2.2.9 鞣花酸 鞣花酸是一种在浆果和坚果中发现的天然抗氧化剂多酚。近年来,由于其潜在的价值,相比于合成抗氧化剂,备受人们的关注。Polce等[39]以非肥胖自发性2型糖尿病大鼠为实验动物模型研究鞣花酸发现,鞣花酸治疗能减轻肝脏氧化应激以及显著降低空腹血糖和胰岛素抵抗,表现为稳态模型胰岛素抵抗指数(HOMA-IR)降低21.8%。这项研究为口服鞣花酸治疗非肥胖型NAFLD提供了新的见解。鞣花酸可作为饮食补充参与非肥胖型NAFLD合并糖尿病并发症的食物治疗计划中,以减缓肝病的进展。其在临床中具有极大的应用潜力,但仍需要进一步的临床研究。
2.2.10 玉米黄质二棕榈酸酯 玉米黄质二棕榈酸酯是枸杞多糖的重要成分,具有调节免疫和神经内分泌功能。许多研究已经证实枸杞多糖在化学和NAFLD诱导的肝损伤中的肝脏保护特性。Li等[40]通过非肥胖转基因小鼠建立非肥胖NASH模型来研究玉米黄质二棕榈酸酯时发现,对患有NASH的非肥胖转基因小鼠,每周加用玉米黄质二棕榈酸酯灌胃后,能部分抵消血清ALT、AST和ALP改变,并且其肝脏脂肪滴沉积减少,肝纤维化程度明显减轻。此外,还对玉米黄质二棕榈酸酯进行了90 d的安全性评估,发现在非肥胖小鼠中,长期服用玉米黄质二棕榈酸酯没有出现任何不良影响。因此,玉米黄质二棕榈酸酯可以作为一种安全、有前途的肝脏保护剂,并具有极大的潜力替代草药衍生物来治疗非肥胖型NAFLD,以减缓NAFLD进展为NASH造成的肝损伤。
3 非肥胖型NAFLD患者的预后
以往研究认为非肥胖型NAFLD患者预后较好。但Cruz等[41]进行的一项长期(>12年)国际研究发现,尽管非肥胖型NAFLD胰岛素抵抗较少,肝纤维化进展较慢,但其全因死亡率是超重和肥胖患者的2倍(28% vs 14%)。随后,许多研究[42-43]相继发现,尽管非肥胖型NAFLD占NAFLD的比例很小且纤维化程度较低,但发生意外代谢并发症的风险与非瘦型NAFLD相似,长期预后更差,全因死亡率甚至更高。肥胖型和非肥胖型NAFLD均可能逐渐进展为NASH和肝脏晚期纤维化,都应考虑作为药物治疗的潜在人群。目前关于此方面的研究并不多, 仍需进一步的探索。
4 总结与展望
目前,非肥胖型NAFLD患者在NAFLD中占据的比例已不容忽视,但因缺乏肥胖表型故未引起足够的重视。相比于肥胖型NAFLD患者,尽管非肥胖型NAFLD胰岛素抵抗较少,肝纤维化进展较慢,但其发生心血管疾病的风险更大、全因死亡率更高。因此,非肥胖型NAFLD更应早期发现、早期治疗、早期预防。非肥胖型NAFLD的发病机制、病因以及其对心血管系统或肾脏系统的具体影响仍有待进一步的研究。目前针对非肥胖型NAFLD尚无特效的药物治疗,改变生活方式、饮食结构及运动仍然是非肥胖型NAFLD现有的有效治疗方式。
作者贡献声明:李洋洋负责参与收集数据,资料分析,撰写论文,修改论文;谢正元负责拟定写作思路,指导撰写文章并最后定稿。
