甲基苯丙胺亚急性染毒大鼠脑内星形胶质细胞转录组学变化
2021-02-26王涛伍赛群谭晓辉陈传香岳霞王慧君杜思昊乔东访
王涛,伍赛群,谭晓辉,陈传香,岳霞,王慧君,杜思昊,乔东访
1.南方医科大学法医学院,广东 广州 510515;2.广东省公安厅刑事侦查局刑事技术中心,广东 广州510050
甲基苯丙胺(methamphetamine,METH)作为一种合成毒品,近年来在全球多个国家和地区的滥用情况愈发严重。METH出现于20世纪70年代,90年代进入我国,被认为是新型毒品的代表[1-3]。METH 制备工艺较为简单,可抽吸、鼻吸、口服或注射,大量用药后吸食者会出现精神兴奋、性欲增强,容易出现激动、狂躁和暴力行为。长期吸食METH 可产生强烈的依赖感,并造成严重的神经系统损伤[4-5]。通过对吸食METH致死者进行尸体检验发现,METH 可导致大脑多脑区出现损伤,造成神经元变性、坏死,小胶质细胞聚集,星形胶质细胞呈现活化状态[6]。
长期以来,研究者们都较为关注METH 诱导的神经元损伤机制,METH 对中枢神经系统的主要毒性作用为损伤多巴胺能神经元,而神经元的凋亡、自噬和氧化应激反应是造成其损伤的重要机制[6-8]。凋亡是细胞有序死亡的过程,研究[7-8]表明,METH 可引起多种类型细胞发生凋亡。本课题组前期研究[9-10]也揭示了METH 在氧化应激反应中的作用。有研究[11]还发现,METH 引起的内质网应激介导凋亡和自噬的发生,其中Nupr1、caspase-11、胰岛素样生长因子结合蛋白5(insulin-like growth factor binding protein 5,IGFBP5)等分子发挥了重要作用。
本课题组前期建立了METH 染毒C57 小鼠模型及体外原代培养星形胶质细胞模型,发现METH 也可导致星形胶质细胞相关的促炎因子表达上调及一系列炎症通路的激活[9]。前期研究发现,经METH 处理后,原代培养的星形胶质细胞中促炎因子白细胞介素-1β(interleukin-1β,IL-1β)和IL-18的表达上调[6,12],还发现了脂质运载蛋白2(lipocalin 2,LCN2)在介导神经炎症中的重要作用[13]。METH 还可导致体内星形胶质细胞的激活,中脑和纹状体脑区的星形胶质细胞呈现胞体增大、突起增多等变化[6,12]。前期研究[9-10]通过METH 体内外给药证明了METH 对星形胶质细胞的影响及炎症通路激活的机制,然而上述研究都基于体外细胞实验或在动物的整体水平进行探讨,仅关注于星形胶质细胞炎症反应方面,无法阐明体内环境下星形胶质细胞发生的改变,亦难以说明细胞状态的变化。星形胶质细胞作为中枢神经系统的关键支撑细胞,对调控METH 神经毒性的具体作用仍有待进一步阐明。
本研究拟建立大鼠METH 亚急性中毒模型,探究METH 在转录水平对星形胶质细胞的影响,以期为METH 的神经毒性研究提供更多思路,为METH 吸毒死亡的鉴定提供借鉴。
1 材料与方法
1.1 主要试剂与仪器
METH(纯度≥90%,中国药品生物制品检定所),磷酸盐缓冲液(phosphate buffer saline,PBS;美国Thermo Fisher Scientific 公司),RIPA 裂解液(10×,德国Merck 公司),磷酸酶抑制剂(美国Sigma 公司),RNAiso Plus(总RNA 提取试剂,日本TaKaRa 公司),Anti-GLAST(ACSA-1)MicroBead 试剂盒(德国Miltenyi Biotec 公司)。
NanoDrop 2000c 分光光度计(美国Thermo Fisher Scientific 公司),2100 生物分析仪(美国Agilent公司),NovaSeq 6000 测序系统(美国Illumina 公司)。
1.2 动物实验与样品收集
健康成年雄性SD 大鼠6 只,6~8 周龄,体质量180~220 g,购自南方医科大学实验动物中心。动物实验操作程序遵循美国国立卫生研究院实验动物护理和使用指南。本研究严格遵守南方医科大学生物医学伦理委员会的规范进行。
METH 染毒实验前将大鼠置于恒温(22 ℃)、12 h光/暗循环的房间1 周,使大鼠适应环境条件。随机将大鼠分为2 组(每组3 只),分别为METH 亚急性中毒组(简称METH 组)和生理盐水对照组(简称对照组)。其中METH 组依据文献[12-13]给大鼠每12 h 腹腔注射(15 mg/kg)METH 1 次,共注射8 次;对照组大鼠在相同时间腹腔注射1 mL 生理盐水。两组均于最后1 次注射后24 h 将大鼠颈椎脱臼处死,迅速分离大脑,在预冷的玻璃板上分离纹状体脑区。
星形胶质细胞磁珠分选采用Anti-GLAST Micro-Bead 试剂盒。参照试剂盒说明书进行抗体孵育及磁珠分选。分选过程中注意保持低温,将分选出的阳性星形胶质细胞放入新的离心管中。分选出的星形胶质细胞纯度均大于95%,可用于后续RNA 提取与分析。
1.3 mRNA 提取及质量控制
提取出的星形胶质细胞每管加入500 μL RNAiso Plus,充分裂解后加入200 μL三氯甲烷,4 ℃下12 000×g离心10 min,取上层水相转移至新的RNase-free 离心管中,加入等体积异丙醇,4 ℃下12 000×g离心10 min,弃去上清液。加入1 mL 75%乙醇溶液重悬沉淀,再次4 ℃下12 000×g离心10 min,弃去上清液,室温干燥10 min 后,加入20 μL 无RNA 酶ddH2O,充分溶解RNA。利用NanoDrop 2000c 分光光度计检测RNA 浓度、纯度,琼脂糖凝胶电泳检测RNA 完整性,2100 生物分析仪测定RNA 完整性指数(RNA integrity number,RIN)。单次建库要求RNA 总量≥1 μg、质量浓度≥35 ng/μL、D260/D280≥1.8、D260/D230≥1.0[14]。
1.4 转录组学测序及生物信息学分析
对RNA 定量后,确定文库构建所加入的总RNA量,建库后进行桥式扩增。采用NovaSeq 6000 测序系统完成mRNA 转录组学测序,对测序结果进行质量控制(简称“质控”),其中错误率(%)表示质控数据对应的测序碱基的平均错误率,应在0.1%以下;Q20(%)、Q30(%)代表对质控后测序数据的质量评估,Q20、Q30 分别指测序质量在99%和99.9%以上的碱基占总碱基的百分比,Q20 应在85%以上,Q30 应在80%以上[14]。本次测序Q20 全部大于98%,Q30 全部大于94%,说明本次测序样本质控较好。收集产出的数据后,依次进行数据去杂、转录组拼接、SNP 分析、基因功能注释、基因表达差异分析、差异基因表达模式聚类、差异表达基因富集分析。
1.4.1 样本相关性分析
按照基因表达的差异倍数>1 且P<0.05、q<0.05的原则筛选差异表达基因[14],基于表达矩阵进行样本相关性分析、主成分分析(principal component analysis,PCA)[14]。样本相关性分析有助于理解样本间的相关性,验证实验设计的合理性。而PCA 有助于降低数据的复杂性,深入挖掘样本之间的关系和变异。样本通过降维分析后,在主成分上有相对坐标点,各个样本点的距离代表了样本的距离。
1.4.2 表达量差异分析
获得基因的reads 数后,使用R 软件中的DESeq2软件包进行组间差异表达基因分析,获得两组间具有差异表达的基因。表达量差异分析的筛选阈值为|log2FC|≥1及P<0.05,其中FC为差异倍数(fold change,FC)。对差异表达基因制作火山图。
1.4.3 差异表达基因GO 分析和KEGG 通路富集分析
对筛选得到的差异表达基因利用基因本体(gene ontology,GO)数据库(http://geneontology.org/)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG;https://www.kegg.jp/)进行GO 分析和KEGG 通路富集分析。对METH 组和对照组上调及下调基因进行GO 分析,鉴于差异表达基因数目较多,本研究从细胞结构、生物学过程及分子功能3 个类别中选取富集最显著的20 个GO 分析条目绘制柱状图。
1.4.4 挖掘部分通路的差异表达基因
通过GO 分析和KEGG 通路富集分析,对差异表达的通路进行筛选,通过分析原始数据,挖掘通路中的差异表达基因。
1.5 统计学分析
运用SPSS 21.0 软件(美国IBM 公司)进行统计学分析,实验数据以表示,两组间比较采用t检验,检验水准α=0.05。
2 结果
2.1 动物中毒后表现
对照组大鼠实验期间状态良好。METH 组大鼠出现摇头、易激惹、自发转圈等刻板运动,行为异常持续至末次注射METH 后4 h,随后出现倦怠、活动减少等表现。
2.2 转录组学质控结果
表1 展示了每个样本的序列数目和质控后的数据,本次测序的错误率均小于0.025%。
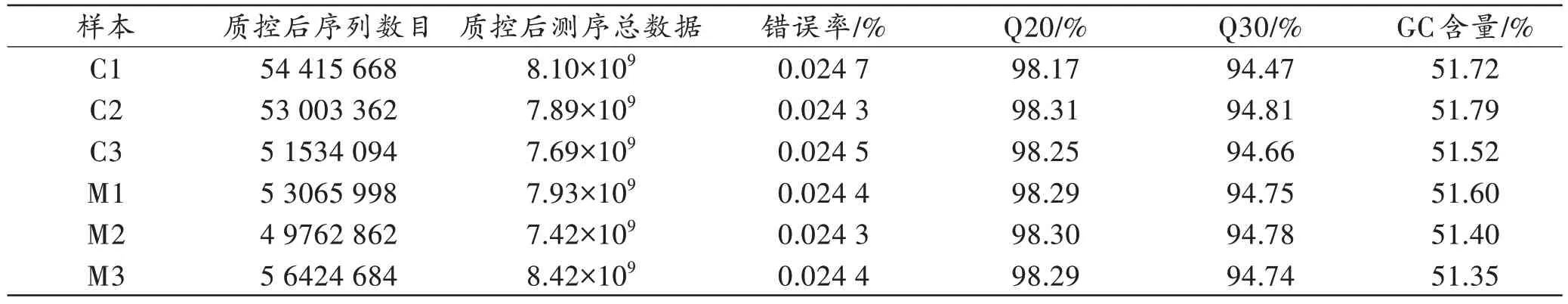
表1 测序数据统计Tab.1 Sequencing data statistics
2.3 样本间关系分析
测序相关性分析结果显示,对照组及METH 组中的样本相关性较好(图1)。PCA 分析表明两组内样本间相似性较高(图2),对照组和METH 组样本的组间差异大。
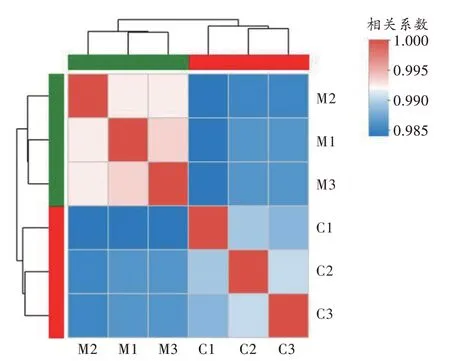
图1 相关性分析结果Fig.1 Results of correlation analysis
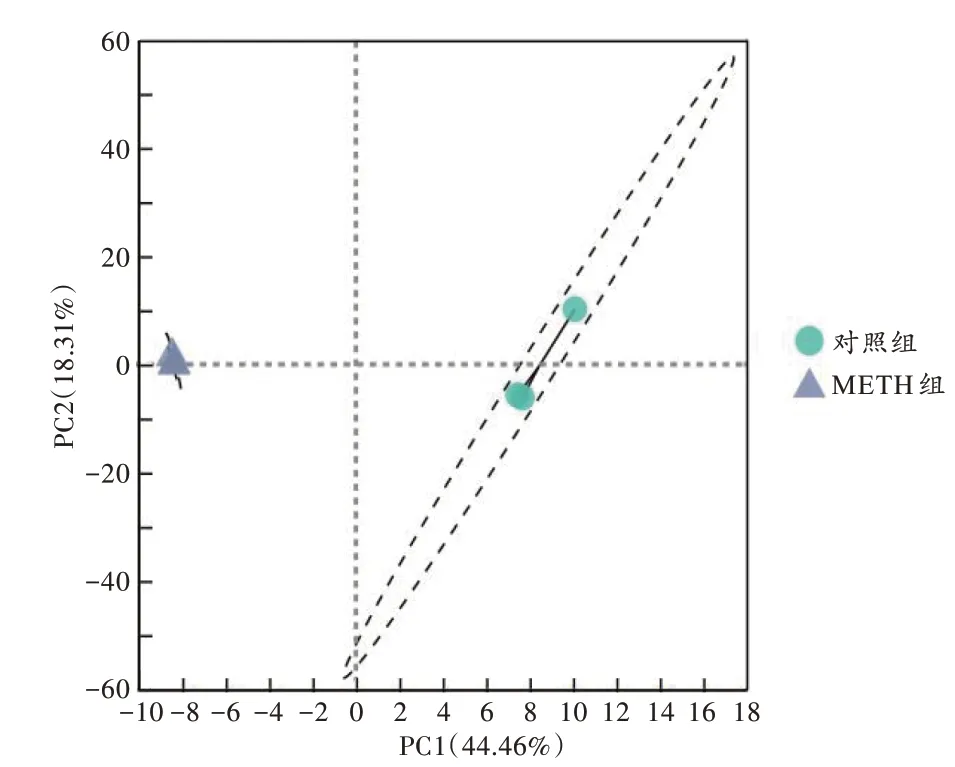
图2 PCA 结果Fig.2 Results of PCA
2.4 表达量差异分析
通过表达量差异分析,共筛选出876 个差异表达基因,其中上调基因321 个,下调基因555 个(图3)。
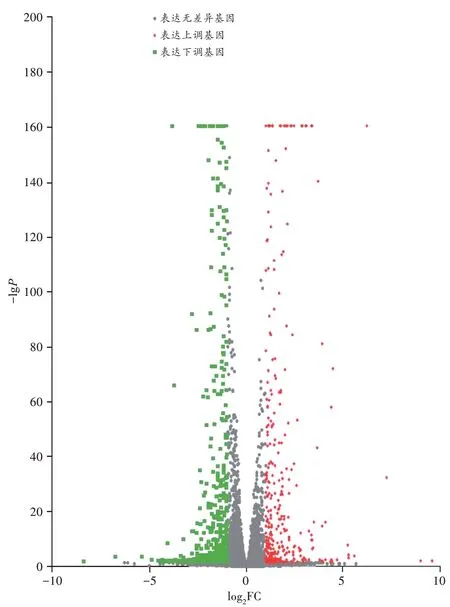
图3 差异表达基因火山图Fig.3 Volcano map of differential expressed gene
2.5 差异表达基因GO 分析
对METH 组和对照组的上调及下调基因进行GO分析。由图4可见,生物学过程富集的基因变化最强,其次是细胞结构,最后是分子功能。在生物学过程类别中,主要变化的有细胞过程、生物调节、代谢过程、发育过程、应激反应、细胞组分或合成、细胞定位、多细胞组织学过程、生物黏附功能;在细胞结构类别中,主要变化的是细胞组分、细胞器、生物膜结构、细胞外基质部分、蛋白复合物及细胞连接;在分子功能中,主要变化的是锚定结合、催化活性、分子功能调节。
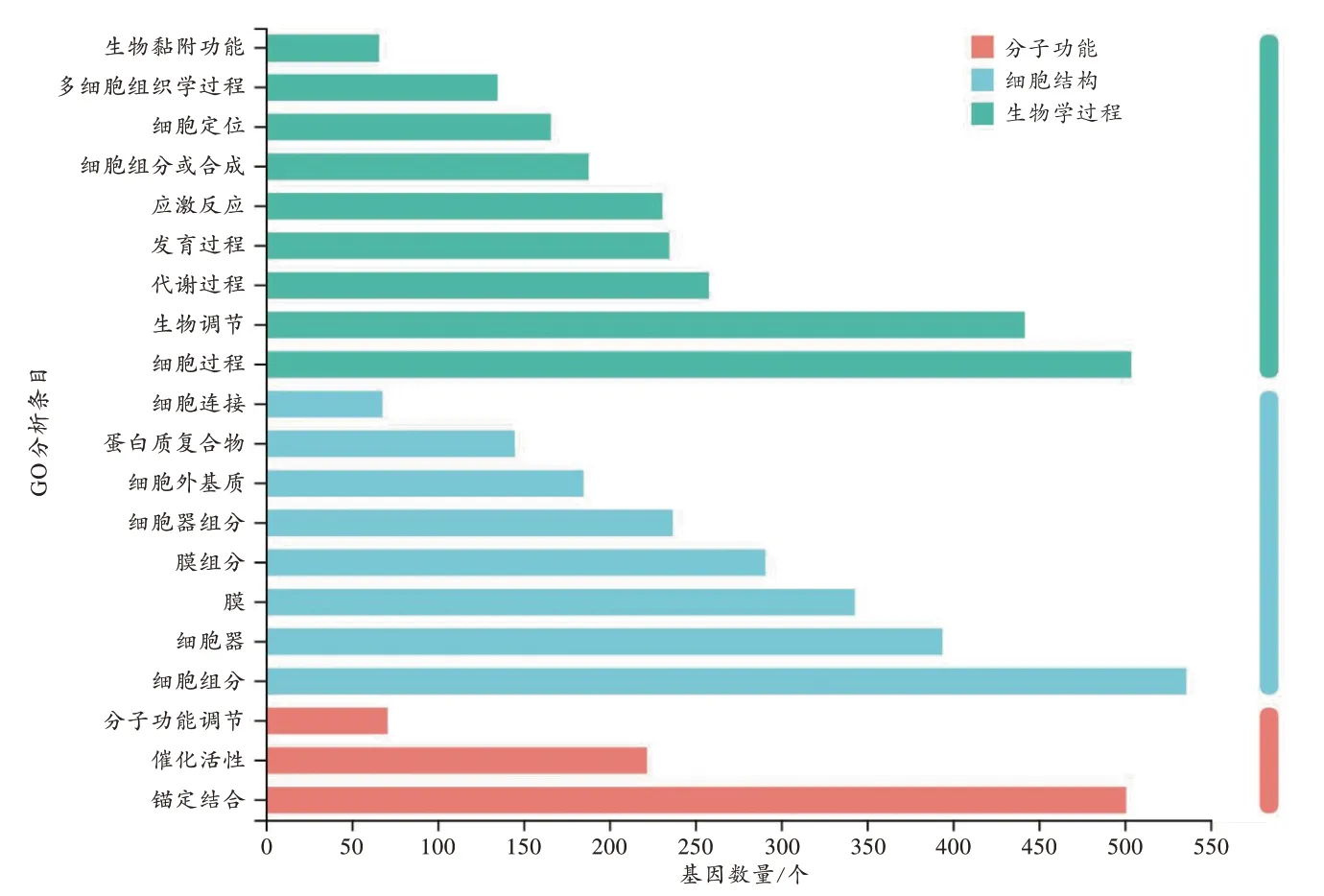
图4 差异表达基因GO 分析结果Fig.4 GO analysis result of differentially expressed genes
2.6 差异表达基因KEGG 通路富集分析
对差异表达基因进行KEGG 通路富集分析,以变化最显著的20 个通路绘制散点图(图5)。其中涉及的信号通路包括类固醇生物合成、脂肪酸生物合成、萜类骨架生物合成、过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor,PPAR)信号通路、单磷酸腺苷依赖性蛋白激酶(adenosine 5’-monophosphate-activated protein kinase,AMPK)信号通路、酮体的合成与降解、不饱和脂肪酸的生物合成等。
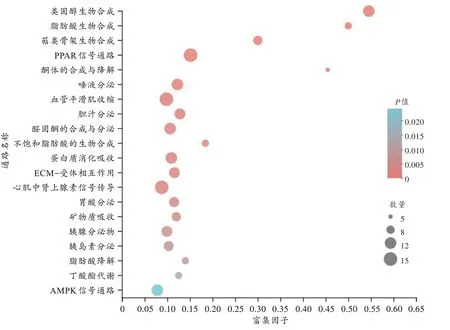
图5 KEGG 通路富集分析结果Fig.5 Enrichment analysis result of KEGG pathway
2.7 部分差异表达基因的挖掘分析
对萜类骨架生物合成、PPAR 信号通路等通路过程的差异表达基因进一步挖掘,其中表达呈显著下调的基因有Acsbg1、Cpt1a,而显著上调的基因有Gdf15、Scd、Scd2、Acsl家族及Fabp家族(P<0.05,表2)。
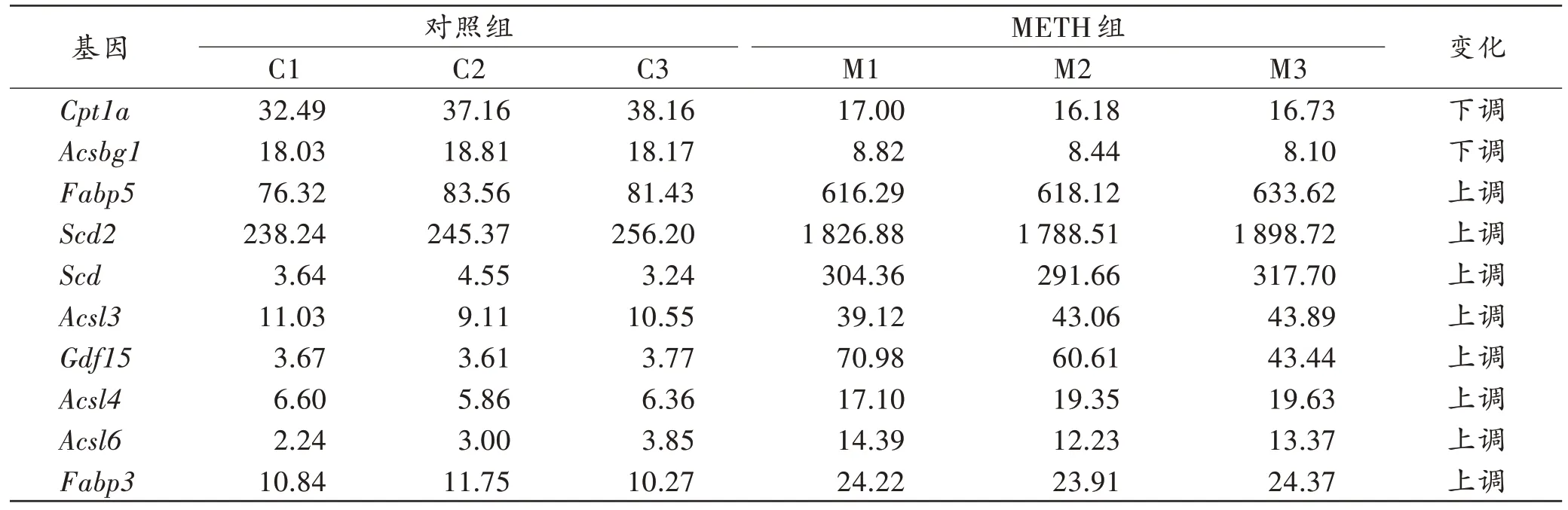
表2 表达上调和下调的基因的相对表达量Tab.2 Relative expressions of up-regulated and down-regulated genes
3 讨论
长期以来,国内外METH 神经毒性研究者主要关注神经元的损伤及变化,忽视了星形胶质细胞及小胶质细胞在中枢神经系统整体微环境中的作用。基于此,本研究探讨了METH 染毒大鼠纹状体内星形胶质细胞的mRNA 转录组学变化。通过对大鼠进行METH亚急性处理,联合生理盐水处理的对照组,用免疫磁珠分选得到纹状体脑区内的星形胶质细胞,对纯化后的星形胶质细胞进行mRNA 转录组学分析,筛选出876 个差异表达基因,其中上调基因有321 个,下调基因有555 个。通过PCA 及样本相关性分析,发现对照组和METH 组样本的组间差异大,同时两组内样本间相似性较高。
GO 分析是基于GO 数据库,把基因的功能分成细胞结构、分子功能和生物学过程3 个部分。本研究利用GO 数据库,得到了目标基因在细胞结构、分子功能和生物学过程3 个层面上主要关联的生物学功能。GO 分析结果显示,生物学过程富集的基因变化最强,其次是细胞结构,最后是分子功能。在生物学过程类别中,主要变化的有细胞过程、生物调节、代谢过程、发育过程、应激反应等;在细胞结构类别中,主要变化的是细胞组分、细胞器、生物膜结构等;在分子功能类别中,主要变化的是锚定结合、催化活性、分子功能调节。上述结果表明,METH 对大鼠脑内星形胶质细胞的作用主要表现在细胞的结构、生物学过程、细胞外及细胞器的功能等方面。
KEGG 数据库是通路相关数据库的一种,是了解高级功能和生物系统的数据库资源。本研究KEGG通路富集分析结果显示,涉及的信号通路包括类固醇、脂肪酸、萜类骨架的生物合成,PPAR、AMPK 信号通路,酮体、不饱和脂肪酸的生物合成等。KEGG 和GO分析都提示METH 处理会导致星形胶质细胞结构异常(如萜类骨架生物合成),类固醇、PPAR 信号通路的富集也与细胞代谢、生物过程、细胞结构等相关,表明METH 可能通过对星形胶质细胞结构和功能的影响,诱导星形胶质细胞的激活。
萜类骨架生物合成、PPAR 信号通路等通路过程的差异表达基因挖掘结果显示,表达呈显著上调的基因有Scd、Scd2、Acsl家族及Fabp家族,而显著下调的基因有Acsbg1、Cpt1a。这些分子不仅与细胞过程、细胞组分高度相关,也是脂肪酸代谢、降解和生物学合成的重要组成部分。萜类骨架生物合成、PPAR 信号通路也可能是METH 对星形胶质细胞影响的重要机制之一。此外,还发现Gdf15显著上调,Gdf15在细胞因子-细胞因子受体相互作用中发挥重要作用。有研究[15-16]发现,Gdf15可以激活星形胶质细胞,促进CXC趋化因子配体3(CXC chemokine ligand 3,CXCL3)、IL-8 等细胞因子的显著上调,Gdf15促进星形胶质细胞重构及血脑屏障的紧密连接增强,小鼠海马兴奋性损伤后,星形胶质细胞Gdf15的表达显著增加。说明Gdf15在METH 诱导星形胶质细胞激活和神经毒性中也可能具有重要作用。
本课题组前期对METH 神经毒性作用中星形胶质细胞的功能进行了深入研究[11-12],星形胶质细胞是中枢神经系统中数量最多的神经胶质细胞,具有多种功能,在支持中枢神经系统和保护神经元等方面发挥了重要的作用。生理条件下,星形胶质细胞具有支持和隔离神经网络、摄取和灭活神经递质、调节离子浓度、传递第二信使、营养修复、诱导神经干细胞再生、抗氧化以及参与学习记忆等功能。病理条件下,星形胶质细胞从静息状态快速向活化状态转变,对各种损害因素产生强烈反应,其活化具有瀑布效应,活化的星形胶质细胞对神经组织发挥着保护和毒性损伤的“双刃剑”效应[17]。前期研究[18]结果表明,METH 染毒的小鼠纹状体脑区出现星形胶质细胞胞体增大、突起增多等形态学表现。纹状体包括背侧纹状体及腹侧纹状体:背侧纹状体是大脑中被认为在决策、动机和奖赏方面起重要作用的部分,由豆状核和尾状核两个亚区组成;腹侧纹状体由伏隔核和嗅结节构成,参与运动和情绪反应,尤其是与快乐和行为动机有关。本研究提取了整个纹状体脑区的星形胶质细胞,发现一系列与细胞结构、功能有关的通路变化,提示星形胶质细胞可能参与METH 对纹状体的毒性作用。未来还可分别对腹侧纹状体和背侧纹状体的功能行进一步探讨,以说明星形胶质细胞在不同脑区中的作用机制。
本研究对METH 染毒大鼠纹状体中的星形胶质细胞进行了转录组学测序,共筛选出差异表达基因876 个,其中上调基因321 个,下调基因555 个。从体内直接分选出星形胶质细胞相较于体外培养的细胞学研究,有助于阐明星形胶质细胞在METH 诱导的神经毒性中的作用及机制,排除了体外实验多因素的干扰,更贴近脑内星形胶质细胞的状态。通过对差异表达基因的生物信息学分析,富集出多条信号通路,部分阐明了METH 对星形胶质细胞结构、功能的影响及分子机制。差异表达基因还提示了PPAR 信号通路相关分子、Gdf15等的可能作用机制,这有待后续深入研究。本研究通过转录组学分析METH 对星形胶质细胞的作用及机制,可为METH 相关死亡的法医学鉴定提供新的思路。
