早产儿李斯特菌败血症临床特征及治疗分析
2021-02-11徐利晓
余 剑,潘 涛,徐利晓,冯 星,孙 斌
(苏州大学附属儿童医院,江苏 苏州 215000)
单核细胞增生性李斯特菌(listeria monocytogenes,LM)是一种胞内寄生的革兰阳性无芽孢短小杆菌,属于食物致病菌,其死亡率是食源性疾病中最高的[1]。人类食用了被LM污染的食物后通常会出现发热、流感样症状及腹痛呕吐腹泻等症状,严重时可出现败血症、脑膜炎和自发性流产等。受影响的主要是老人、孕妇及免疫功能低下的患者,新生儿感染的主要方式是母亲垂直传播。南非的一项流行病学调查发现,在实验室确诊的病例中41%是≤28天的新生儿,其中96%在生后一周发病,死亡率28%[2-3]。2004—2009年在美国报告的760例李斯特菌病病例中,17%与怀孕有关,围产期死亡率(胎儿死亡和新生儿死亡)总体率为29%[4]。由于早产儿李斯特菌感染病例数报道较少,本文对14例早产儿李斯特菌败血症的临床资料进行回顾性分析,进一步丰富早产儿李斯特菌败血症的诊治经验。
1资料与方法
1.1临床资料收集
采用回顾性研究的方法,收集2011年1月至2020年10月苏州大学附属儿童医院新生儿科血培养为LM的14例早产儿的临床资料,回顾性分析患儿母亲孕期病史、围产期高危因素、临床特点、实验室检查、抗生素治疗及转归。该研究通过苏州大学附属儿童医院伦理委员会批准并豁免知情同意,伦理号(2020CS090号)。
1.2血培养标本采集及细菌培养
患儿均在入院时严格消毒后经外周静脉采集≥1.0mL血液标本,注入血培养瓶中,于60min内将标本送检。血液标本采用专用微生物培养仪进行培养,在12~48h内有菌株生长则会收到报警,如无菌株生长则培养延长至5~7天。分离菌株采用专用微生物鉴定系统进行菌株鉴定。
1.3统计学方法
采用SPSS 18.0软件进行数据处理。计数资料采用例数(n)和百分数(%)表示,不符合正态分布的计量资料以中位数(P25~P75)表示。以P<0.05为差异有统计学意义。
2结果
2.1母孕期情况
14例产妇的中位年龄为29.5岁(26.75~32.75岁),初产妇3例(21.42%),经产妇11例(78.57%)。13例(92.86%)产妇有临床表现,其中7例(50%)出现产前发热,3例(21.42%)出现流感样症状,6例(42.85%)伴有不规则腹痛,4例(28.57%)阴道出血或流液,3例(21.42%)胎膜早破,4例(28.57%)出现胎心异常。
2.2发病季节分布
相关的LM败血症病例如图1所示,发生在春季和夏季(即3—8月)较多,占总发病例数的92.86%(13/14)。

注:春季(3—5月)、夏季(6—8月)、秋季(9—11月)、冬季(12月至次年2月)。图1 14例早产儿LM败血症病例数的季节分布Fig.1 Seasonal distribution of 14 premature infants with LM septicemia
2.3一般情况及围产期高危因素
14例确诊LM败血症的早产儿中,男性9例,女性5例,男女比为1.8∶1。胎龄中位数为32.4周(30.4~34.1周),入院年龄中位数为5h(2~14.5h),出生体质量中位数为1 885g(1 513~2 188g)。剖宫产7例(50%),自然分娩7例(50%);有宫内窘迫12例(85.71%),发生窒息12例(85.71%),胎膜早破2例(14.29%),羊水污染11例(78.57%),见表1。
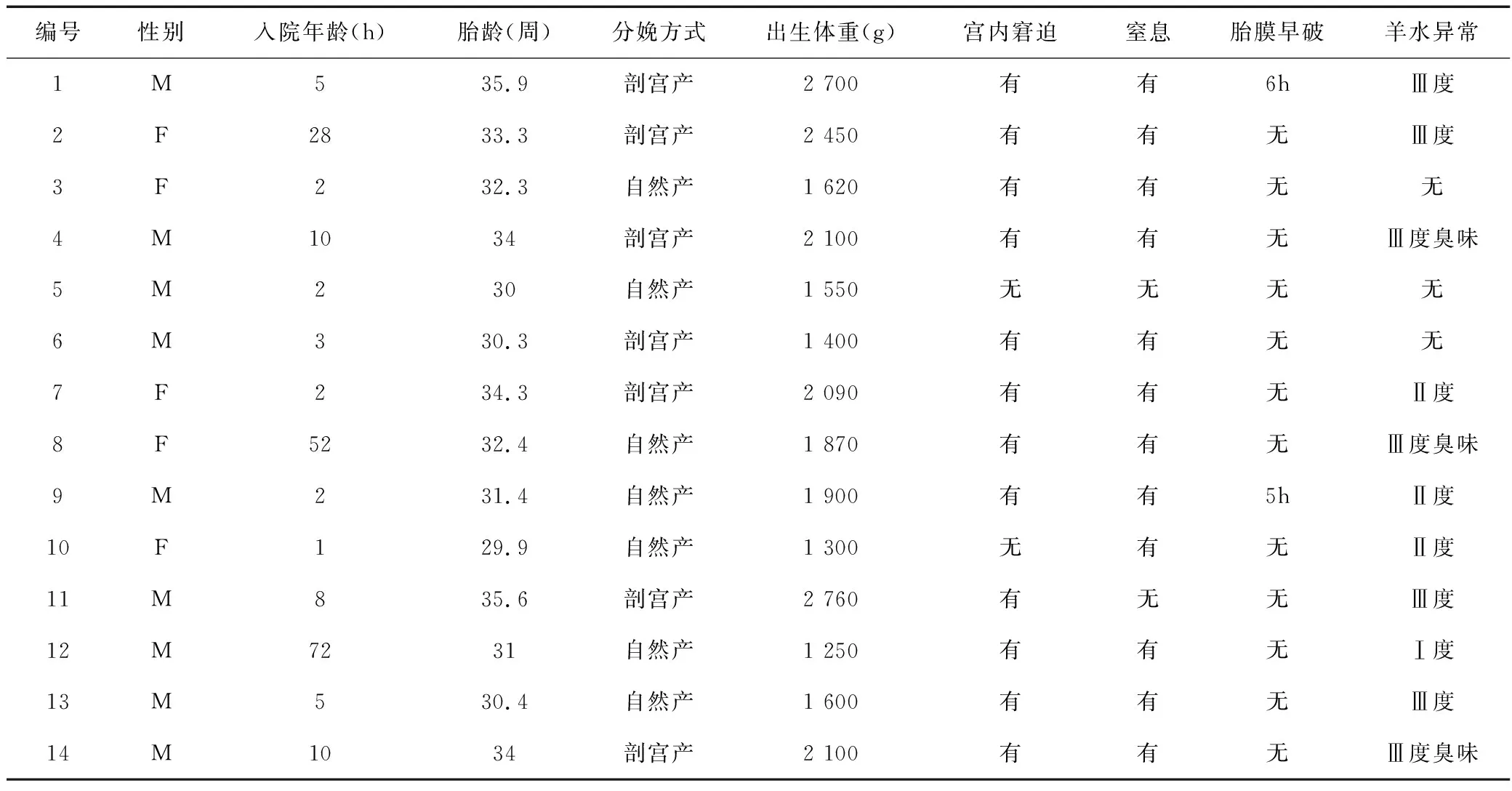
表1 14例早产儿LM败血症患儿的一般情况及围产期高危因素Table 1 General information and perinatal risk factors of 14 premature infants with LM septicemia
2.4临床表现及并发症
14例确诊LM败血症早产儿中,13例(92.86%)出现气促呻吟,11例(78.57%)出现发热或体温不升,2例(14.29%)出现抽搐,2例(14.29%)出现腹胀,6例(42.86%)出现黄疸,8例(57.14%)出现出血点或红色斑丘疹。14例患儿血培养均提示LM生长,血培养报警时间中位数16.5h(12.42~18.32h),9例进行了脑脊液检查,6例(42.86%)脑脊液符合细菌性脑膜炎改变,1例脑脊液培养提示LM生长,5例因病情危重未行脑脊液检查。13例(92.86%)患儿的胸片均有不同程度的肺部炎症表现,其中6例(42.86%)出现呼吸窘迫综合症、7例(50%)感染性休克、3例(21.43%)出现肺出血、2例(14.29%)新生儿硬肿症;6例(42.86%)颅内出血,其中4例头颅磁共振发现存在颅内出血,2例行头颅B超检查发现脑室内大量出血;肝功能谷丙转氨酶升高2例(14.29%);缺血缺氧性脑病2例(14.29%),见图2。

图2 14例早产儿李斯特败血症的并发症情况Fig.2 Complications of 14 premature infants with LM septicemia
2.5辅助检查
14例早产患儿中血常规白细胞计数(2.12~126)×109/L,7例(50%)明显升高>25×109/L,2例(14.29%)明显降低<5×109/L,8例(57.14%)血小板减少,最低为14×109/L。13例患儿行C反应蛋白(C-reactive protein,CRP)检测,其中12例(92.31%)CRP≥8mg/L,最高为231mg/L。9例患儿行降钙素原(procalcitonin,PCT)检测,均>2ng/mL,最高者>62.35ng/mL。9例行脑脊液检查,其中5例(55.56%)脑脊液白细胞升高,葡萄糖降低,1例(11.11%)脑脊液常规及生化正常,但脑脊液培养为阳性。
2.6抗生素使用情况及转归
14例患儿标本采集后均经验性抗感染治疗,血培养结果出来后更换抗生素,救治成功的7例(50%)患儿,其中6例使用美罗培南联合阿莫西林舒巴坦或美洛西林,1例美罗培南联合万古霉素。电话随访患儿,其中4例预后良好,1例存在生长发育落后的后遗症,2例失访。死亡的7例患儿,其中3例单用头孢菌素类药物治疗,1例用美罗培南联合阿莫西林舒巴坦,1例用美罗培南联合头孢哌酮舒巴坦,1例单用美罗培南,1例用万古霉素联合美洛西林,见表2。
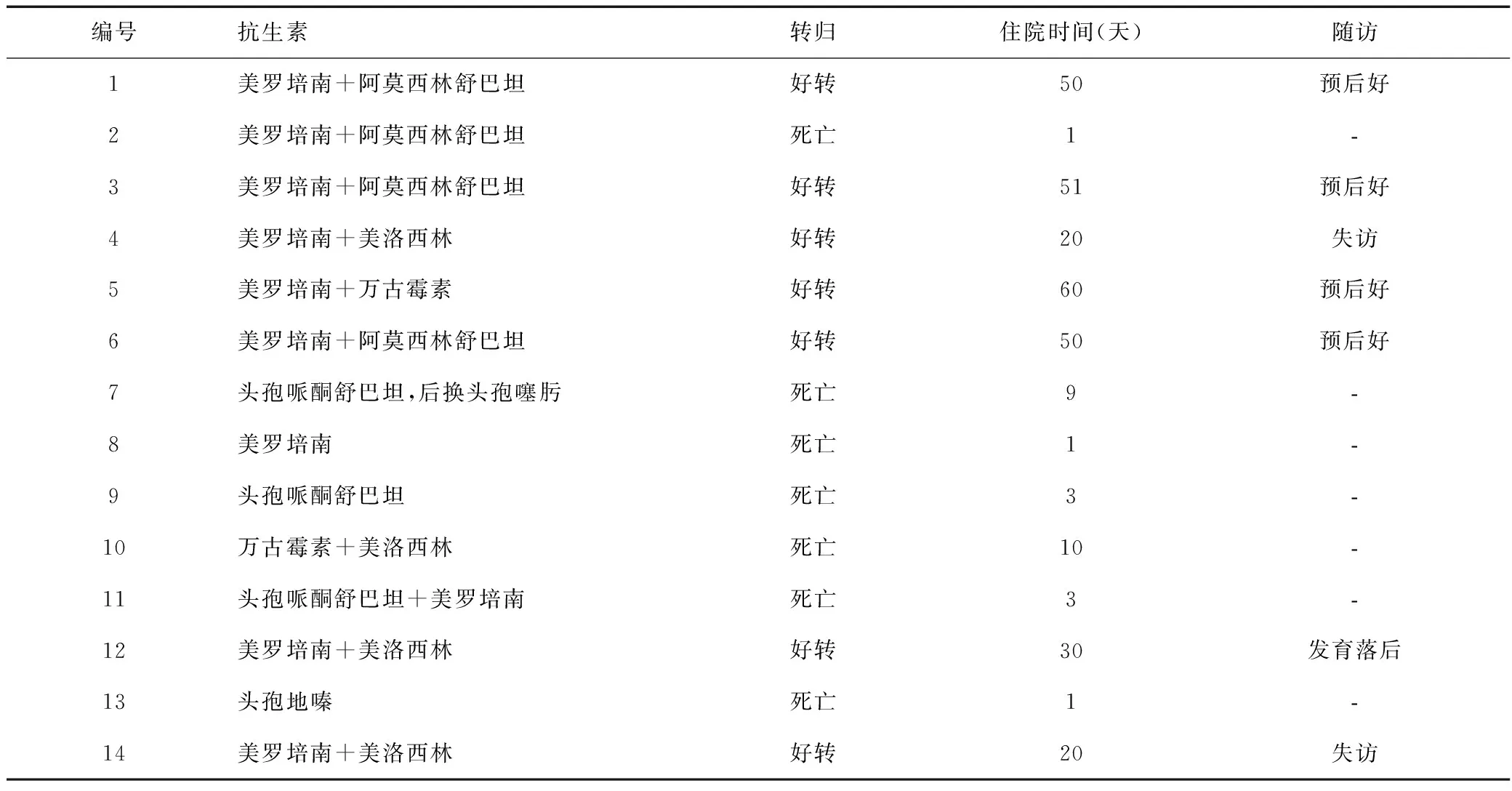
表2 14例早产儿LM败血症患儿的抗生素使用情况及转归Table 2 Antibiotic use and outcome of 14 premature infants with LM septicemia
3讨论
3.1发病季节分布
李斯特菌广泛分布于自然界中,为兼性厌氧菌,属于革兰阳性杆菌,该菌耐冷不耐热,可以污染奶制品类、肉类、蔬菜水果等,在冰箱内可长期生存[5]。人类通常食用被污染的食物后而感染,与怀孕相关的李斯特菌病的发病率大约是普通人群的13倍,新生儿的感染途径主要是感染的母亲通过胎盘垂直传播[6-7]。本研究发现LM感染发生在春季和夏季(即3—8月)较多,占总发病例数的92.86%(13/14例),分析原因可能与气候炎热导致孕妇食用容易被LM污染的未熟食物或冷藏食物等有关。本组病例中初产妇11例(78.57%),初产妇3例(21.42%),有2例产妇提及产前食用冷藏食品史,原因可能是大部分孕妇未意识到食用不洁或冷冻食物所带来的风险。因此,应加强对妊娠期妇女的饮食宣教,建议孕妇避免食用李斯特菌污染风险高的食物,如水果蔬菜要在自来水中彻底的清洗,对于肉类熟食等食品需要加热至74℃,奶制品要经过巴氏消毒等[8]。
3.2母孕期情况及围产期高危因素
产妇感染可能是无症状的,当有症状时,感染通常表现为一种非特异性的流感样症状,伴有发热、肌肉痛、背痛和头痛,通常在出现腹泻或其他胃肠道症状之前[9]。然而,胎儿和新生儿感染可能是严重的,导致死胎、早产、新生儿败血症、脑膜炎和死亡。对11例李斯特菌病孕妇的病例和对222例文献的回顾发现,大约1/5的孕妇并发李斯特菌病导致自然流产或死产;大约2/3存活的婴儿发展为新生儿李斯特菌病[10-11]。早产儿LM败血症多为宫内感染,早发性败血症,发病时间早[12],本组病例早产儿胎龄中位数为32.4周(30.4~34.1周),入院年龄中位数为5h(2~14.5h),出生体重中位数为1 885g(1 513~2 188g)。有13例(92.86%)产妇有临床表现,产妇有7例(50%)出现生产前发热,3例(21.42%)出现流感样症状,6例(42.85%)伴有腹痛。围产期出现宫内窘迫12例(85.7%),发生窒息12例(85.71%),羊水污染11例(78.57%),与其他文献报道一致[13]。对于产妇孕期出现发热、流感样症状、胎儿宫内窘迫、分娩时羊水有污染或者臭味等高危因素者,分娩时及时行血培养,羊水和胎盘组织培养,并尽早开始抗生素治疗。
3.3患儿临床表现、并发症及治疗效果
14例确诊LM败血症的早产儿中,临床表现主要为呼吸窘迫,发热或体温不升,皮肤出现出血点或典型红色斑丘疹。实验室检查有7例白细胞明显升高,2例明显降低,8例血小板减少,最低为14×109/L,白细胞、血小板越低,可能提示病情越重;12例CRP≥8mg/L,最高者231mg/L,9例患儿行PCT检测,均>2ng/mL,最高者>62.35ng/mL,CRP、PCT值的高低可反映感染的严重程度。白细胞、血小板、CRP、PCT的数值有助于判断患儿感染的严重程度,而且监测其动态变化可评估抗感染的效果。本组病例中化脓性脑膜炎的发生率为42.86%,5例因病情严重未行脑脊液检查,因此不能体现早产儿李斯特菌败血症中化脓性脑膜炎真实的发生率。9例行脑脊液检查,其中5例脑脊液呈化脓性脑膜炎样改变,1例脑脊液常规及生化检查正常,但脑脊液培养为阳性,考虑原因是行脑脊液检查的时机早,颅内尚未产生炎症反应。死亡的7个病例中有5例在入院后3天内病情迅速进展,出现感染性休克、弥散性血管内凝血、肺出血导致死亡,其中病例2、病例3、病例13的入院年龄分别是出生28h、52h、5h,入院时已经出现感染性休克,并在数小时内迅速进展并死亡;病例9和病例11虽已得到血培养结果报警,由于药敏结果未出,临床医生未意识到早产儿LM败血症的临床特点,未及时更改有效抗生素,这两例患儿在入院3天内因治疗效果差并发弥散性血管内凝血、肺出血导致死亡;病例7由于未更换有效抗生素,治疗效果差,病例10虽然更换万古霉素+美洛西林治疗,由于其胎龄小,体重低,治疗效果不佳,这两例并发脑膜炎和严重的颅内出血,家属考虑预后不良,在生后第10天左右放弃治疗后死亡。病例12虽然救治成功,但因其为31周1 250g的早产儿,入院年龄已72h,并发化脓性脑膜炎,在后期的随访中该患儿存在生长发育及智力发育落后。本研究中的死亡率为50%,远高于文献报道李斯特菌感染围产期死亡率29%[4],可能由于本研究病例数少,且仅以早产儿为研究对象,并未纳入足月儿及晚发性LM败血症患儿。早产儿LM败血症临床症状不典型,难以早期识别,并且容易迅速进展为感染性休克,救治存活也容易合并细菌性脑膜炎和颅内出血,可留下不同程度的后遗症。因此对于不明原因早产、出生时窒息,生后不久即出现呼吸窘迫、发热、全身皮疹等症状的早产儿,需进一步询问产前母亲发热或上呼吸道感染病史,临床高度怀疑LM感染,应及时行血液相关指标及病原学检查,尽快应用能覆盖LM的抗生素。
本研究中,14例早产儿血培养均为阳性,血培养报警时间中位数16.5h(12.42~18.32h),其中9例根据血培养危急值回报,及时调整抗生素为美罗培南联合青霉素类或者万古霉素联合青霉素类,救治成功7例,3例单用头孢菌素类药物感染均未得到有效控制。目前LM感染抗生素首选青霉素或氨苄西林[14],而我们临床上对于早产儿感染非特异性临床症状经常经验性选用头孢菌素类抗生素,但LM对此天然耐药[15]。因此,对于高度怀疑LM感染的早产儿应尽早使用青霉素或氨苄西林,严重病例应早期使用碳青霉烯类及万古霉素,并考虑联合用药。2016年欧洲临床微生物和感染病学会在指南[16]中提出美罗培南可作为LM脑膜炎的替代治疗。一些研究也尝试抗菌药物的联合应用,特别是针对LM脑膜炎的重症患者,可以使用氨苄西林联合美罗培南治疗[17]。
综上所述,早产儿LM败血症多为早发性败血症,发病时间早,病情进展快,并发症多,合并细菌性脑膜炎的发生率高,致死致残率高。早产儿LM败血症的治疗效果取决于医务人员是否能早期识别并选用合适的抗菌药物、有效抗生素治疗是否及时、患儿胎龄、出生体质量等。治疗上首选青霉素或氨苄西林,对于严重病例或合并化脓性脑膜炎时,可考虑联合美罗培南治疗。总之,产科、儿科医师应了解LM感染的特点,早诊断并尽早给予有效抗生素治疗,降低LM感染患儿的并发症及死亡率。
