冷冻诱导对大豆分离蛋白结构和聚集行为的影响
2021-02-07荣荟汤辉煌赵娅柔吕文郑志强李泽昊汪建明
荣荟,汤辉煌,赵娅柔,吕文,郑志强,李泽昊,汪建明*
(1.天津科技大学食品科学与工程学院,天津 300457;2.天津市利民调料有限公司,天津 300000;3.军事科学院系统工程研究院军需工程技术研究所,北京 100010)
大豆蛋白的功能特性不仅与其制备方法及自身结构组成相关,还受到许多外界条件的影响,研究表明热处理[1]、酶处理[2]、pH值[3]等多种因素可诱发大豆蛋白质发生聚集行为。降低温度是食品加工领域中的常用手段。随着冷处理程度的增加,蛋白质组分的微观结构和宏观品质也逐渐发生变化[4]。
大豆蛋白制品在冷冻食品领域应用广泛,冷处理[5]会导致大豆蛋白质性质和特性发生改变。大豆蛋白经过冷冻处理,蛋白质分子内和分子间发生疏水相互作用,氢键和二硫键的含量增加,蛋白质发生了聚集现象[6]。冷冻对大豆蛋白的保水保油性、乳化特性及其质构特性也有影响[7]。
本文研究不同浓度的大豆分离蛋白经冷冻处理后聚集行为的变化,探讨冷冻处理后大豆分离蛋白的微观结构与宏观性质之间的关联性,冷冻诱导大豆分离蛋白的研究为大豆分离蛋白在冷冻食品中的应用提供依据。
1 材料与方法
1.1 材料与仪器
大豆分离蛋白(蛋白质含量90%以上):河北赛亿生物科技有限公司;磷酸氢二钠、磷酸二氢钠、氢氧化钠、五水合硫酸铜、酒石酸钾钠、碘化钾:北京鼎国生物技术有限公司;β-巯基乙醇:北京Solarbio科技有限公司;以上化学试剂均为分析纯。
SU1510扫描电子显微镜:日本Hitachi公司;Tuibiscan ASG静态多散射稳定性分析仪:北京朗迪森科技有限公司;UV-2550PC全波长紫外/可见光扫描分光光度计:日本岛津公司。
1.2 方法
1.2.1 冷冻诱导大豆分离蛋白的制备
将大豆分离蛋白粉末状样品与水以一定比例混合,得到不同浓度的大豆分离蛋白溶液,研究不同浓度对其冷冻处理效果的影响。大豆分离蛋白溶液在-5、-20℃下分别冷冻处理 1、3、5、10 d后,烘干过筛(80目),得到冷冻诱导大豆分离蛋白样品备用[8]。
1.2.2 冷冻诱导大豆分离蛋白溶解性的测定
采用双缩脲法测定冷冻大豆分离蛋白的溶解性[9],用氮溶解指数(nitrogen solubility index,NSI)表示。
1.2.3 冷冻诱导大豆分离蛋白浊度的测定
参照Chen等的方法[10],将0.02 g冷冻大豆分离蛋白和10 mL磷酸盐缓冲溶液(0.1 mol/L,pH 7.0)混匀,后取4 mL样品移入1 cm比色皿中,用全波长紫外分光光度计在600 nm波长处测吸光值,以吸光度表示浊度,以未经冷冻的大豆分离蛋白溶液为对照。
1.2.4 冷冻诱导大豆分离蛋白稳定性动力学指数的测定
采用静态多散射稳定性分析仪来对蛋白质溶液的稳定性进行测定,将0.1 g的冷冻诱导大豆分离蛋白放入30 mL磷酸盐缓冲液(0.1 mol/L,pH7.0)中搅拌均匀,将其装入Turbiscan测试瓶中,在26℃条件下,对6 h内的稳定性动力学指数进行测定,扫描频率为30 min/次,溶液的稳定性用稳定性动力学指数(turbiscan stability index,TSI)表示[11]。
1.2.5 冷冻诱导大豆分离蛋白的扫描电子显微镜(scanning electron microscope,SEM)的观察
将冷冻前后的大豆分离蛋白样品处理后,经离子溅射金镀膜后在扫描电子显微镜下观察样品的微观形貌[12]。
1.2.6 冷冻诱导大豆分离蛋白巯基和二硫键的测定
采用Ellman法[13]和Richard法[14]结合测定冷冻诱导大豆分离蛋白样品的巯基和二硫键,计算公式如式(1)所示。

式中:X为游离巯基和总暴露巯基的含量,μmol/mg protein;73.53为106/(1.36×104),1.36×104是Ellman′s试剂的摩尔消光系数;A412为412 nm处的吸光光度值;D为稀释倍数;C为蛋白样品浓度,mg/mL。
1.2.7 冷冻诱导对大豆分离蛋白紫外吸收光谱的影响
取2mg样品(蛋白浓度4%;冷冻温度分别为-5℃和-20℃;冷冻时间3 d)与 10 mL的磷酸盐缓冲液(0.01 mol/L,pH 7.0)搅拌均匀,在波长 230 nm~300 nm下进行扫描,得出大豆分离蛋白的紫外吸收光谱,再用Origin软件微分化得到二级衍生紫外光谱。
1.2.8 数据统计分析方法
试验数据采用Microsoft Excel和Orign 8.0进行统计分析。所有试验均重复测定3次,试验结果以平均值±标准差的形式标出。当0.01<p<0.05时为差异显著,当p<0.01时为差异极显著。
2 结果与分析
2.1 冷冻诱导对大豆分离蛋白聚集行为的研究
2.1.1 冷冻诱导对大豆分离蛋白溶解性的影响
蛋白质的溶解性可初步表现出蛋白质的聚集程度,而且溶解性对蛋白质的功能特性也有一定的影响[15]。大豆分离蛋白溶解性测定结果如图1所示。

图1 不同处理方式对冷冻诱导大豆分离蛋白溶液溶解性的影响Fig.1 Effect of different treatment methods on solubility of cold induced soybean protein isolate solution
由图1可以看出,不同浓度大豆分离蛋白溶液经冷冻处理后溶解性无明显差异,大豆分离蛋白溶液冷冻诱导时间对蛋白溶解性的影响极显著(p<0.01),冷冻诱导温度对溶解性的影响不显著(p>0.05)。在-5℃和-20℃的冷冻条件下,随着冷冻时间的增长冷冻诱导烘干后大豆分离蛋白的溶解性先降低后有轻微上升,在第5天时冷冻诱导大豆分离蛋白的溶解性达到最低,分别为(47.62±1.04)%和(66.34±1.10)%,这可能是因为随着冷冻诱导时间的增加,蛋白质发生了聚集和交联从而形成不可溶的聚集体,导致了溶解性的下降。由此可见,大豆分离蛋白溶液冷冻诱导时间越长,蛋白的溶解性越低,而在冷冻诱导5 d后溶解性有轻微上升,这可能是因为过长时间的冷冻使蛋白质分子发生了一定程度的断裂,与Cropotava等的研究一致[16]。
2.1.2 冷冻诱导对大豆分离蛋白浊度的影响
蛋白质溶液的浊度可以在一定程度上反映出蛋白质的聚集状态、溶解性和颗粒大小等[17],由此可见,蛋白质溶液的浊度与聚集体的浓度和大小有关,可以作为一个重要指标来评价蛋白质聚集体。不同冷冻诱导后蛋白浊度测定结果如图2所示。

图2 不同处理方式对冷冻诱导大豆分离蛋白溶液浊度的影响Fig.2 Effect of different treatment methods on turbidity of cold induced soybean protein isolate solution
如图2所示,蛋白浊度与大豆分离蛋白溶液冷冻诱导时的浓度成正比关系。这是由于大豆分离蛋白溶液冷冻诱导时的浓度对蛋白溶解性影响很小,此时蛋白质溶液可能处于质量较稳定均匀的悬浊液状态。浊度在蛋白浓度为6%时达到最高为0.82±0.06,但在5%的蛋白浓度时浊度增加的速度开始减慢,因此选择5%蛋白质浓度来研究冷冻诱导时间对蛋白浊度的影响。
在-5℃和-20℃冷冻条件下,蛋白质的浊度均有所增加,说明冷冻使蛋白质产生变性,形成聚集体不可溶,阻止蛋白质聚集。而冷冻诱导时间对浊度的影响极显著(p<0.01),这可能是因为冷冻诱导时间的增加导致了蛋白质溶解性的下降,从而形成更大质量和尺寸的团聚体,最终导致浊度增加,在-20℃冷冻时长为10 d的浊度达到最大,在600 nm波长处的吸光值为0.78±0.065。可见脂质减少的大豆蛋白通过疏水相互作用、静电相互作用或氢键重新包装形成更大的聚集物。减缓脂质的大豆蛋白浊度增加,颗粒分布更广。
2.1.3 冷冻诱导对大豆分离蛋白稳定性动力学指数的影响
为了进一步研究冷冻对大豆分离蛋白聚集行为的影响,采用静态多散射稳定性分析仪对大豆分离蛋白稳定性动力学指数进行测定,结果如图3、图4所示。
粒子在一定周期内的状态变化可以作为动力学稳定指数的指标。动力学稳定指数越高则变化量越大,分散越不稳定。由图3可知,与未冷冻时相比,-5℃和-20℃条件下的冷冻诱导均使大豆蛋白的稳定性动力学指数有明显提高,即冷冻诱导使蛋白质分散系变得不稳定。由图4所示,随着冷冻诱导时蛋白溶液浓度的增加,蛋白稳定性动力学指数变化逐渐稳定,在蛋白溶液浓度4%、冷冻时长为6 d时达到最大为20.51。结合图3和图4分析,冷冻时间对稳定性动力学指数有影响但不显著,冷冻诱导与蛋白溶液浓度对稳定性动力学指数的影响均不显著(p>0.05)。

图3 冷冻诱导对大豆分离蛋白溶液稳定性动力学指数的影响Fig.3 Effect of freezing induction on the stability kinetic index of soybean protein isolate solution

图4 冷冻诱导时蛋白溶液浓度对大豆分离蛋白溶液稳定性动力学指数的影响Fig.4 Effect of protein concentration on the stability kinetic index of soybean protein isolate during freezing induction
2.1.4 冷冻诱导对大豆分离蛋白微观结构的影响
图5为冷冻诱导的大豆分离蛋白放大8 000倍的扫描电镜图。

图5 冷冻诱导大豆分离蛋白的扫描电子显微镜图Fig.5 Scanning electron micrograph of freeze-induced soybean protein isolate
如图5所示,未冷冻的样品以颗粒状相互分离,-5℃条件下冷冻诱导后,蛋白样品表面呈现大量不规则片状凸起,且能看到少量孔洞,整体结构看上去较为疏松。而-20℃条件冷冻诱导下,蛋白质样品表面则看上去片状凸起明显减少,几乎看不到孔洞,且整体结构更为紧致细密。因为低温冷冻,使蛋白质发生变性,产生聚集体,表面呈现凹凸不平的状态,而随着温度降低,蛋白质聚集体数量增多,结合得也更为紧密,因此-20℃时样品表面看起来更为紧致细密,随着冷冻强度的增大,蛋白质发生断裂形成可溶性聚集体和数目多的小分子多肽,使浊度和溶解性都增大,微观结构变得疏松,可以看出扫描电镜观察得到的样品微观结构与冷冻诱导对大豆分离蛋白溶解性和浊度分析的结果一致。
2.2 冷冻诱导对大豆分离蛋白分子结构的研究
2.2.1 冷冻诱导对大豆分离蛋白巯基和二硫键的影响
巯基和二硫键在维持蛋白分子的空间结构中有重要的作用[18],因此可以通过测定分析巯基和二硫键的含量来反映蛋白质的结构状态。结果如图6所示。

图6 不同处理条件对大豆分离蛋白巯基和二硫键含量的影响Fig.6 Effects of different treatment conditions on sulfhydryl and disulfide bond contents of soybean protein isolate
一般来说,巯基含量的增加可能是因为蛋白质结构的展开或者是二硫键的断裂[19]。而巯基的减少可能是因为蛋白质的聚集或者是转化成了二硫键[20]。由图6可知,未冷冻大豆分离蛋白的游离巯基含量为5.16 μmol/g,而在-5℃和-20℃条件下冷冻诱导后游离巯基含量分别为(4.82±0.34)μmol/g和(4.37±0.21)μmol/g,即在冷冻条件下,二硫键和总巯基含量在逐渐增加,而游离巯基含量则逐渐减少,且冷冻温度对二硫键和巯基含量的影响极显著(p<0.01)。
如图6所示,随着冷冻诱导时蛋白溶液浓度的增加,二硫键和总巯基含量逐渐增加,当蛋白浓度为6%时,二硫键含量最大为(26.54±0.78)μmol/g,游离巯基含量则先增加后有轻微减少且一直比对照样品的游离巯基含量少,但蛋白溶液浓度对二硫键和巯基含量的影响不显著(p>0.05)。这是因为蛋白质中的巯基与水分子间存在氢键等相互作用,而冷冻后氢键等相互作用被破坏,导致蛋白质表面的游离巯基失衡从而转化成二硫键等。
由图6可知,随着冷冻诱导时间的增长,二硫键和总巯基含量的变化趋势逐渐趋于平稳。这是因为初期冷冻时,大豆分离蛋白的体系还不稳定,随着冷冻诱导时间增长,体系逐渐趋于稳定,各项指标变化趋势也逐渐趋于稳定,同样可以说明冷冻时间对大豆分离蛋白巯基和二硫键含量的影响不显著(p>0.05)。
由此可见,冷冻诱导后二硫键含量增加,使蛋白质结构变得更加稳定,且蛋白溶液浓度越高二硫键含量越高即结构越稳定,而冷冻诱导时间对大豆分离蛋白结构稳定性影响不显著。
2.2.2 冷冻诱导对大豆分离蛋白紫外吸收光谱的影响
紫外测得的波长和强度的变化与微环境中存在的各种残留物有关。因此,可以通过紫外吸收光谱来判断蛋白质的吸收状态[21]。由于紫外光谱特征比较不明显,因此采用二阶导数光谱法检测了3个芳香氨基酸残基在250 nm~300 nm范围内的结构变化。大豆分离蛋白紫外吸收光谱如图7所示。

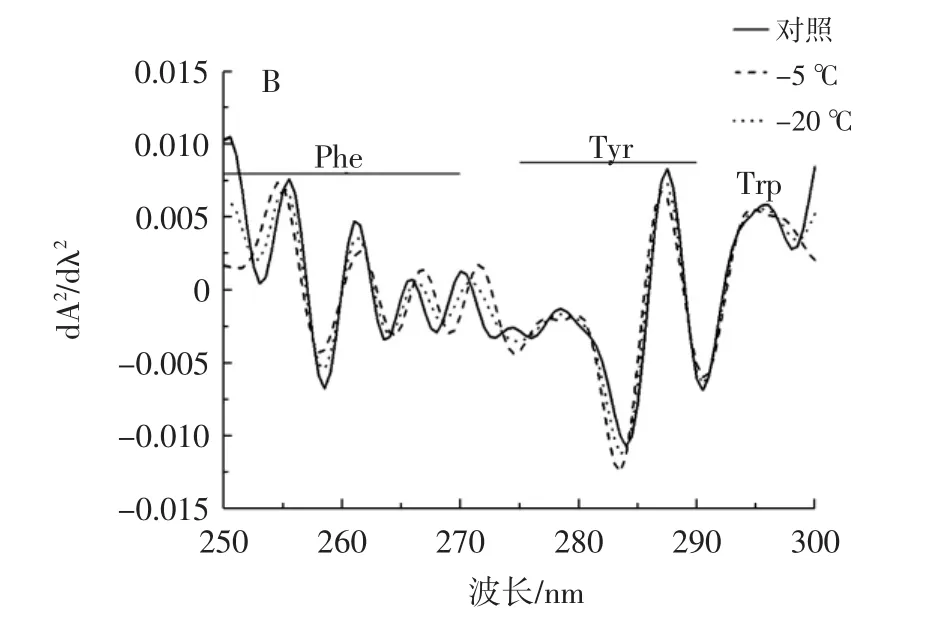
图7 冷冻诱导大豆分离蛋白聚集体的紫外吸收光谱图Fig.7 Ultraviolet absorption spectra of freeze induced SPI aggregates
从图7可以看出,不同冷冻程度诱导的样品,在与苯丙氨酸(Phe)对应的253 nm和255.5 nm处的谷峰有轻微的蓝移,而在 261、263.5、266、268、270 nm 处对应的谷峰有轻微的红移。在258.5 nm时,苯丙氨酸在-5℃和-20℃的冷冻诱导条件下发生蓝移,说明在冷冻诱导条件下一部分蛋白质分子展开,导致其具有轻微的疏水性,即芳香族氨基酸增加。图7B显示在278.5、284 nm和287 nm处的谷峰出现蓝移,表明经冷冻诱导后从大豆分离蛋白的可溶性聚合体中分离出了酪氨酸,增加了亲水性。
3种芳香族氨基酸在-5℃和-20℃冷冻处理下由于蛋白质的部分展开,冷冻聚集使大豆分离蛋白的疏水部分聚集在一起,形成更加紧密的内部结构[22],使其具有轻微疏水性,氨基酸显著地暴露出来,这与图5观察的结果一致。
3 结论
本试验以大豆分离蛋白溶液为研究对象,在-5℃和-20℃的条件下冷冻诱导烘干后再溶解,通过对溶解性、浊度、稳定性动力系数、微观结构、紫外光谱的测定,研究了大豆分离蛋白溶液浓度和冷冻诱导时间对大豆分离蛋白的聚集性行为及分子结构所产生的影响。冷冻诱导使大豆分离蛋白溶解性降低。冷冻诱导时间相同,冷冻诱导程度越深浊度越高,微观结构也越容易达到稳定状态。蛋白质变性形成大小不一的聚集体,从而对大豆分离蛋白的聚集性行为产生影响。而这些聚集体之间的相互交联作用则对大豆分离蛋白的分子结构产生影响。
综上所述,冷冻诱导对大豆分离蛋白的聚集性行为和分子结构产生了积极的影响,以上结论有望为大豆分离蛋白在冷冻食品中的应用提供参考依据。
