沙棘果渣总黄酮提取工艺优化及抗氧化活性研究
2021-02-01田建华张春媛
田建华,张春媛,魏 璐
山西省林业和草原科学研究院,太原 030002
沙棘(HippophaerhamnoidesL.)别名酸刺、醋柳,是一种雌雄异株、生态适应性很广的胡颓子科灌木或乔木,同时也是极为珍贵的药食同源植物[1],并收录于《中国药典》[2]。沙棘富含多种维生素[3]、脂肪类[3]、多酚[4]等多种生物活性物质,具有抗炎[5]和抗衰老[6]等作用,被广泛应用于食品和保健品[7]等领域。沙棘黄酮主要存在于沙棘果、叶及果渣中,是重要的生物活性物质,具有扼制动脉粥样硬化[8]、降血糖血脂[9]、治疗肠道疾病[10]、抗肿瘤[11]等多种功能,同时沙棘黄酮是优良的活性氧清除剂和脂质抗氧化剂,能够清除自由基,延缓机体衰老[12],引起越来越多的关注和研究。
沙棘黄酮的提取方法主要有水浸提法[13,14]、有机溶剂提取法等[12],这些传统的提取法存在提取时间长、提取率低、溶剂消耗量大以及高温使黄酮类物质变性等弊端。近年来,一些新型高效的提取技术及方法引起了研究人员的高度关注。其中,超声波萃取法[15]具有提取温度低、时间短、提取率较高的优势;酶法[16]提取可以在常温和非有机溶剂下进行,得到的产物纯度、稳定性及活性都较高,同时酶法具有能耗和投资成本较低、性价比高的优势。果胶酶能降解植物材料使细胞壁结构松散,甚至能完全水解植物材料,将活性成分释放。但是利用果胶酶协同超声波辅助提取法从沙棘果渣中提取黄酮类化合物的研究还鲜有报道。因此,本试验以沙棘果渣为研究材料,利用果胶酶协同超声波法提取沙棘总黄酮,通过Design-Expert 8.06软件优化试验,确定其最佳提取条件;其次通过对DPPH自由基清除、羟自由基清除和超氧阴离子自由基清除指标进行分析,评价其抗氧化活性,旨在为沙棘果渣总黄酮的研究及开发利用提供参考。
1 材料与方法
1.1 材料与仪器
沙棘果渣(山西省某沙棘饮料厂);芦丁(CAS153-18-4,HPLC ≥ 98%,成都曼斯特生物科技有限公司);果胶酶、无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠、硫酸亚铁、邻苯三酚、1,1-二苯基-2-三硝基苯肼(DPPH)、过氧化氢、浓盐酸、二丁基羟基甲苯(BHT)、邻二氮菲、磷酸盐缓冲液(PBS)、水杨酸、三羟甲基氨基甲烷(Tris)等试剂皆为市售国产分析纯试剂;试验用水为双蒸水。
JYL-C020E粉碎机(九阳股份有限公司);Explorer pro分析天平(奥豪斯仪器有限公司);BXH-65S精密可程式烘箱(上海博迅实业有限公司医疗设备厂);HH数显恒温水浴锅(常州国宇仪器制造有限公司);KQ-200VD型双频数控超声波清洗器(昆山市超声仪器有限公司);UV3100PC紫外-可见分光光度计(美普达仪器有限公司);SC-3610低速离心机(安徽中科中佳科学仪器有限公司)。
1.2 试验方法
1.2.1 材料预处理
将沙棘果渣于60 ℃鼓风干燥箱中干燥24 h,粉碎,过80目筛,备用。
1.2.2 芦丁标准曲线的绘制
配置0.2 mg/mL芦丁标准溶液,分别吸取0、1.0、2.0、3.0、4.0、5.0、6.0 mL于25 mL容量瓶中,各加30%乙醇至6 mL,加入5%NaNO2溶液1 mL,摇匀,静置6 min,加入10%Al(NO3)3溶液1 mL,摇匀,静置6 min,加4%NaOH溶液10 mL,加30%乙醇至刻度,摇匀,静置15 min。于510 nm处测定吸光度,以吸光度为纵坐标,芦丁浓度为横坐标,绘制标准曲线。
1.2.3 沙棘果渣总黄酮提取及含量测定
准确称取沙棘果渣干粉1.000 g,置于100 mL锥形瓶中,按一定比例的酶添加量、液料比、一定乙醇浓度、提取温度、提取时间、一定功率超声提取总黄酮,提取液在室温下离心,取上清液于100 mL容量瓶中,摇匀,作为供试品溶液,每个样品重复三次。分别量取各供试品溶液3 mL,按制作标准曲线的同样方法,测定样品溶液的吸光度。根据标准曲线计算出总黄酮的质量浓度,再按以下公式计算沙棘果渣总黄酮提取率:
总黄酮提取率(mg/g)=
1.2.4 单因素试验
以酶添加量、液料比、乙醇浓度、超声时间、超声提取温度、超声功率6个因素进行单因素设计,设定酶添加量1%、2%、3%、4%、5%、6%(占沙棘果渣干重);液料比10∶1、20∶1、30∶1、40∶1、50∶1、60∶1;乙醇浓度30%、40%、50%、60%、70%、80%、90%;超声提取时间30、40、50、60、70、80、90、100 min;提取温度40、50、60、70、80 ℃;超声功率50%、60%、70%、80%、90%(总功率500 W),分析各单因素对沙棘果渣黄酮提取率的影响。
1.2.5 响应面设计方案
在单因素试验的基础上,选定酶添加量(A)、液料比(B)、超声提取时间(C)3个因素为响应变量,总黄酮提取率为响应值,进行响应面优化试验。采用Design Expert 8.06软件,进行Box-Behnken试验方案,设计三因素三水平试验方案,以二次多元回归方程拟合各因素和总黄酮提取率之间的函数关系。试验因素水平见表1。
1.2.6 DPPH自由基清除能力测定
参照Sun等[17]的方法,取质量浓度不同的沙棘果渣黄酮提取液1.0 mL,加入0.004%的DPPH溶液4 mL,充分混匀,黑暗条件下静置30 min,以无水乙醇作空白对照,相应浓度的BHT作阳性对照,于517 nm处测定其吸光值。每一样品平行测3次,取其平均值。清除率公式可表示为:
DPPH自由基清除率=(A2-A1)/A2×100%
式中:A1为样品或阳性对照的吸光度值;A2为空白对照的吸光度值。

表1 响应面试验因素水平表
1.2.7 羟自由基的清除能力测定
参照Hou等[18]的方法改进,于若干比色管中分别加入7.5 mmol/mL硫酸亚铁溶液1 mL,7.5 mmol/L水杨酸-乙醇溶液1 mL,不同浓度待测总黄酮提取液1 mL(空白对照以蒸馏水代替总黄酮提取液),最后加8.8 mol/L过氧化氢溶液1 mL,35 ℃水浴35 min,于510 nm波长处测其吸光度,测其本底值时用蒸馏水代替过氧化氢,同时以相应浓度的BHT作阳性对照。根据以下公式计算其清除率:
羟自由基清除率=[A0-(Ax-Ax0)]/A0×
100%
式中:A0是空白对照吸光度;Ax是加入样品溶液或BHT后的吸光度;Ax0是本底吸光度。
1.2.8 超氧阴离子的清除能力测定
参照Wang等[19]的方法改进,于若干比色管中分别加入0.05 mol/L的Tris-HCl溶液(pH 8.2)4.5 mL并于25 ℃下水浴保温20 min,加入0.1 mL不同浓度总黄酮提取液,加入0.3 mL的3 mmol/L的邻苯三酚(用10 mmol/L的HCl配置),混匀后20 ℃水浴6 min,随即加入2滴8 mol/L HCl终止反应,320 nm处测定吸光度。空白对照以蒸馏水取代总黄酮提取液,其余步骤相同。本底测试时以0.3 mL蒸馏水取代邻苯三酚,其余步骤相同。同时以BHT作为阳性对照。按照以下公式计算其超氧阴离子自由基清除率:
超氧阴离子自由基清除率=[A0-(A1-A2)]/
A0×100%
式中:A0为空白对照吸光度;A1为样品或阳性对照的吸光度;A2为本底吸光度。
2 结果与分析
2.1 标准曲线的绘制及回归方程的建立
从图1可知,其吸光度在510 nm处与芦丁浓度相关,其相关系数R2=0.999。
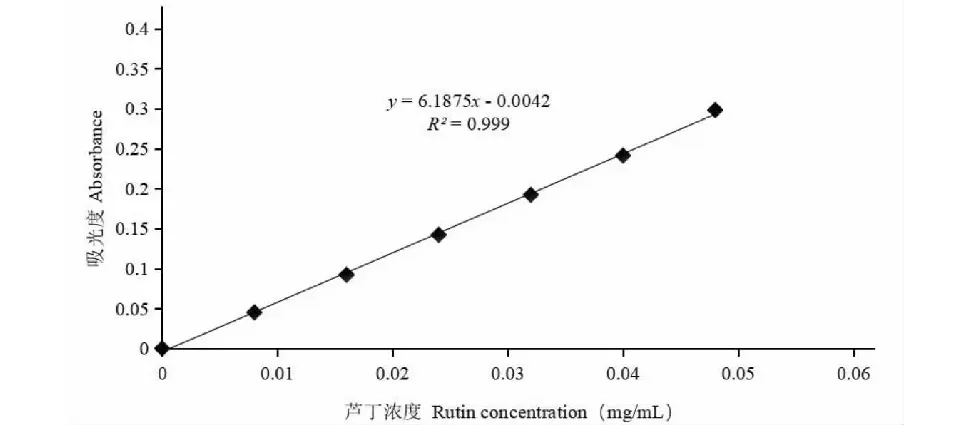
图1 芦丁标准曲线Fig.1 Rutin standard curve
2.2 单因素实验
2.2.1 酶添加量对沙棘黄酮提取率的影响
由图2可知,总黄酮提取量随着果胶酶添加量的提高不断增加。当果胶酶添加量达到5%时,黄酮提取量达到最高;继续增加酶添加量,黄酮提取量反而下降;这主要是因为果胶酶添加量少时,酶解不完全,果胶酶添加量为5%时,酶解浓度达到最大饱和,继续添加果胶酶为6%时,底物浓度不能对酶达到饱和;因此最佳果胶酶添加量为5%。
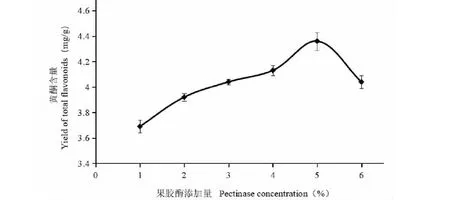
图2 果胶酶添加量对沙棘果渣黄酮含量的影响Fig.2 Effect of pectinase concentration on yield of total flavonoids
2.2.2 液料比对沙棘黄酮提取率的影响
由图3可知,不论超声辅助提取、酶法辅助提取还是超声酶法双辅助提取,液料比均在40∶1时,黄酮提取量最佳;这主要因为液料比低时,溶出一部分黄酮就达到了饱和,不能使黄酮全部溶出,液料比为50∶1和60∶1时,溶出的黄酮类物质被稀释,使得提取率下降。
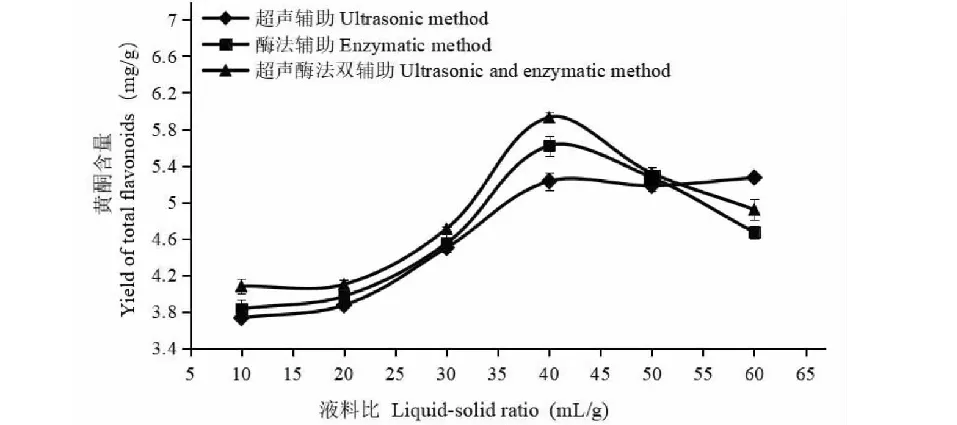
图3 液料比对沙棘果渣黄酮含量的影响Fig.3 Effect of liquid-solid ratio on yield of total flavonoids
2.2.3 乙醇浓度对沙棘黄酮提取率的影响
由图4可知,不论超声辅助提取、酶法辅助提取还是超声酶法双辅助提取,乙醇浓度为40%时,黄酮提取量达到最大值,乙醇浓度为30%或高于40%时黄酮提取量均降低;这主要是因为黄酮与提取液乙醇的极性越相似,黄酮溶出就越多,当乙醇浓度40%时,与黄酮极性最相似。
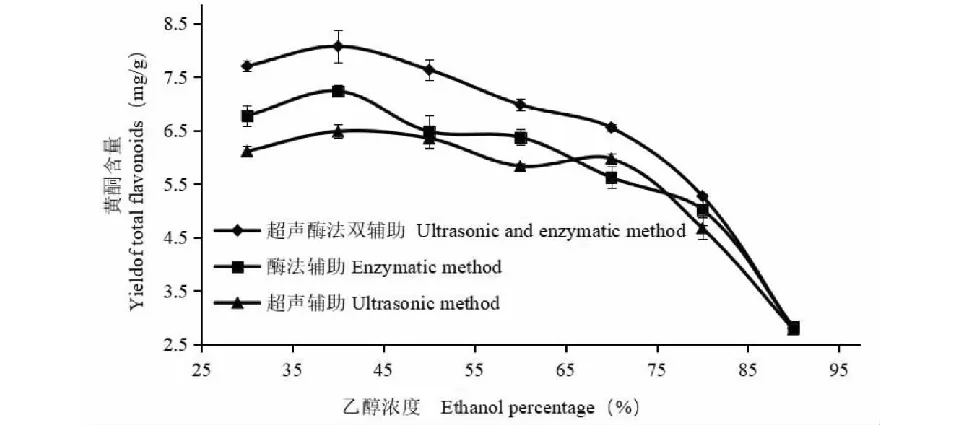
图4 乙醇浓度对沙棘果渣黄酮含量的影响Fig.4 Effect of ethanol percentage on yield of total flavonoids
2.2.4 超声提取时间对沙棘黄酮提取率的影响
由图5可知,超声提取时间为80 min时,黄酮提取量最佳,超声提取时间低于80 min或高于80 min时,黄酮提取量均下降;这主要是因为超声提取时间太短时,黄酮只能溶出一部分,不能完全溶解于乙醇溶液中,超声提取时间太长,容易使黄酮与溶液中其他物质发生反应,使得黄酮提取率降低。
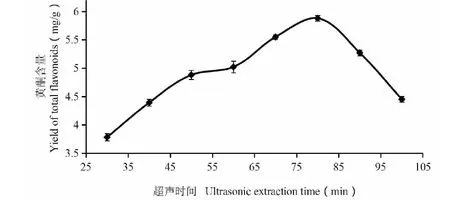
图5 超声提取时间对沙棘黄酮提取率的影响Fig.5 Effect of ultrasonic extraction time on yield of total flavonoids
2.2.5 提取温度对沙棘黄酮提取率的影响
由图6可知,在50 ℃时黄酮提取量最佳,这主要是因为温度太低时,黄酮不能完全溶出;而温度超过50 ℃时,容易使黄酮结构发生破坏,提取量降低。因此最佳提取温度为50 ℃。
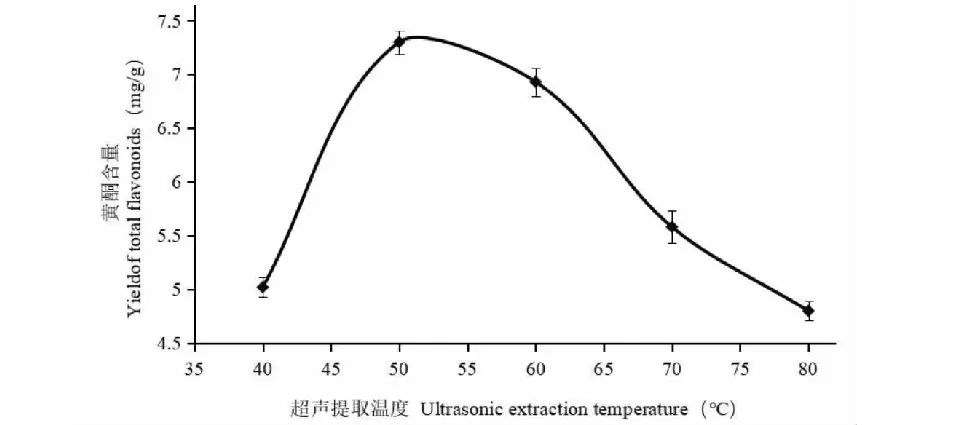
图6 提取温度对沙棘黄酮含量的影响Fig.6 Effect of ultrasonic extraction temperature on yield of total flavonoids
2.2.6 超声功率对沙棘黄酮提取率的影响
由图7可知,超声功率为80%时(总功率500 W),黄酮提取量达到最大值,这主要因为随着超声功率的增大,超声的空化作用使沙棘果渣分子发生振荡,加速黄酮的溶出;而超声功率太大时,使一些杂质溶出增多,阻碍了黄酮的溶出,提取量下降。
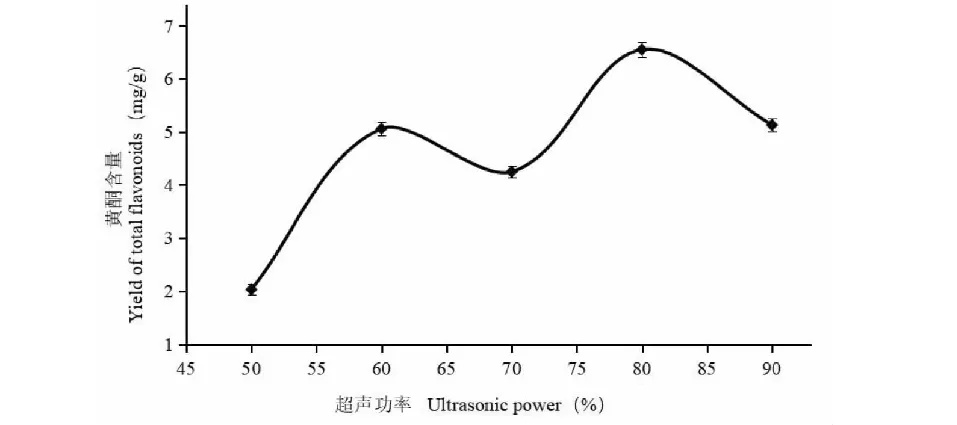
图7 超声功率对沙棘黄酮含量的影响Fig.7 Effect of ultrasonic power on yield of total flavonoids
2.3 响应面优化试验结果分析
2.3.1 响应面试验设计及结果
采用Design Expert 8.06软件,对沙棘果渣总黄酮的提取进行Box-Behnken设计,响应面试验结果见表2。
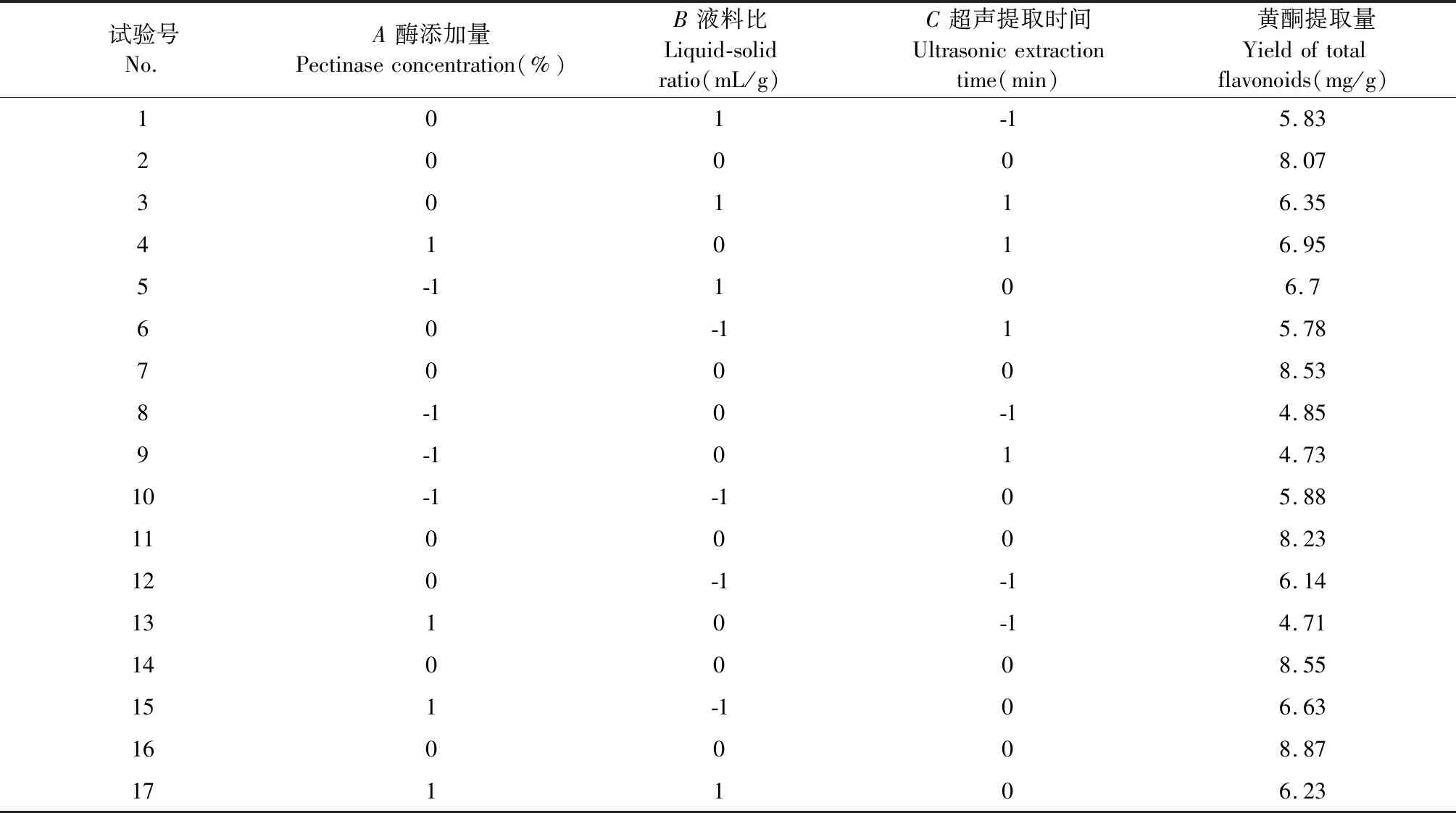
表2 响应面试验设计及结果
2.3.2 模型的建立及其显著性检验
利用Design Expert 8.06统计软件,对表2中的试验数据进行多元回归分析,获得黄酮提取量对果胶酶添加量(A)、液料比(B)、超声提取时间(C)的二次多元回归模型为:
黄酮提取量=8.45+0.30A+0.085B+0.29C-0.31AB+0.59AC+0.22BC-1.40A2-0.69B2-1.74C2。
对该二次多元回归模型进行方差分析,结果如表3。
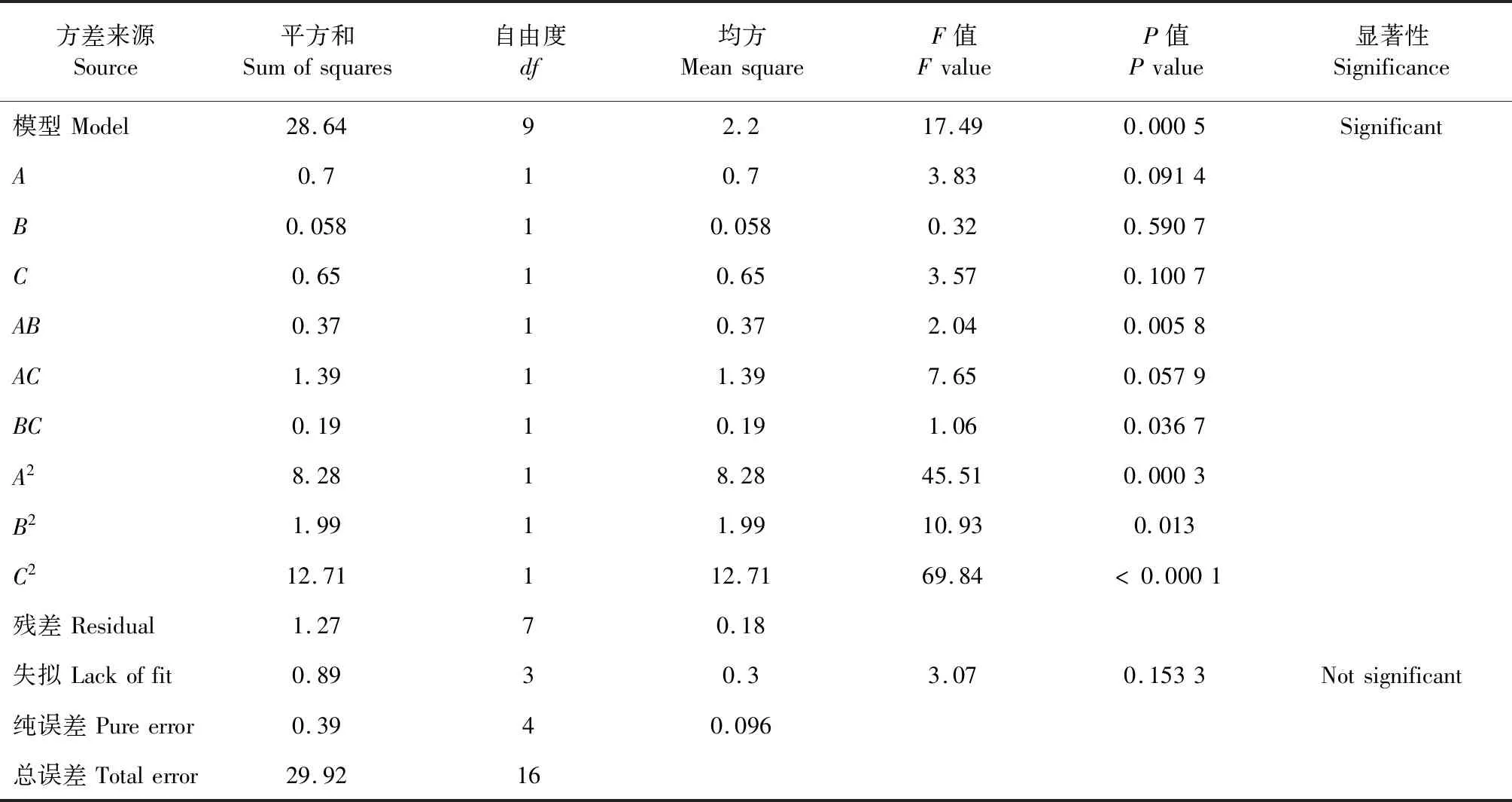
表3 响应面试验方差分析表
由表3可知,F回归值=17.49>F0.05=6.94,P<0.05,说明该回归模型显著,即各因素果胶酶添加量、液料比、提取时间与黄酮提取量之间的线性关系显著,实验模型是可靠的,能够用来分析和预测沙棘总黄酮的提取率;F失拟值=3.07
2.3.3 两因素间的交互影响
果胶酶添加量与液料比、果胶酶添加量与超声提取时间、液料比与超声提取时间之间交互作用的三维空间响应面图,如图8。
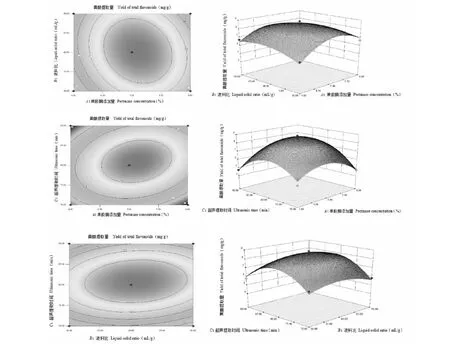
图8 两因素相互作用对沙棘果渣黄酮提取量影响的响应面和等高线图Fig.8 Response surface and contour plots for the effect of operating parameters on the extraction yield of total flavonoids
由图8可知,果胶酶添加量、超声提取时间相对于液料比的曲线较陡峭,说明果胶酶添加量、超声提取时间对黄酮提取量的影响比液料比显著,而果胶酶添加量与超声提取时间的曲线都比较陡峭,说明果胶酶添加量与提取时间的相互作用不明显。等高线图为响应面图在底面的投影,其形状反应两交互作用的显著性。果胶酶添加量与液料比、液料比与超声提取时间等高线图的形状是椭圆形,说明果胶酶添加量与液料比、液料比与超声提取时间之间交互作用显著,而果胶酶添加量与超声提取时间等高线图的形状是圆形,说明果胶酶添加量与液料比交互作用不显著[21]。
2.3.4 响应面优化的验证
拟合曲面有最大值,对回归方程求偏导进行分析,得到其沙棘果渣黄酮提取量理论最佳值为8.99 mg/g,其所对应的最佳提取条件为:果胶酶添加量5.12%,液料比40.51∶1,超声提取时间为81.07 min。考虑到实验操作的可行性,将最佳条件调整为:果胶酶添加量5.1%,液料比41∶1,超声提取时间为81 min,在此条件下进行三次重复试验,测得沙棘果渣黄酮提取量为8.78、8.89、9.05 mg/g,平均值为8.91 mg/g,与理论值相差0.08 mg/g,说明该模型优化所得的提取工艺参数是可靠的。
2.4 抗氧化活性试验
2.4.1 DPPH自由基清除能力
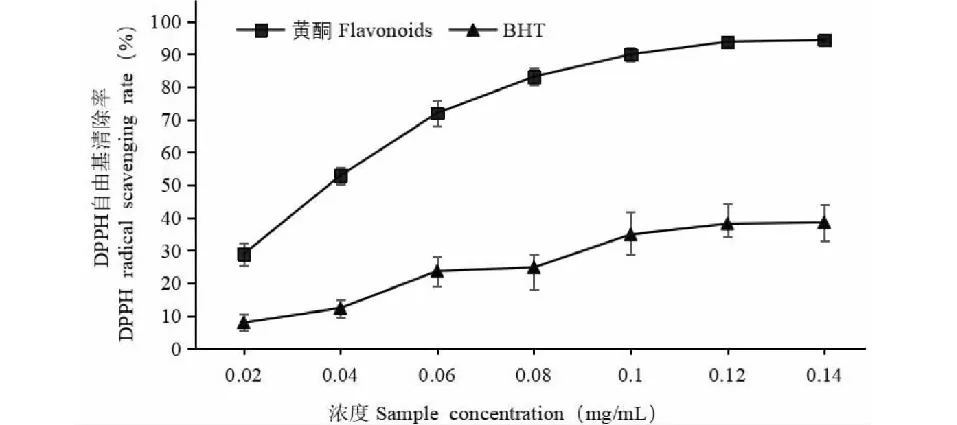
图9 沙棘果渣总黄酮对DPPH自由基的清除能力Fig.9 DPPH free radical scavenging capacity of flavonoids from sea buckthorn pomace
由图9可知,沙棘果渣总黄酮提取液和BHT都有清除DPPH自由基的作用,对沙棘果渣来说,总黄酮提取液浓度在0.02 mg/mL至0.08 mg/mL时,清除DPPH自由基的能力增长很快,清除率由28.89%迅速增长至83.17%,随后总黄酮提取液浓度增加,但清除能力增长缓慢,总黄酮提取液浓度由0.12 mg/mL增长至0.14 mg/mL时,清除率仅增加1%,达到94.42%。整体来看,沙棘果渣总黄酮对DPPH自由基的清除能力要大于BHT。
2.4.2 羟自由基清除能力
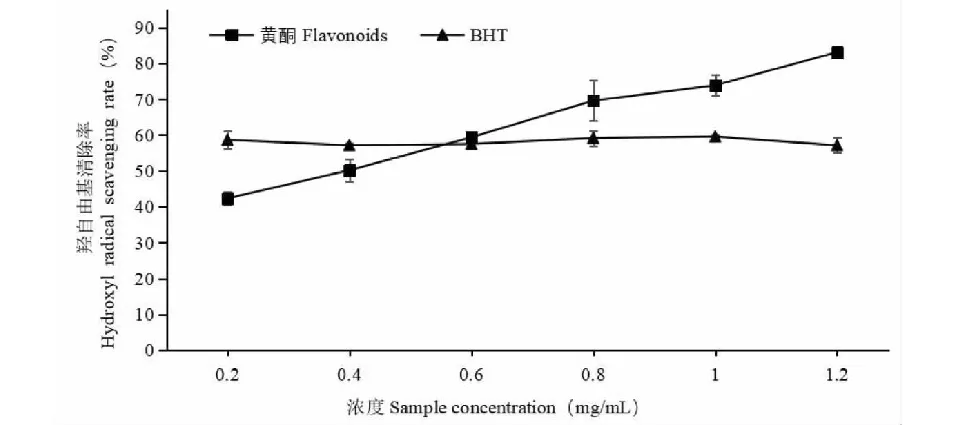
图10 沙棘果渣总黄酮对羟自由基的清除能力Fig.10 Hydroxyl free radical scavenging capacity of flavonoids from sea buckthorn pomace
由图10可知,沙棘果渣总黄酮提取液和BHT都有清除羟自由基的作用,沙棘果渣总黄酮提取液对羟自由基的清除率呈现一条增长曲线,当提取液浓度由0.2 mg/mL增长至1.2 mg/mL时,清除率由42.34%增加至83.10%。和BHT相比,总黄酮提取液在低浓度时对羟自由基的清除率明显低于BHT;但在高浓度时对羟自由基的清除率又高于BHT。
2.4.3 超氧阴离子自由基清除能力
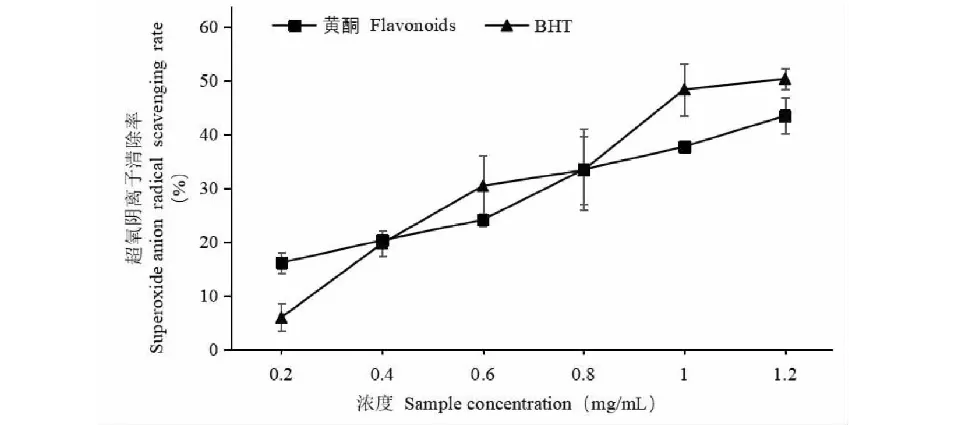
图11 沙棘果渣总黄酮对超氧阴离子自由基的清除能力Fig.11 Superoxide anion free radical scavenging capacity of flavonoids from sea buckthorn pomace
由图11可知,沙棘果渣总黄酮提取液和BHT都有清除超氧阴离子自由基的作用。当总黄酮提取液质量浓度小于0.4 mg/mL时清除能力大于BHT;当提取液浓度为0.4 mg/mL时,总黄酮提取液和BHT清除能力相差不大,均为20%左右;当总黄酮提取液浓度大于0.4 mg/mL时,清除能力明显低于BHT。整体来看,沙棘果渣总黄酮提取液随浓度的增加而增加,但清除效果不显著,仅在提取液浓度达到1.2 mg/mL时,清除率达到43.41%。
3 结论
本研究对沙棘果渣总黄酮的提取工艺进行优化,并对其抗性氧化活性进行研究。通过响应面优化试验,建立了果胶酶添加量、液料比和超声提取时间三因素三水平的回归模型拟合方程,根据模型,对果胶酶添加量、液料比和超声提取时间对沙棘果渣黄酮提取量影响的交互作用进行探讨,得出沙棘果渣总黄酮最佳提取工艺条件为:果胶酶添加量5.1%,液料比41∶1,超声提取时间为81 min,在此条件下,沙棘果渣总黄酮提取量达到8.91 mg/g,高于前人报道的沙棘果皮渣中黄酮含量[22],并且缩短了提取时间[23]。提取液DPPH自由基清除能力、羟自由基清除能力、超氧阴离子自由基清除能力的试验,证实其比BHT有更高的抗氧化活性,可以作为抗氧化剂,为沙棘黄酮在抗氧化方面的应用提供了一定的依据。
