白僵菌天然产物及其药理活性和生物合成研究进展
2021-02-01谢丽媛尹文兵
谢丽媛,尹文兵,李 伟,3*,高 伟*
1首都医科大学 中医药学院,北京 100069;2中国科学院微生物研究所,真菌学国家重点实验室,北京 100101;3河南省科学院生物研究所有限责任公司,郑州 450008
白僵菌属(Beauveria)真菌属于子囊菌门(Ascomycotina)粪壳菌纲(Sordariomycetes)肉座菌目(Hypocreales)虫草菌科(Cordycipitaceae),是一类常见的昆虫寄生菌。该属中的球孢白僵菌(Beauveriabassiana(Bals.)Vuillant)感染或人工接种于蚕蛾科昆虫家蚕(BombyxmoriLinnaeus)4~5龄的幼虫后使其死亡而形成的干燥体称为僵蚕,是一味传统中药,可用于肝风夹痰,惊痫抽搐,小儿急惊,破伤风,中风口,风热头痛,目赤咽痛,风疹瘙痒,发颐痄腮等。研究发现,白僵菌次级代谢产物是僵蚕活性的重要物质基础,且具有较好的药理活性和生物活性。研究人员对该属真菌中的次级代谢产物及其生物合成途径进行了广泛的研究,迄今为止,已从该属真菌中分离得到了多肽类、聚酮类、生物碱类、苯丙素类、萜类、核苷类等多种结构类型的化合物约158个,NCBI数据库中公开了17个白僵菌菌株的基因组测序数据,白僵菌素、白僵菌交酯、球孢交酯、卵孢素及纤细素等活性分子的生物合成基因簇及其生物合成途径也已得到阐明。本文就白僵菌属真菌产生的天然产物、药理活性及生物合成途径等方面的最新研究成果进行全面的总结,为白僵菌来源的新结构活性天然产物的基因组挖掘以及已知重要活性分子资源的深入开发应用提供参考。
1 化学成分和药理活性
1.1 多肽类化合物
多肽类化合物是白僵菌属真菌产生的一类主要化合物类型,目前已发现大约78个多肽类化合物,包括核糖体多肽类(ribosomal peptides)和非核糖体多肽类(non-ribosomal peptides,NRPs),研究较为广泛的有白僵菌素(beauvericins)、白僵菌交酯(beauverolides)、球孢交酯(bassianolide)等。
1.1.1 核糖体多肽类化合物
核糖体多肽类化合物是核糖体以mRNA作为模板,利用20种常见的蛋白源氨基酸进行合成得到的产物(个别生物可利用硒代半胱氨酸和吡咯赖氨酸)。化合物1~14为从球孢白僵菌中分离发现的核糖体多肽类化合物(见图1),这些化合物为铁载体及相关的衍生物,但其中仅含两个(1、3~8)或三个异羟肟酸基团的化合物(14)显示出铁结合的活性[1]。
1.1.2 非核糖体多肽类化合物
非核糖体多肽类化合物是不依赖mRNA或其他RNA模板,利用蛋白源氨基酸或非蛋白源氨基酸,通过非核糖体肽合成酶进行催化合成,非核糖体肽合成酶中每个腺苷酰化结构域的特异性决定了被选择和激活氨基酸的种类和数量。目前已经在白僵菌中分离得到约有64个NRPS类型的化合物,其中多为环缩肽类,代表性的六元环缩肽类化合物有白僵菌素(beauvericins)、isaridins、破坏素(destruxins)和isariins及其衍生物(见图2)。
白僵菌素及其衍生物的核心结构由三个氨基酸残基与三个羟基酸残基交替连接构成,从白僵菌中分离得到的白僵菌素类化合物包括白僵菌素(15)、白僵菌素A~F(16~19、23、24)及其衍生物allobeauvericins A~C(20~22)。白僵菌素(15)从球孢白僵菌的菌丝体中首次分离得到,因其具有抗肿瘤、杀虫、抗菌、抗病毒等多种药理活性而得到广泛研究。例如,白僵菌素对人乳腺癌、非小细胞肺癌等多种肿瘤细胞均具有较好的药理活性[2],其抗癌作用机制与氧化应激[3]、刺激细胞内钙离子浓度升高[4]、诱导细胞周期停滞[4-6]及细胞凋亡[2,5]、抑制肿瘤细胞迁移及肿瘤中新血管生成[2]等有关。白僵菌素还具有较好的杀虫活性,可有效杀灭Aedesaegypti、Calliphoraerythrocephala、Leptinotarsadecemlineata、Lygusspp.等多种害虫[7]。白僵菌素A~B(16、17)也是从球孢白僵菌中首次分离得到的,白僵菌素D~F(19、23、24)则是Beauveriasp.FKI-1366中分离得到,白僵菌素C(18)以及allobeauvericin A~C(20~22)则于Beauveriasp.中分离得到,这些化合物均具有较好的杀虫活性,可有效杀灭蚊子幼虫、苍蝇、有色甲虫等害虫,白僵菌素A~B(16、17)和allobeauvericin A~C(20~22)对疟原虫均有较好的杀灭作用,其IC50分别为2.3、2.8、2.5、3.0和1.9 μM[8]。白僵菌素对人、动物和植物的多种病原菌均具有很强的抗菌活性,且对革兰氏阳性菌和革兰氏阴性菌无选择性,其抗菌作用机制与细菌细胞壁无关,可能与细菌细胞器或某些酶系统有关[2]。白僵菌素虽无抗真菌活性,但当其与酮康唑或咪康唑合用时具有显著的抗Candidaparapsilosis活性[2];还可通过阻断多药外排和抑制全局调节剂TORC1激酶增强吡咯类抗真菌药对耐唑类念珠菌的活性[9]。白僵菌素A、D~F(16、19、23、24)还可增强咪康唑的抗真菌活性,其中白僵菌素D(19)和白僵菌素E(23)可显著增强咪康唑对氟康唑耐药型白色念珠菌的活性[10]。白僵菌素还是一种强抗炎剂,可通过抑制Src和Syk来减弱NF-κB依赖性炎症反应[11],并通过抑制炎症反应并诱导炎症细胞凋亡来减轻哮喘[12]。此外,白僵菌素可通过有效抑制ACAT活性降低胆固醇[13],还可通过抑制HIV-1整合酶来发挥抗HIV活性[14]。
Isaridin及其衍生物是由α-羟基酸、β-丙氨酸和另外四个α-氨基酸组成的六元环缩肽类化合物。目前从B.felina中分离得到isaridins A、B(25、26)、isaridin C2(27)、isaridins E-G(28、31、32)、desmethylisaridins C1、C2(29、33)、desmethylisaridin E(30)和desmethylisaridin G(34)10个isaridins类化合物[15,16]。研究发现,desmethylisaridin C1(33)具有一定的抗大肠杆菌活性,其MIC值为8 μg/mL[15];而desmethylisaridin E(30)和desmethylisaridin C2(29)则可分别通过抑制超氧阴离子产生和抑制弹性蛋白酶释放来发挥抗炎作用,其IC50值分别为10.00 ± 0.80 μM和10.01 ± 0.46 μM[16]。
破坏素及其衍生物基本结构中含一个羧基酸残基和五个氨基酸残基,从白僵菌B.felina中分离得到的破坏素及衍生物有destruxin A(35)、destruxin A1(36)、destruxin A4(37)、roseotoxin B(38)、[β-Me-Pro] destruxin E chlorohydrin (39)、chlorohydrin destruxin A4(40)、destruxin E chlorohydrin(41)、destruxin E diol(42)、destruxin Ed1(43)、desmethyldestruxin C(44)、destruxin C(45)、roseotoxin C(46)、destruxins B、B1(47、48)、homodestruxin B(49)、roseotoxin A(50)、destruxin C2(51)、destruxin D2(52)、destruxin E1(53)、destruxins D、D1(54、55)、destruxin F(56)、hydroxydestruxin B(57)、hydroxyhomodestruxin B(58)、[Phe3,N-Me-Val5] destruxin B(59)、pseudodestruxins B、C(60、61)在内的27种破坏素类化合物[17-19]。破坏素类化合物具有广泛的杀虫、植物毒性活性,例如:destruxin A(35)和destruxins B、B1(47、48)对白血病细胞和脾淋巴细胞具有较好的细胞毒性作用[20],destruxin B(47)对大鼠心肌组织具有正性变力作用和负性变时作用,destruxin B(47)和homodestruxin B(49)可抑制乙型肝炎病毒表面抗原,destruxin B(47)还可作为液泡型ATP酶的特异性、剂量依赖性和可逆性抑制剂,chlorohydrin destruxin A4(40)则可作为促红细胞生成素诱导剂[21]。绿僵菌Metarhiziumrobertsii也可产生破坏素及其衍生物,且其生物合成途径已经阐明[22],通过生物合成簇的骨架基因DtxS1的BlastP 分析比对,在已测序的白僵菌基因组中没有发现合成破坏素的相似功能基因,但与白僵菌中的环孢菌素C合成酶(cyclosporin synthase)、球孢交酯合成酶(bassianolide synthase)、白僵菌素合成酶(beauvericin synthetase)和恩镰孢菌素成酶(enniatin synthase)的相似性达40%左右。
从白僵菌中还产生具有多种活性的isariin、scopularide、isarfelin、球孢交酯和bassiatin等多种其他非核糖体多肽类化合物。例如:Baute等[23]从Isariafelina(=B.felina)中分离得到化合物isariin和isariins B~D(62~65),其中仅isariin C(64)和isariin D(65)具有较好的杀虫活性;Langenfeld等[24]从B.felina中分离得到的化合物iso-isariin B(66)对象虫类害虫有一定杀灭作用,其LD50为10 μg/mL;而iso-isariin D(67)具有很强的卤虫致死性,其LD50为26.58 μΜ[17];Elbanna等[25]从Beauveriasp.CMB-F585 中分离得到的scopularides C-G(68~72),但并没有明显的抗细菌、抗真菌或抗癌活性;有研究从白僵菌中分离得到了的环孢菌素A(73),环孢菌素A作为免疫抑制剂被广泛应用于器官移植以及自身免疫病的治疗,还具有一定的抗肿瘤、抗寄生虫、抗真菌、抗HIV和丙型肝炎病毒等活性[26]。Guo等[27]从I.felina中分离得到的isarfelins类化合物isarfelins A、B(74、75)具有一定的杀虫、抗菌等活性;Geng等[28]则从Beauveriaamorpha中分离得到了具有酪氨酸酶抑制活性的槲寄生酰胺(76);从B.bassiana中分离得到的球孢交酯(77)具有一定的抗癌、抗疟原虫、抗分枝杆菌[29]、杀虫[30]等活性;从B.bassianaK-717中分离得到的血小板聚集抑制因子bassiatin(78)对HeLa细胞、L929细胞和MDA-MB-231乳腺癌细胞均具有细胞毒性作用[31],对耐甲氧西林金黄色葡萄球菌(MRSA)也有效[32]。
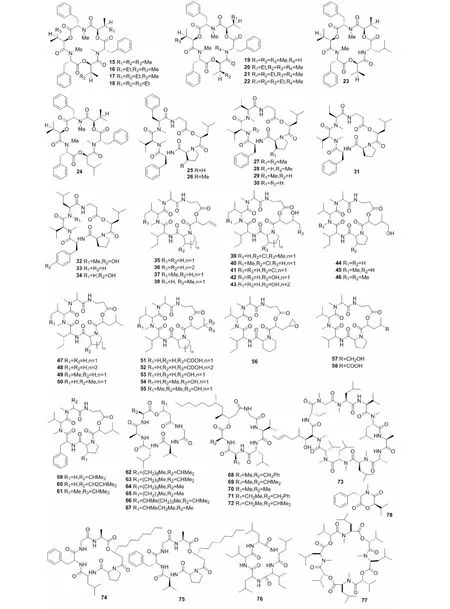
图2 非核糖体多肽类化合物15~78的结构Fig.2 Structures of the nonribosomal peptides 15-78
1.2 聚酮类化合物
聚酮类化合物(polyketides,PKs)是通过聚酮合酶利用乙酰辅酶A和丙二酸单酰辅酶A作为构造单元合成的一类化合物,其终产物来源于聚酮中间体。目前已从白僵菌中分离得到了31个聚酮类化合物(见图3),而且具有一定的药理活性和生物活性。
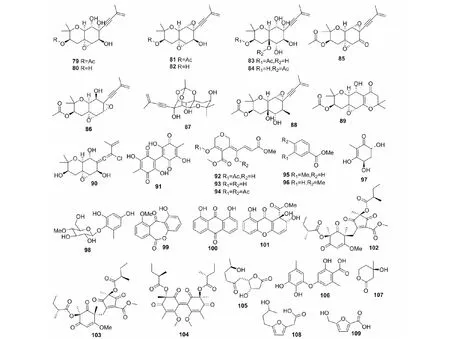
图3 聚酮类化合物79~109的结构Fig.3 Structures of the polyketides 79-109
白僵菌能产生包括oxirapentyns A~L(79~90)在内的12个oxirapentyns类化合物,并展示了重要的活性。Oxirapentyn A(79)从B.felinaSANK 13682中首次分离得到,具有一定的细胞毒性[33];Smetanina和Yurchenko等[33-35]先后从I.feline中分离得到了oxirapentyns B~D(80~82)、oxirapentyn L(90)和oxirapentyns E~K(83~89),其中oxirapentyn E(83)可作为植物生长促进剂来促进玉米和大麦的生长。卵孢素(91)是从B.bassiana中分离得到的一种红色素,具有一定的细胞毒性,可通过诱导氧化应激使ROS和丙二醛水平升高影响线粒体膜电位,造成DNA损伤而诱导细胞凋亡[36]。卵孢素具有一定的杀虫作用,在球孢白僵菌将宿主杀死后,卵孢素还可以发挥其抗菌作用,抑制其他微生物生长,以保证球孢白僵菌更好地利用宿主营养进行生长繁殖[37]。Smetanina等[38]从I.felinaKMM 4639中分离得到了化合物isariketides A和B(92、93)和isariketide A acetate(94),其中isariketide A(92)和isariketide A acetate(94)对22Rv1、PC-3 和LNCaP细胞具有一定的细胞毒性。Gao等[39]从油松毛虫病原真菌布氏白僵菌B.brongniartii中分离得到具有杀虫活性的小分子毒素物质间甲基苯甲酸甲酯(95)和对甲基苯甲酸甲酯(96),这两个化合物都对油松毛虫现出很高的注射毒性,但其饲喂毒性和表皮接触毒性不高。Hu等[40]通过活性导向的分离从B.amorpha中分离得到了具有自由基清除活性的(-)-terredionol(97)和6-methyl-2,4-dihydroxyphenyl 4-O-methyl-beta-D-glucopyranoside(98),后者具有与TroloxTMC、抗坏血酸或槲皮素相当的自由基清除活性和脂质过氧化抑制活性。Yamazaki等[41]从B.bassianaTPU942中分离得到了1-hydroxy-10-methoxy-dibenz[b,e]oxepin-6,11-dione(99)、chrysazin(100)和globosuxanthone A(101),其中后两种化合物具有抗白色念珠菌活性,globosuxanthone A(101)还可以抑制HCT-15(结肠)和Jurkat(T细胞淋巴瘤)的生长,其IC50值分别为10.7 和2.3 μM。Oller-López等[42]从B.bassiana中分离得到了(+)-bassianolone(105),该化合物为抗菌化合物cephalosporolides E和cephalosporolides F的前体,具有一定的抗革兰氏阳性菌和抗真菌等活性。Zenitani等[43]从B.felineQN22047中分离得到化合物gerfelin(106),该化合物可以非竞争性地抑制hGGPP合酶介导的香叶基二磷酸的合成。Lee等[44]从B.bassiana中分离得到了beauvetetraones A~C(102~104),其独特的结构特点暗示了该类化合物可能在B.bassiana抗氧化应激过程中起作用。此外,Krasnoff等[1]从B.bassiana中分离得到了铁载体相关化合物mevalonolactone(107),Luo等[45]从B.bassianaΔBbPacC突变体中分离纯化到了黄色化合物bassianolone B(108),de Souza Daniel等[46]则从B.bassiana中分离得到了具有抗菌活性的化合物5-hydroxymethyl-2-furanoic acid(109)。
1.3 聚酮-非核糖体多肽杂合类化合物
PK-NRP(polyketide-nonribosomal peptides)杂合化合物是经过聚酮合酶和非核糖体多肽合酶协同作用催化形成的一类化合物,目前在白僵菌属真菌中分离得到的PK-NRP杂合化合物约有36个,其中多数为白僵菌交酯类化合物(见图4),该类化合物也展示了优良的药理活性和生物活性。
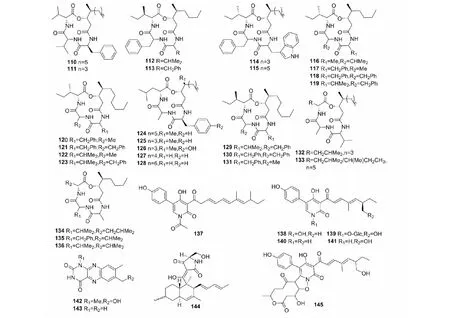
图4 PKS-NRPS杂合化合物110~145的结构Fig.4 Structures of the NRPS-PKS hybrids 110-145
白僵菌交酯类化合物属于四元环缩肽类化合物,由一个羟基酸和三个氨基酸组成,并偶联一个多烯烃链。目前已从白僵菌中分离得到27个白僵菌交酯类化合物。Elsworth等[47]从B.bassiana中先后分离得到了白僵菌交酯类化合物beauverolide A(110)、beauverolide B(129)、beauverolide Ba(123)、beauverolide C(130)、beauverolide Ca(121)、beauverolides D、E(111、112)、beauverolide Ea(119)、beauverolide F(113)、beauverolide Fa(118)、beauverolides H~I(127、128);Grove等[48]从B.bassiana中分离得到了beauverolide Ba(123)、beauverolide Ca(121)、beauverolide Ja(114)和beauverolide Ka(115);Jegorov 等[49]从B.tenella中分离得到了beauverolide L(131)和beauverolide La(120); Kuzma等[50]从B.bassiana中分离得到了beauverolide M(132)、beauverolide N(126)和beauverolide P(133);Mochizuki和Namatame等从Beauveriasp.中分别分离得到了beauverolide I(125)、beauverolide II(124)[51]和beauverolide III(117)[52];Matsuda等[53]则从Beauveriasp.FO-6979中分离得到beauverolide IV(136)、beauverolide V(116)、beauverolides VI、VII(134、135)和beauverolide VIII(122)。上述白僵菌交酯类化合物具有广泛的药理活性,例如:beauverolide L(131)可以通过靶向MCP-1、MMP2和CTGF途径抑制成肌纤维细胞分化来减轻肺纤维化[54];beauverolide I(125)具有一定的抗衰老作用,可作为抗衰老剂的潜在先导化合物[55]; beauverolide III(117)可有效抑制脂滴形成,从而对动脉粥样硬化的早期事件产生影响[56]。
球孢菌素(137)和纤细素(138)为从B.tenella和B.bassiana中分离得到的两种黄色化合物,它们均具有较好的杀虫作用。此外,纤细素还可作为铁螯合剂防止球孢白僵菌中因铁过载诱导产生的活性氧的毒性[57]。Andrioli等[58]从白僵菌中分离得到pyridovericin-N-O-(4-O-methyl-β-d-glucopyranoside)(139)、pretenellin B(140)、pyridovericin(141)、1-methyl-11-hydroxylumichrome(142)和lumichrome (143) 等化合物,其中pyridovericin(141)具有一定的细胞毒性。此外,Neumann和Takahashi等[59,60]分别从B.bassiana中分离到了具有中等细胞毒性的tetramic acid衍生物beauversetin(144)和活性未知的化合物pyridomacrolidin(145)。
1.4 其他类型化合物
白僵菌还产生生物碱、苯丙素类、萜类和核苷类等其他类型的化合物,其中146~149为生物碱类化合物,150~152为苯丙素类化合物,153~155为萜类化合物,156~158为核苷类化合物(见图5),这些化合物也具有多样的生物活性。例如:Fan等[61]从B.tenella发酵液中分离纯化出2-哌啶酮(146)、六氢化-吡咯环[1,2-a]吡嗪-1,4-二酮(147)和2-香豆满酮(150)多个化合物,其中2-哌啶酮和2-香豆满酮对油松毛虫具有显著的杀灭活性;Du等[17]从B.felinaEN-135中分离得到了felinones A、B(151、152),其中felinone B(152)对铜绿假单胞菌具有一定的抑制活性;Baek和Geng等[62,28]分别从B.bassianaCS1029和中B.amorpha分离得到的dhFAME(153)和2′-氨基-2′-脱氧鸟苷(156)均具有抑制黑色素生成的活性;Liu等[63]首次从B.bassiana中分离得到了N6-(2-羟乙基)腺苷(HEA)(158),该化合物是第一个生物来源的钙拮抗剂,具有抑制肿瘤细胞增殖、抗炎、杀虫、保护肾脏和镇静等药理活性,说明该白僵菌菌株可作为HEA的来源,具有广阔的研究前景。此外,de Souza Daniel等[46]从B.bassiana的乙酸乙酯提取物中分离得到了pyridine-2,6-dicarboxylic acid(148)和monomethyl dipicolinate(149),从丁醇提取物中分离得到了β-adenosine(157);而Yang等[64]则从白僵菌中分离得到了高效糖皮质激素地塞米松合成的中间体16α-甲基-RSA(154)及其11α-羟基化产物(155)。
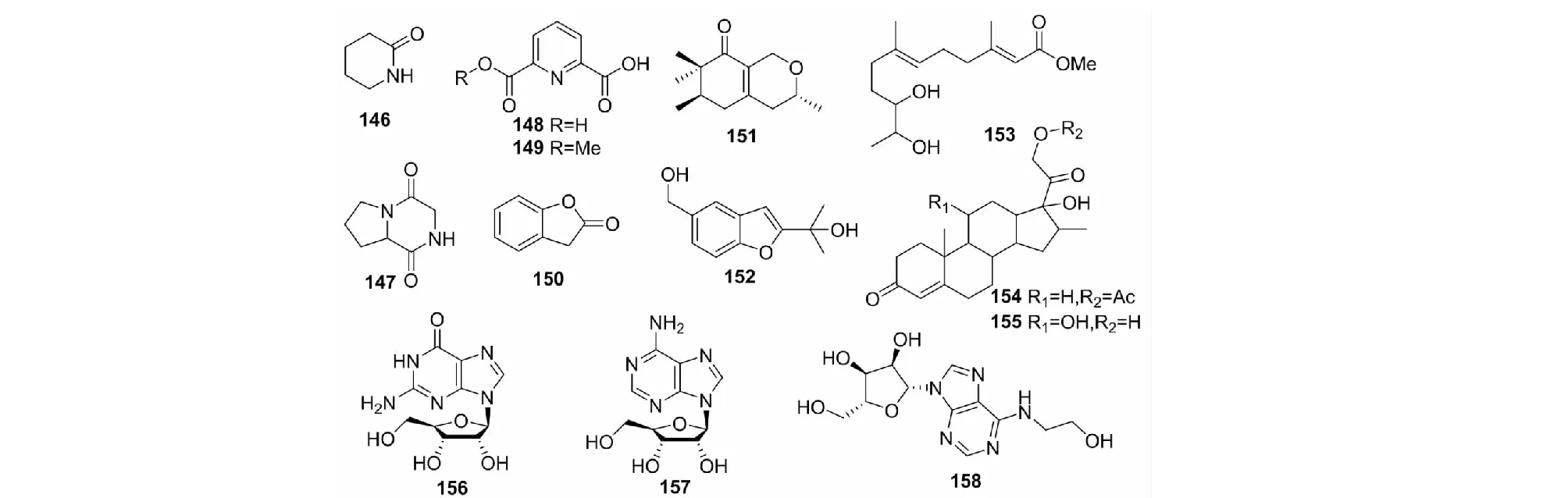
图5 其他类型化合物146~158的结构Fig.5 Structures of other compounds 146-158
由此可见,白僵菌产生的结构和种类复杂多样的天然产物具有优良的药理活性和生物活性(见表1),展现出极大的应用和开发潜力。

表1 白僵菌产生具有药理活性的主要天然产物
2 白僵菌天然产物生物合成研究
随着基因组测序技术的发展,多种白僵菌菌株的基因组测序已经完成。目前白僵菌素、白僵菌交酯类化合物、球孢交酯、卵孢素和纤细素的生物合成基因及其功能已经得到克隆和验证(见表2),其生物合成途径也得到了较为清楚的阐明。
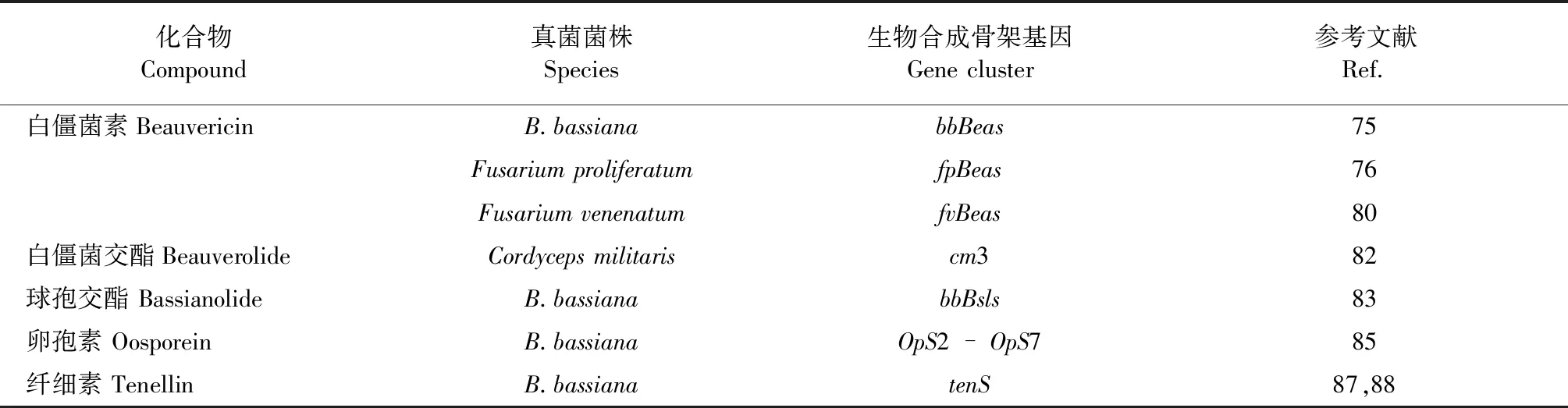
表2 白僵菌中已知生物合成途径的化合物及其生物合成关键基因
2.1 白僵菌素的生物合成
Xu等[65]从球孢白僵菌中获得编码白僵菌素的合成酶基因bbBeas,并通过基因敲除和异源表达等手段证实该基因负责白僵菌素的生物合成;在其合成过程中,以D-2-羟基异戊酸(D-Hiv)和N-甲基-L-苯丙氨酸(N-Me-L-Phe)为底物合成二肽中间化合物,然后将 3 个该中间化合物聚合形成低聚环状化合物白僵菌素(见图6)。镰刀菌Fusariumproliferatum和Fusariumvenenatum也可合成白僵菌素,两者白僵菌素合成基因fpBeas和fvBeas的氨基酸序列的相似性为62.9%,而球孢白僵菌bbBeas基因与镰刀菌白僵菌素合成基因fpBeass和fvBeas的氨基酸序列的相似性分别为74%和58.4%,镰刀菌与球孢白僵菌的白僵菌素合成基因中独特的序列差异可能是其高产量的关键因素[66]。Bassiatin是白僵菌素三聚体的一个环化单体单元,参与了白僵菌素的生物合成,因此可能是该途径的旁路产物[67]。Kim等[68]发现,白僵菌素合成酶是球孢白僵菌中一种新型的CaM结合蛋白,在白僵菌素的生物合成过程中,能够以Ca2+依赖的方式与CaM相互作用。而球孢白僵菌2-酮异戊酸还原酶(BbKIVR)可在由环境刺激介导的白僵菌素生物合成中通过CaM信号传导途径发挥重要作用[69]。Yu等[70]将KIVR工程化到酿酒酵母BJ5464-NpgA中,进一步提高了白僵菌素的产量,并通过加入l-Val改善了KIVR底物的供应,增加了白僵菌素的产量;并利用该表达系统表征了来自F.venenatumNRRL 26139的白僵菌素合成酶 FvBEAS。白僵菌素合成酶催化白僵菌素合成时,在C1-A1-T1-C2-A2-MT-T2a-T2b-C3域结构中,C3和C2轮流将两种生物合成前体D-2-羟基异戊酸(D-Hiv)和L-苯丙氨酸(Phe)加入到二肽链中,最后C3使链环化,Yu等[71]通过使C2和C3与两个SNAC连接的前体反应重建了体外白僵菌素的生物合成。
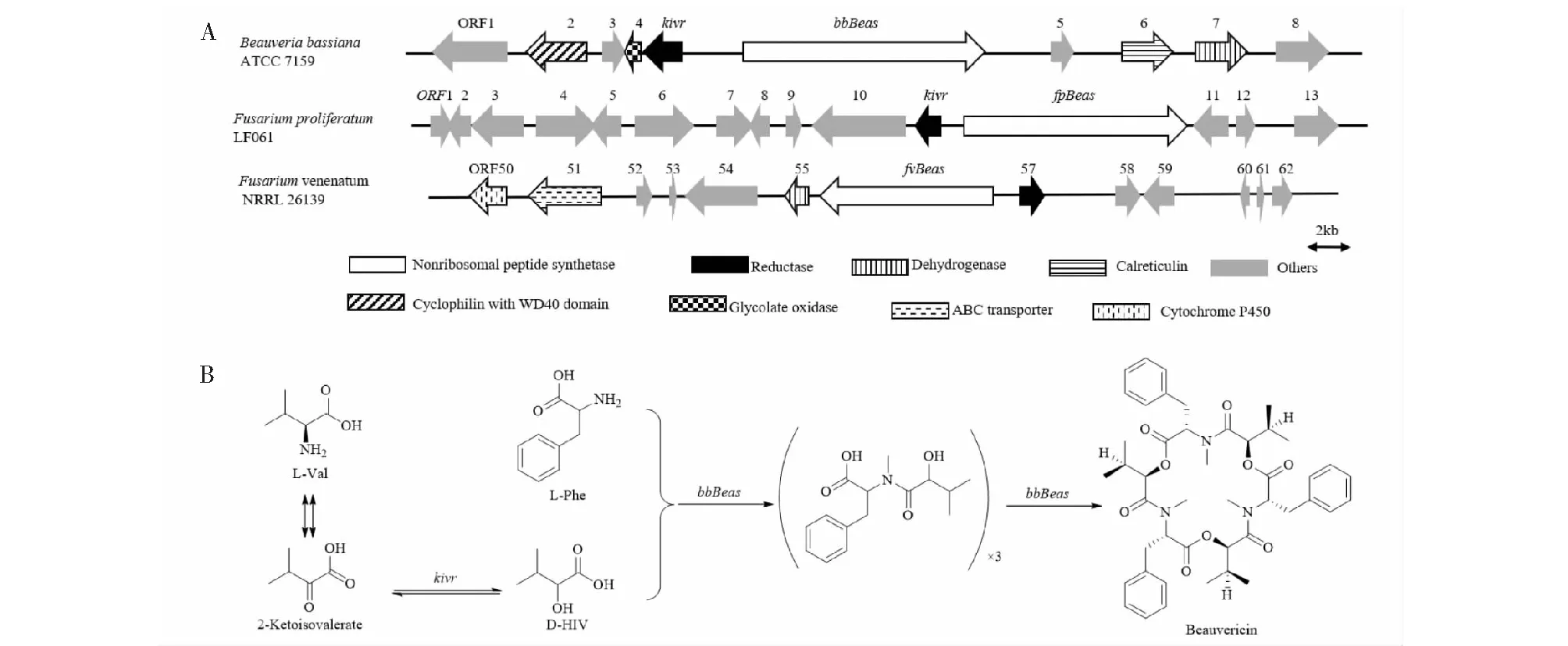
图6 白僵菌素生物合成基因簇(A)及其生物合成途径(B)Fig.6 Biosynthetic gene cluster of beauvericin (A) and biosynthetic pathway (B)
2.2 白僵菌交酯类化合物的生物合成
白僵菌中的白僵菌交酯化合物生物合成还未有研究,但Wang等[72]阐明了蛹虫草(Cordycepsmilitaris)中白僵菌交酯的生物合成基因簇,并推测其生物合成是在PKs-NRPs杂合装配线上完成的。BlastP分析发现了白僵菌中白僵菌交酯类化合物生物合成基因簇,与蛹虫草中相应基因簇基因的氨基酸序列的相似性到达72.9%(见图7A)。在其生物合成过程中,首先HR-PKS Cm3B催化乙酰辅酶A、丙二酸单酰辅酶A和SAM合成聚酮中间体,然后ATP依赖性乙酰辅酶A连接酶Cm3D将聚酮中间体转化为硫酯的形式,乙酰基转移酶Cm3C再将聚酮中间体转运至NRPS Cm3A中的第一个T结构域。Cm3A将聚酮中间体、L-苯丙氨酸、L-丙氨酸和D-亮氨酸(或D-allo-异亮氨酸)组装起来以形成beauverolide I(或beauverolide III)(见图7B)。
2.3 球孢交酯的生物合成
Xu等[73]最先克隆了球孢白僵菌的bbBsls基因,该基因编码一个非核糖体肽合成酶(NRPS),bbBsls基因缺失突变菌株不再产生球孢交酯说明bbBsls基因参与了球孢交酯的生物合成,尽管bbBsls基因所在基因簇的其他基因的功能仍未得到进一步的验证(见图8A),但可结合已知环缩肽生物合成机制和球孢交酯的结构特征和基因簇构成对球孢交酯的生物合成途径进行推测。在其假定的生物合成过程中,首先以D-2-羟基异戊酸(D-Hiv)和N-甲基-亮氨酸(N-Me-Leu)作为底物合成二肽中间化合物,然后球孢交酯合成酶通过对该中间化合物进行递归缩合来催化球孢交酯的形成(见图8B)。Boecker等[74]将bbBsls基因导入黑曲霉进行异源表达并喂养前体物质15 mMD-Hiv,将bbBsls基因成功表达且球孢交酯的产量达到378.77±59.74 mg/L。
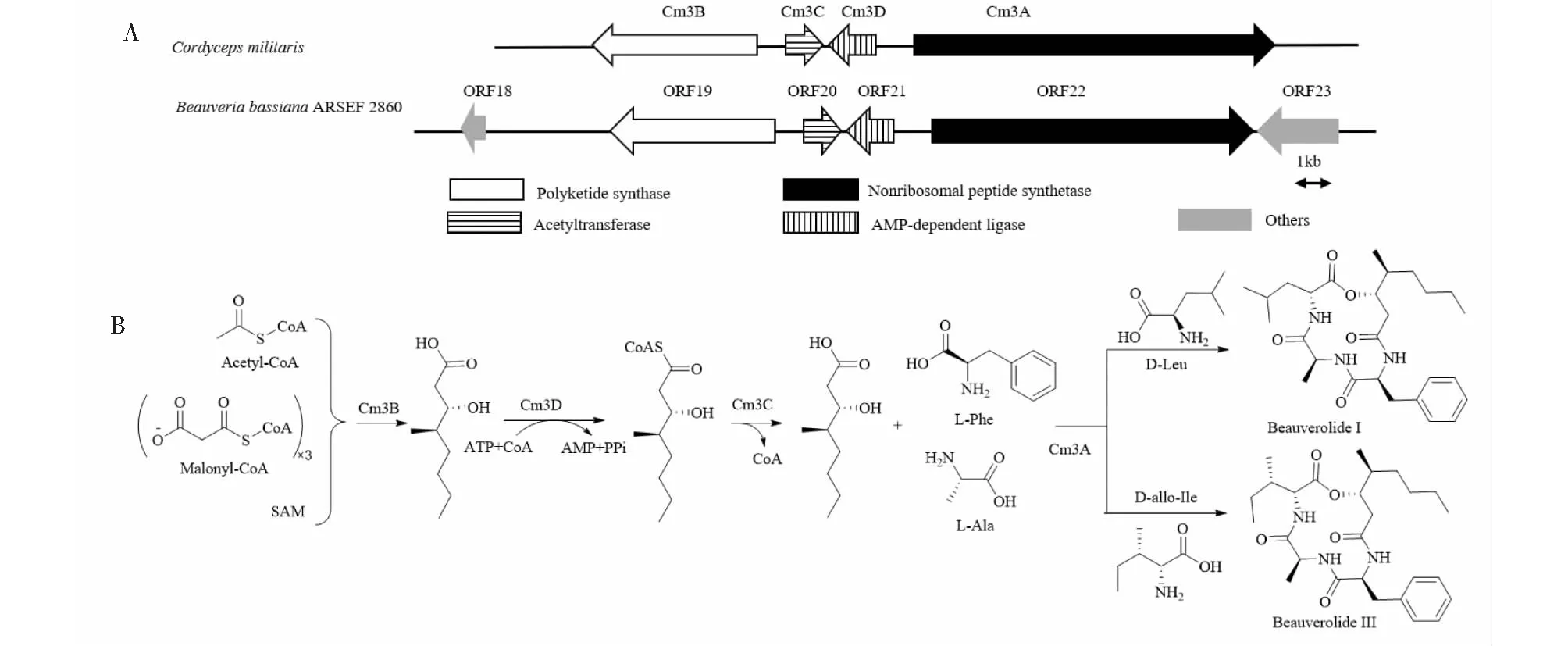
图7 白僵菌交酯类化合物生物合成基因簇(A)及生物合成途径(B)[72]Fig.7 Biosynthetic gene cluster of beauverolides (A) and the putative biosynthesis pathway (B)
2.4 卵孢素的生物合成
Feng等[75]首先阐明了卵孢素的生物合成途径,该途径涉及一个含有七个生物合成基因的基因簇(图9A),其中PKS卵孢素合酶1(OpS1)催化乙酰辅酶A和3个丙二酸单酰辅酶A生成苔色酸,苔色酸被羟化酶OpS4羟化为中间体6-甲基-1,2,4-苯三酚,该中间体可被非酶促氧化为5,二脱氧-卵孢素或被双加氧酶OpS7酶促氧化为6-甲基-1,2,4,5-苯四酚,6-甲基-1,2,4,5-苯四酚通过过氧化氢酶OpS5进一步二聚为卵孢素(图9B)。其中OpS3编码含有Gal4的Zn2Cys6结构域的转录因子,该基因的缺失会导致突变株中与卵孢素生物合成相关的其他基因表达失活,而OpS3的过表达则显著增强了基因簇其他基因的表达。此外,Bbsmr1可通过调节OpS3实现负调节作用[37],Bbmsn2则为pH依赖性负调节剂,可根据外界PH变化进行调整,以增加球孢白僵菌的毒力并促进菌株的生长[76]。
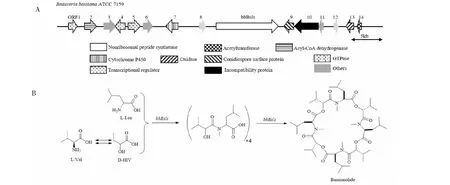
图8 球孢交酯生物合成基因簇(A)及其假定的生物合成途径(B)Fig.8 Biosynthetic gene cluster of bassianolide (A) and putative biosynthetic pathway (B)
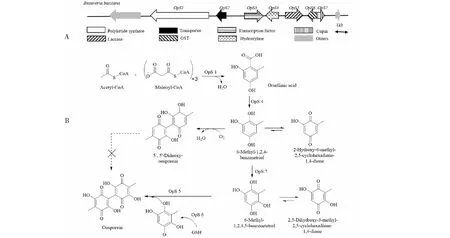
图9 卵孢素生物合成基因簇及其生物合成途径Fig.9 Biosynthetic gene cluster of oosporein and the biosynthetic pathway
2.5 纤细素的生物合成
早在2007年白僵菌纤细素的生物合成基因簇和生物合成途径就已经得到初步阐明(见图10A),PKS-NRPS合成酶TenS与NRPS合成酶TenS3的共同作用产生前体pretenellin-A[77]。Halo等[78]利用基因敲除、反义RNA和基因共表达等方法对卵孢素生物合成途径中最后一步进行验证,从而完善了纤细素的生物合成途径,其中TenS1编码的细胞色素P450氧化酶催化pretenellin-A发生氧化环扩展,使五元环结构形成2-吡啶酮六元环,形成化合物pretenellin-B,TenS2编码的细胞色素P450单加氧酶使2-吡啶酮环上的氮原子羟基化从而形成纤细素(见图10B)。BlastP分析表明TenS2属于细胞色素P450 N-单加氧酶的相对罕见类别,其作用机理与已知的氮原子羟基化的方式均不相同。此外,prototenellin-D是纤细素的支路代谢途径产物,可能是由基因组中未知基因编码的氧化酶催化的;15位羟基化的产物pyridovericin和15-hydroxytenellin的存在表明在球孢白僵菌中可能存在对聚酮化合物侧链的羟基化有选择性的其他细胞色素P450酶发挥作用,13-hydroxypretenellin-B可能与pyridovericin是同一或其他P450氧化酶的产物。研究还发现了一个非纤细素的生物合成簇内的甲基转移酶可催化15-hydroxyaltenellin N1-羟基的甲基化,而过表达簇内的特异性转录因子TenR后新发现包括甲基葡萄糖基化的产物在内的四个新结构的纤细素类化合物,纤细素 BGC外部的GT-MT(糖基转移酶-甲基转移酶)基因负责吡喃葡萄糖苷的形成[79]。Jirakkakul等[57]发现球孢白僵菌铁蛋白缺乏突变体中纤细素和铁-纤细素复合物的产量显著增加,说明铁蛋白和纤细素的生物合成之间的意想不到的联系可能是铁介导的氧化应激期间的生存策略。Heneghan等[80]通过用米曲霉amyB启动子替换其所有四个组成基因的启动子,在异源宿主米曲霉中实现了球孢白僵菌完整纤细素生物合成途径的受控表达,这样产生的纤细素的浓度是天然宿主的五倍以上。Yakasai等[81]研究了球孢白僵菌CBS110.25的代谢产物纤细素在表观遗传修饰剂5-氮杂胞苷和亚磺酰基双异羟肟酸的存在下以及在纤细素生物合成基因簇的个别基因被沉默的条件下的生物合成,发现合成了许多新化合物,这表明纤细素可能只是这条代谢途径上各种可能产物中的一种结果。上述研究为纤细素的生产应用奠定了理论基础。
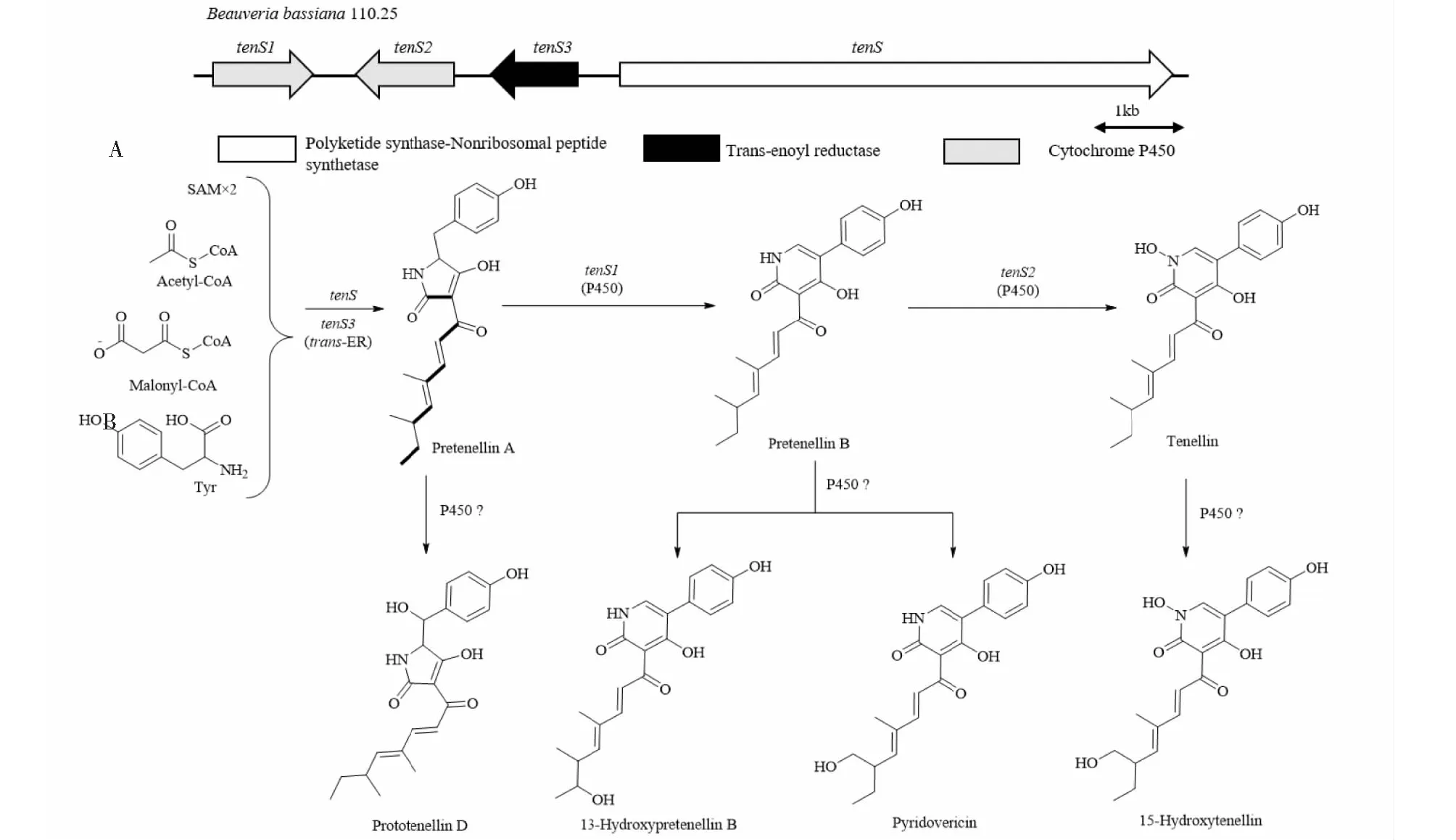
图10 纤细素生物合成基因簇(A)及其生物合成途径(B)Fig.10 Biosynthetic gene cluster of tenellin (A) and the biosynthetic pathway (B)
3 展望
白僵菌作为一类重要的昆虫病原真菌,具有强大的合成天然产物的潜力,能够产生结构类型多样的活性天然产物,包括肽类、聚酮类、生物碱类、苯丙素类、萜类、核苷类等,并表现出较好的抗肿瘤、杀虫、抗菌、抗炎等活性,其应用主要集中在生物防治、生物催化等领域。此外,在活性化合物生物合成机制方面,已在白僵菌属真菌中发现了白僵菌素合成酶基因bbBeas、球孢交酯合成酶基因bbBsls、卵孢素合成酶基因OpS2~OpS7和纤细素合成酶基因tenS分别是白僵菌素、球孢交酯、卵孢素和纤细素骨架结构生物合成的关键酶基因,白僵菌交酯类化合物在蛹虫草(Cordycepsmilitaris)中的生物合成机制得到阐明,其合成酶基因cm3负责该化合物的生成,但在白僵菌属真菌中的生物合成机制尚未得到研究证实。并且,白僵菌素和纤细素已通过异源表达策略使其产量获得大幅度的提高。在后基因组时代,合成生物学相关研究策略和技术的发展将大大促进白僵菌天然产物在药理活性应用和生物合成方面的研究,进而必将促进白僵菌来源的新结构活性天然产物的基因组挖掘和发现以及已知重要活性分子的开发应用。
