壳聚糖改性硅藻土除藻性能及生态安全性评价
2021-01-28赵益华贾凯悦季民赵迎新卢佳佳赵明杰
赵益华,贾凯悦,季民,赵迎新,卢佳佳,赵明杰
1. 天津生态城水务投资建设有限公司,天津 300467;2. 天津大学 环境科学与工程学院,天津 300350;3. 秦皇岛天大环保研究院有限公司,河北 秦皇岛 066000
由于人类的活动,河流、湖泊等地表水作为接纳各种污水的汇集地,环境承载能力日益变差,河道藻华爆发现象频发,严重影响水生态安全和人类健康(Xia et al.,2010)。2019年底公布的《2018年度中国环境状况公报》显示:全国开发利用程度较高和面积较大的107个重要湖泊(水库)中,富营养状态占湖泊总数的29%(中华人民共和国环境保护部,2019)。经过多年治理,中国城市水体的富营养化程度有所缓解,但由此带来的藻污染问题仍十分严重,目前藻污染现象已是中国面临的一项重大水环境问题(孔繁翔等,2005)。
目前,国内外学者对蓝藻水华的治理进行多方面研究,其中絮凝除藻的方法日益受到关注,尤其是藻华大规模爆发时,各类人工打捞工程由于成本的原因无法实施,絮凝除藻更显示出优势(邹华等,2004)。邹华等(2007)、潘纲等(2003)、Huang et al.(2000)利用壳聚糖对多种粘土进行改性,研究了其对铜绿微囊藻的去除效应,探讨了絮凝机理,取得了很好的效果;李凯等(2017)利用壳聚糖与海泡石复合对水华微囊藻进行去除,发现当复合比例为1∶8时,去除效率达到96.4%;季程晨等(2008)利用粉煤灰复配磁矿粉混合絮凝除藻,其投加量为200 mg·L-1时,处理率97.08%。
投加除藻剂后需要过高的搅拌力度是目前该方法被限制广泛应用的重要因素,此外絮凝剂的用量有所限制,生物毒性及对生态安全性评价缺乏研究,亟需开发一种高效、绿色、经济的除藻剂并对其研究。
为了解决现行除藻剂用量大、易产生二次污染的弊端问题,本研究拟结合城市河道等景观水体现状和水质特点,以壳聚糖改性硅藻土制备除藻剂提高絮凝除藻性能,降低使用量及成本消耗,在不危害水体中动植物体的前提下,一方面抑制藻类的产生,另一方面对产生的蓝藻进行消除,达到水质改善的目的,为该除藻剂后期应用提供有力依据。
1 材料与方法
1.1 实验材料
壳聚糖改性硅藻土除藻剂:天津大学环境科学与工程学院实验室制备。
藻液:铜绿微囊藻(Merismopedia aeruginosa),购自中国科学院水生生物研究所藻种库,后由天津大学环境科学与工程学院实验室经 BG-11培养基培养。
发光细菌:菌种为明亮发光杆菌 T3小种(Photobacterium phosephoremT3)。
绿色植物:菖蒲(Acorus calamusLinn.)、水竹(Phyllostachys heterocladaOliver.)、芦苇(Phragmites australisTrin.)、水葱(Scirpus validusVahl.),购自阿里巴巴,采自秦皇岛戴河生态园河水培养60 d,每隔7 d换一次水,每天进行8 h的曝气(雷泽湘,2006)。
草鱼(Ctenopharyngodon idellus):购自阿里巴巴,采自秦皇岛戴河生态园河水培养28 d,每隔7 d换一次水,每天进行8 h的曝气。
1.2 实验方法
1.2.1 水质检测
藻去除率:除藻前后藻液OD680之差与藻原液OD680的比值(藻密度以吸光度OD680表示)。
叶绿素(Chl-a)的测定:水样中藻细胞经0.45 µm滤膜抽滤后在4 ℃在用95%乙醇避光提取24 h,离心测其吸光度(国家技术监督局,1991)。
浊度的测定:取上清液于2100P便携式浊度仪测定同一样品,测定3次,取平均值。
1.2.2 毒性分析
藻毒素测定:高效液相色谱法(中华人民共和国国家质量监督检验检疫总局,2006)。
生物毒性检测:明亮发光杆菌 T3小种(Photobacterium phosphoremT3)冻干粉(中国科学院南京土壤研究所)检测药剂水样的生物毒性,其流程主要包括菌种的复苏及培养、试验准备、测定和计算结果(中华人民共和国国家环境保护总局,1995)。
植物生长情况表征:生物量为植株清洗后滤纸擦干称重所得;数根数;测量株高、根长是用直尺直接测量(程丽芬等,2017)。
草鱼生命活动表征:数其存活数量,观察眼部、尾部形态变化(Jiang,2009)。
1.2.3 表征方法
扫描电镜(朱丽霞等,1983):样品用2.5%戊二醛溶液固定1 h,磷酸缓冲液,后用Milloning 缓冲液清洗2—3次,用50%—100%的乙醇洗脱样品,每次停留约 10 min,干燥,真空喷金后于 Nova NanoSEM NPE218型扫描电镜下观察,摄影。
Zeta电位(ζ)(Xu et al.,2014):配制除藻剂和藻细胞悬浊液于Nano ZSP型Zeta电位仪测定。
1.2.4 絮凝除藻
采用400 mL处于对数期的铜绿微囊藻液,吸光度为 OD680>0.100 (±0.002),对应的藻密度为6.39×106ind·mL-1,达到水华爆发时的藻密度。分别投加10—100 mg·L-1的改性前后硅藻土除藻剂进行除藻实验,慢速搅拌(50 r·min-1)5 min,静置后于液面下2—3 cm处取样测定藻密度、叶绿素a、浊度。
1.3 数据分析
根据藻类生长情况的指标,可以计算出相对除藻率R。相对除藻率的计算公式如下:

式中,R为相对抑制率(%);C0为对照组的生长指标(OD680);Ct为试验组的生长指标(OD680)。
试验数据运用 Oringe 8.5软件进行整理和作图,运用SPSS软件进行方差分析和显著性检验,显著水平为P<0.05。
2 结果与讨论
2.1 改性硅藻土絮凝除藻性能
将改性硅藻土除藻剂进行400 mL的jar-test实验,投药后慢速搅拌(50 r·min-1)5 min,藻细胞相互聚集成絮体,静止后沉降。图1为实验中水样藻密度去除率随时间和投加量变化曲线。研究发现,在投加量为 10—30 mg·L-1的条件下,搅拌后絮体较小不易沉降;当投加量达 40 mg·L-1时,搅拌后形成明显絮体,静置0.5 h后,除藻率近80%,1 h后除藻率开始趋于稳定,均在90%以上,2 h后除藻率为95.2%。因此,在低搅拌强度的作用下,除藻剂仍有较高的除藻效果,在此之前尚未有文献报道在无快速搅拌条件有如此高的除藻效果。
将壳聚糖改性硅藻土制得的除藻剂与CuSO4、ClO2等传统除藻剂的除藻性能对比,如图2所示,结果表明,投加CuSO4、有机氯、ClO2等传统化学除藻剂后1 h藻细胞、叶绿素a与浊度的去除率均在 80%以上,但发光细菌的发光强度抑制率均高于75%,说明其毒性较高,易造成二次污染;而酶制剂等传统生物除藻剂发光细菌的发光强度抑制率虽低于30%,但投加后24 h藻细胞、叶绿素a与浊度的去除率仍低于 50%,说明其除藻性能差,见效慢,不适于应急。壳聚糖改性硅藻土除藻剂可避免传统除藻剂所带来的弊端,投加后1 h藻细胞、叶绿素a与浊度的去除率超过 90%,且发光菌的发光强度抑制率低于30%,实现高效快速、绿色除藻的目的。
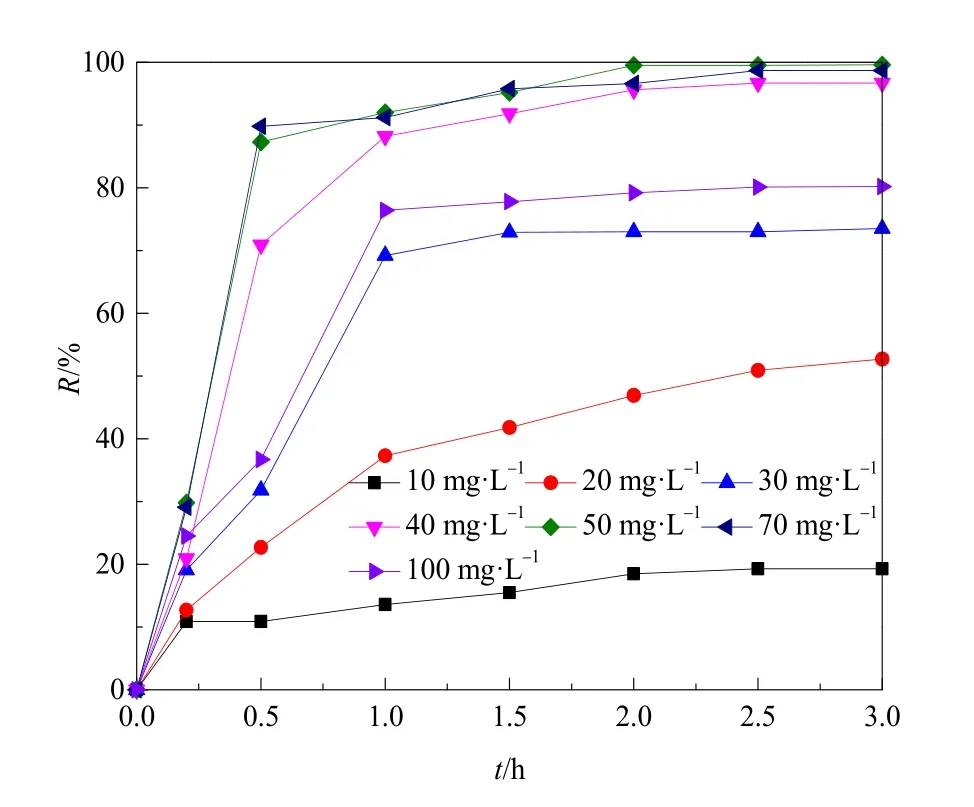
图1 投加除藻剂后藻去除率(R)变化Fig. 1 Variation of algae removal rate (R) after adding algaecide
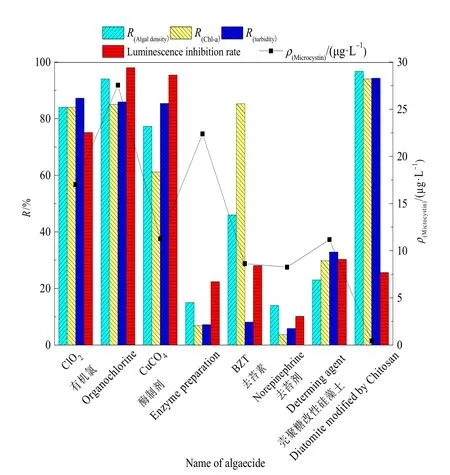
图2 改性硅藻土除藻剂与传统除藻剂的对比Fig. 2 Comparison between modified diatomite and traditional algaecide
2.2 表面电位对藻去除率的影响
图3为投加不同量的硅藻土及改性硅藻土后水体Zeta电位变化及除藻效率,图4为投加改性前后硅藻土除藻剂水体Chl-a去除率与剩余浊度变化。由图发现投加未改性的硅藻土投量为 100 mg·L-1时,除藻效率仅为10.7%,其Zeta电位为-32.7 mV;经壳聚糖改性后的硅藻土除藻剂投量为 40 mg·L-1时,除藻效率为95.2%,Chl-a去除率为94.1%,剩余浊度仅为4.6 NTU,其Zeta电位增加到-16.7 mV,当投加量为100 mg·L-1时,Zeta电位已增加到8.2 mV。经过改性,随着投加量的增加,Zeta电位也随之增加,藻密度及Chl-a的去除率明显提高,剩余浊度逐渐降低。

图3 投加改性前后硅藻土水体Zeta电位变化及除藻效率Fig. 3 Zeta potential change and algae removal efficiency of diatomite before and after modification

图4 投加改性前后硅藻土水体Chl-a去除率及剩余浊度Fig. 4 Removal rate of chlorophyll-a and residual turbidity in diatomite water before and after modification
前期实验表明铜绿微囊藻在水体中为负电性,其Zeta电位在-40.0 mV上下,且体积小,粒径约2.5 μm,不易沉降。未改性的硅藻原土表面通常也带负电荷,Zeta电位在-40.5— -34.0 mV之间,投加未改性的硅藻原土除藻效率不高,这是由于带负电荷的硅藻土在水中与同样带负电荷的藻细胞产生静电排斥作用而降低碰撞效率,藻细胞状态相对稳定,不易絮凝沉降,从而影响除藻效果。此外有研究表明改性材料壳聚糖在溶液中会发生质子化反应和水解反应(王闪等,2016;Morfesis et al.,2009),从而产生带正电荷的聚合离子,提高硅藻土表面 Zeta电位,与带负电的藻细胞发生静电中和,使得藻细胞脱稳絮凝成团,快速沉降去除,这与图3中投加改性硅藻土后,Zeta电位和除藻效率皆明显提升的结果一致。
图5为电镜下改性前后硅藻土的表面形态。可以看出经过改性后,硅藻土表面粗糙且空隙较大较多,比表面积增大,大量改性剂通过表面包埋负载修饰在硅藻土表面上。这是由于改性剂有一定黏性,且硅藻土具有较强的吸附性能(宋来洲等,2004),使二者得以更好的结合。
图6是沉降后藻絮体的电镜扫描图,发现可以看出颗粒状的藻细胞相对完整,无破裂现象;絮体间可看到网状结构使大量藻细胞聚集成团,这是改性硅藻土的网捕卷扫作用。本研究前期实验利用La3+提高硅藻土表面 Zeta电位除藻发现当投加量低于 3 g·L-1时除藻率仅不及 60%,结合相关研究(Benjamin et al.,2012)表明仅利用电性中和作用不足以使其高效除藻,由此看来,改性硅藻土发挥着电性中和与网捕架桥双重作用到达高效除藻的目的。
2.3 生态安全性评价

图5 硅藻土的扫描电镜图Fig. 5 Scanning electron microscopy of diatomite

图6 藻絮体的扫描电镜图Fig. 6 Scanning electron microscopy of algal flocs
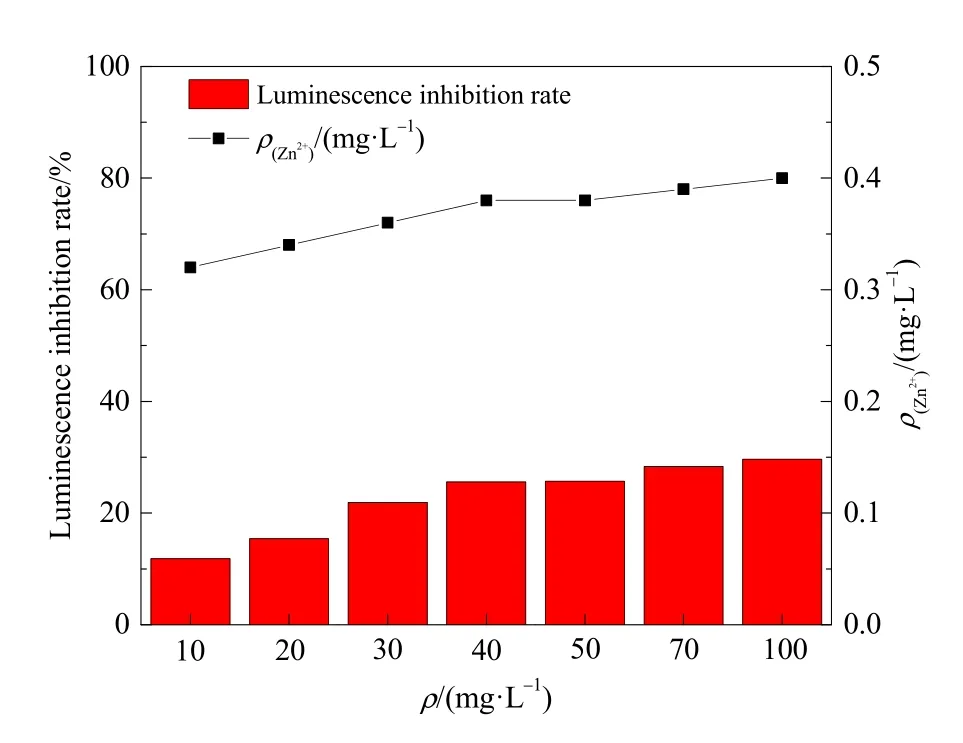
图7 壳聚糖改性硅藻土的生物毒性Fig. 7 Biotoxicity of diatomite modified by chitosan
以发光细菌的发光强度作为毒性指标,图7为发光菌在壳聚糖改性硅藻土制得除藻剂中的发光强度抑制率及除藻剂的参比毒物浓度,反映了其生物毒性。结果表明,随着除藻剂投量的增多,发光菌的发光强度抑制率有所增加但幅度不大,发光菌的发光强度抑制率均低于30%,最适投量40 mg·L-1时,发光菌发光强度抑制率仅为 25.6%,相当于 Zn2+质量浓度 0.38 mg·L-1,最大投量 100 mg·L-1时的发光菌发光强度抑制率仅为 29.2%,相当于 Zn2+质量浓度0.40 mg·L-1,根据国际标准ISO11348—1999中发光菌的发光强度抑制率<30%,毒性等级为Ⅰ级,属低度毒性风险。由于本研究制备的除藻剂所选用的原材料均为环保型材料,安全无毒,且投加除藻剂后水体pH值仍可保持在7.0—7.5之间,不影响水体酸碱平衡。
图8为投加壳聚糖改性硅藻土后铜绿微囊藻水样的藻毒素释放情况。结果表明,在改性硅藻土投加量小于 70 mg·L-1时,随着投加量的增加,细胞胞外藻毒素量逐渐升高,是由于在投加壳聚糖改性硅藻土后,通过网捕藻细胞絮凝沉降,微囊藻细胞因聚集摩擦受到稍许破坏,造成藻毒素释放,但释放量较低,仅不到1.0 µg·L-1。另外,当除藻剂投加量大于 70 mg·L-1时,胞外藻毒素质量浓度趋于平缓,由于投量过多藻液发生胶体再稳现象,藻细胞间不易聚集。

图8 藻毒素释放情况Fig. 8 Release of microcystin
综合2.1结论所述,在投加壳聚糖改性硅藻土除藻剂除藻时,并非投加量越高效果越好,而存在最佳投药浓度,壳聚糖改性硅藻土除藻剂对铜绿微囊藻治理的最适投量为40 mg·L-1,此时水样中藻毒素释放量仅为 0.087 µg·L-1;当投加量达 100 mg·L-1时,水样中藻毒素释放量开始趋于稳定,最高为0.181 µg·L-1,均低于国标规定的地表水源地微囊藻毒素MC-LR的标准限值1.0 µg·L-1。由较低的毒素释放量可以推测出该改性硅藻土未穿透藻细胞内部杀死藻细胞,而是通过表面相互聚集增大比重从而沉降除藻。
图9展示的是投加不同浓度的改性硅藻土除藻剂水培系统在实验开始和结束时测定的菖蒲、水竹、芦苇及水葱的根长、根体积、植株生物量、株高的变化情况。由图可知,对比未投加除藻剂的空白组,投加除藻剂后菖蒲的根茎生长并无明显异常,只有投加10 mg·L-1的除藻剂时根体积减少了4 mL,其他参数变化幅度均在2个单位值以内,当投加适量的除藻剂,其根茎生长量略高于空白组,可能由于适量除藻剂的投加抑制了水体藻类的滋生,为菖蒲减少了吸收氧气及养分的竞争者;相对于菖蒲,投加除藻剂对水竹根茎的生长浮动影响略微明显,除了对生物量的变化较小外,其他参数变化幅度均在4个单位值以内;投加除藻剂后芦苇的根茎生长并无明显异常,参数变化幅度均在2个单位值以内,且根部涨幅略有上升,说明除藻剂对芦苇的根部生长影响低于对茎部的生长影响;除藻剂对水葱的根部生长存在一些影响,但抑制作用较低,对比于未投加除藻剂变化幅度在2个单位值以内,不影响植株生长,水葱的茎部生长较快,两个月内平均增长了40 cm。
综上所述,在不同浓度投加条件下,4种挺水植物在收获时的生物量、株高、根长、根体积等形态指标均有明显的增长,且与空白组对比,其变化量小,均在4个单位值以内,水生植物生长情况无明显异常现象,说明壳聚糖改性硅藻土除藻剂对水生植物正常生长影响较小。

图9 壳聚糖改性硅藻土对4种绿色植物生长影响Fig. 9 The effect of Diatomite modified by Chitosan on the growth of four green plants

表1 壳聚糖改性硅藻土对草鱼生命活动影响Table 1 Effect of algaecide on life activities of grass carp
表1显示了投加不同浓度的壳聚糖改性硅藻土除藻剂后28 d对草鱼生命活动影响结果。当草鱼培养14 d时,空白对照组的草鱼死亡率与投加除藻剂后对应的草鱼死亡率均为零,表明该时段及除藻剂浓度水样对草鱼生命活动基本无影响。当草鱼培养21 d后,空白对照组的草鱼死亡率及投加壳聚糖改性硅藻土除藻剂浓度在 70 mg·L-1和 100 mg·L-1时对应的草鱼死亡率均高于投加除藻剂质量浓度在10 mg·L-1和 40 mg·L-1时对应的草鱼死亡率,说明适量浓度的除藻剂更有利于草鱼的生存。由于空白组未投加除藻剂,21 d后水体藻滋生严重,堵塞草鱼呼吸器官,阻碍草鱼正常生命活动;而投加浓度过高时,会影响水体的酸碱平衡,酸度多高会对草鱼的皮肤等器官造成一定的腐蚀。如图 10所示生存下来的草鱼体态样貌,观察无明显畸形病变,说明壳聚糖改性硅藻土的毒性较低,对草鱼正常生命活动无较大影响。
3 结论
(1)改性硅藻土仅慢速搅拌(50 r·min-1)5 min的条件下可有效地消除藻污染现象,最佳投量为40 mg·L-1,藻密度去除率为95.2%,Chl-a的去除率为94.1%,剩余浊度仅为4.6 NTU;对比几种传统除藻剂,改性硅藻土除藻剂既发挥着高效快速除藻的优势,同时避免了传统除藻剂毒性高、易造成二次污染的弊端。

图10 投加除藻剂后草鱼生命状态Fig. 10 Life state of grass carp after adding algaecide
(2)硅藻土经改性后表面Zeta电位明显提升,除藻率也随之提高。改性剂附着在硅藻土表面发挥着电性中和与网捕卷扫的双重作用,从而实现高效除藻的目的。
(3)利用发光细菌发光强度检测改性硅藻土急性生物毒性属于低毒性风险,且发现改性硅藻土并没有穿透藻细胞内部杀死藻细胞,其藻毒素释放量低于国家标准中对微囊藻毒素MC-LR的标准限值1.0 µg·L-1;且投加改性硅藻土除藻剂后,培养的水生动植物生长变化较空白组无明显异常,说明除藻剂对水体生态环境影响较小,具有绿色生态、环境友好型特点。
