高钾血症的疾病负担及预后
2021-01-28张相林
李 沭,张 倩,张相林
(中日友好医院药学部,北京 100029)
1 高钾血症概述
1.1 高钾血症的定义、临床表现及病因
高钾血症主要是人体血浆中的钾离子浓度高,患者可以表现为乏力、肢体麻木,最严重的表现为肌无力或肌麻痹、心脏传导异常及心律失常。高钾血症的常见病因包括以下3大类:(1)钾离子排泄减少,如慢性肾脏病(chronic kidney disease,CKD)进展至G4、G5期,或使用肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)抑制剂等药物导致的肾脏排钾减少;(2)钾离子分布失衡,如组织破坏(溶血、横纹肌溶解等)、恶性肿瘤、胰岛素缺乏和代谢性酸中毒等;(3)钾摄入过多,在正常健康人群中少见,常见的钾摄入增多引起的高钾血症多见于肾功能不全的患者[1]。
1.2 高钾血症的诊断标准
钾离子是人体细胞内主要的阳离子,其正常浓度为3.5~5.0 mmol/L[2]。在我国,血清钾离子浓度>5.0 mmol/L即可诊断为高钾血症(应注意与假性高钾血症的鉴别)。其次,应评估高钾血症的严重程度、有无危及生命的紧急状况。《中国慢性肾脏病患者血钾管理实践专家共识》[3]建议,根据血清钾离子浓度和是否存在心律失常等心电图变化,将急性高钾血症分为:(1)轻度,血清钾离子浓度为5.0~5.9 mmol/L,心电图无改变;(2)中度,血清钾离子浓度轻度升高合并心电图变化,或血清钾离子浓度为6.0~6.4 mmol/L、心电图无变化;(3)重度,血清钾离子浓度中度升高合并心电图变化,或血清钾离子浓度≥6.5 mmol/L。
目前,对于高钾血症诊断阈值的界定存在一定差异,随着对高钾血症疾病领域的深入研究,国际上已经开始将诊断阈值前移。一项纳入831 760例参与者的观察性研究结果指出,在CKD G1、G2期患者中,最优血清钾离子浓度为3.61~4.61 mmol/L,在此范围内死亡率可降低50%;在CKD G3期患者中,最优血清钾离子浓度范围扩大至3.51~4.87 mmol/L;而在CKD G4、G5期患者中,其最优的血清钾离子浓度范围为3.50~5.09 mmol/L[4]。2018年,一项血钾水平与肾脏不良结局的荟萃分析(Meta分析)中指出,血清钾离子浓度的最佳临床范围为4.0~4.5 mmol/L[5]。2019年,意大利肾脏病学会肾病患者管理指南也指出,CKD患者血液透析前血清钾离子浓度应保持在4.6~5.3 mmol/L范围内,腹膜透析前血清钾离子浓度应保持在4.0~4.5 mmol/L范围内[6]。当血清钾离子浓度>5.0 mmol/L时,应考虑为病理性血钾升高,血清钾离子浓度>5.0 mmol/L是心力衰竭患者死亡和终末期肾病的独立危险因素[6]。因此,近年来国外多部指南,如2016年加拿大心血管学会等的指南[7]、2019年意大利肾脏病学会肾病患者高钾管理指南[6]、2020年改善全球肾脏病预后组织(kidney disease: improving global outcomes,KDIGO)肾脏病血钾管理专家共识意见[8]和其他国际指南共识[9]均将高钾血症定义为血清钾离子浓度>5.0 mmol/L。
2 高钾血症的疾病负担
2.1 高钾血症的流行病学负担
2.1.1 高钾血症的发病率:目前,高钾血症在一般人群中的发病率约为2%~3%,在住院患者中的发病率约为1%~10%[10-11]。尤其当患者合并CKD、心力衰竭、糖尿病或使用RAAS抑制剂等药物时,高血钾症的发生率可显著升高[12-13]。2019年,Adelborg等[14]基于丹麦人群的大规模队列研究评估了2000—2012年157 766例CKD患者的高钾血症发生率(首次检测血清钾离子浓度>5.0 mmol/L),结果表明,在CKD确诊1年内,高钾血症的发病率为12.8%,而3年后则达到19.4%;高钾血症的发病率随着CKD的疾病进展而升高,CKD G4、G5期的患者中分别有31%、42%的患者在CKD诊断后的第1年内发生了高钾血症,首次发生高钾血症的中位时间为CKD诊断后的1.2年。我国全军合理用药监测网数据管理中心数据库的数据显示,2015—2017年我国全军门诊患者的高钾血症总体发生率为3.86%,在CKD、心力衰竭、糖尿病和高血压门诊患者中,高钾血症患者所占比例依次为22.89%、12.54%、7.11%和6.51%,均高于研究总人群的高钾血症发生比例,与欧美国家的报告一致[15]。
2.1.2 高钾血症患病率较高且反复发作:高钾血症曾被视为一过性疾病,但近年来的研究结果发现,对于CKD、心力衰竭、糖尿病等高钾血症高风险人群而言,高钾血症其实是一种长期持续的状态。反复发作的高钾血症是心血管疾病和肾功能受损患者全因死亡的严重危险因素之一[16-17]。2018年,一项对27个队列、1 271 986例参与者血清钾离子浓度的Meta分析结果显示,高血钾(血清钾离子浓度>5.5 mmol/L)的患病率为3.31%[5]。2019年,一项基于丹麦人群的大规模队列研究中发现,发生过1次高钾血症的患者中,43%的患者会发生第2次高钾血症,发生第3次乃至第4次高钾血症的概率则更高,分别为57%和64%,且高钾血症复发的时间间隔呈逐渐缩短的趋势[14]。上述结果与在丹麦心力衰竭人群中的研究结果一致[18]。2019年,针对日本住院患者的一项真实世界研究,纳入分析了2008年4月至2017年9月至少检测过1次血清钾离子浓度的1 022 087例患者,平均随访时间为2.74年,该研究结果显示,高钾血症在CKD人群中的患病率达23%,其中CKD G4、G5期患者的高钾血症患病率高达44%、51%;此外,该研究结果发现,高钾血症是一种长期持续的状态,>30%的患者的高钾血症持续反复发作(血清钾离子浓度≥5.1 mmol/L),且随着患者肾功能的恶化,高钾血症反复发作的风险也逐渐升高[11]。一项研究采用了“大数据分析”方法,对美国2007—2012年大型电子病历数据库(>700万例患者)进行全面分析,发现接受标准化RAAS抑制剂治疗的CKD患者中,32.8%的患者有过1次以上高钾血症发生,28.5%的患者有过1次以上轻度高钾血症发生,15.1%的患者有过1次以上中度至重度高钾血症发生[19]。
2.1.3 高钾血症发生/预测模型的探索:随着对高钾血症疾病的关注与了解,国际上开始尝试对高钾血症发生和复发的危险因素/预测模型进行相关探索。2007年,一项研究对所纳入的7 599例患者随访3.2年,探讨心力衰竭与高钾血症发生的预测风险,结果显示,高龄(>75岁),男性,基线血钾水平、肌酐水平高,肾衰竭、糖尿病、使用RAAS抑制剂的有症状的心力衰竭患者,其高钾血症发生风险增加[20]。2019年,一项研究量化了老年人非甾体抗炎药给药30 d急性肾损伤和高钾血症的风险模型,包括6个预测指标,即年龄、男性、较低的基线肾小球清除率、较高的血钾水平,血管紧张素转换酶抑制剂或血管紧张素Ⅱ受体阻断剂的使用或利尿剂的使用,预测的风险范围为0.05%~22.6%,灵敏度为2.6%~67.8%,特异性为64.1%~99.8%,该模型可通过在线计算器(https://qxmd.com/calculate-by-qxmd)使用[21]。
2.2 高钾血症的经济负担
2018年,Betts等[22]对美国医保数据库进行回顾性分析,评估了39 626例高钾血症(血清钾离子浓度>5.0 mmol/L)成年患者的经济负担。该研究结果表明,高钾血症发生1年后,总医疗保险费用增加了15 606美元(95%CI=14 648~16 576),其中患有CKD和(或)心力衰竭患者增加了25 156美元(95%CI=23 529~26 757);相比普通患者,患有高钾血症患者的卫生医疗资源利用率更高,其中包括住院治疗比率(30 d: 0.14 vs. 0.03;1年:0.44 vs. 0.19)、门诊就诊率(30 d: 3.33 vs. 28;1年:26.58 vs. 18.53)以及急诊就诊率(30 d: 0.16 vs. 0.06;1年:0.86 vs. 0.50)(P均<0.001);高钾血症患者的平均住院时间延长了1.51 d(95%CI=1.22~1.80),再次入院的可能性增加了40%。
2019年,一项基于整个丹麦北部人群的队列研究比较了2005—2011年首次发生高钾血症(血清钾离子浓度>5.0 mmol/L)的CKD、心力衰竭和糖尿病患者在高钾血症发生前6个月和发生后6个月的医疗费用[23]。该研究结果显示,发生高钾血症的CKD患者中,平均住院人数增加比率从发生高钾血症前6个月的0.8增加到发生高钾血症后6个月的1.2,心力衰竭患者相应的住院发生率从1.3增至1.5;CKD患者发生高钾血症后费用增加了71%,心力衰竭患者增加了52%,糖尿病患者增加了70%;在CKD和糖尿病人群中,与轻度高钾血症(血清钾离子浓度>5.0 mmol/L)患者相比,患有更严重高钾血症(血清钾离子浓度>5.5 mmol/L和血清钾离子浓度>6.0 mmol/L)患者的平均住院费用更高。同年,Mu等[24]在2010—2014年美国国家老年人医疗保险人群中观察到,与无高钾血症的患者比较,患有高钾血症的老年患者在30 d内的平均总医疗费用高出7 608美元,年平均医疗费用高出21 205美元。
3 高钾血症的预后
3.1 高钾血症增加心血管不良事件发生及死亡风险
高钾血症急性发作可引起严重的心脏损伤[25]。其导致患者死亡的机制可能是诱发致命性心律失常[26]。Hoppe等[27]对涉及310 825例参与者的24个研究进行了Meta分析,结果显示,在急性心肌梗死患者中,高钾血症的存在增加了室性心律失常的风险(风险比为3.22,95%CI=1.60~3.38)。2019年,Xi等[28]对7个队列研究进行了Meta分析,结果显示,与对照组(血清钾离子浓度为3.5~4.0 mmol/L)相比,血清钾离子浓度≥5.0 mmol/L的急性心肌梗死患者的死亡风险为1.85(95%CI=1.39~2.47)。多项研究结果表明,血钾水平与心力衰竭患者病死率之间呈现U型曲线关系。观察性研究结果显示,基线血清钾离子浓度与患者心血管事件发生率及死亡率呈U型曲线,见图1。高钾血症的发作速度、持续时间及患者的血钾水平均与危重疾病患者的不良预后相关。通过名为健康伙伴的医疗管理组织获取2009年1月至2013年6月55 266例CKD患者[估算肾小球滤过率<60 ml/(min·1.73 m2)]的电子记录并进行回顾性观察,结果显示,患者主要心血管不良事件(major adverse cardiovascular events,MACE)发病率及死亡率与血钾水平之间呈U型曲线,当血清钾离子浓度>5.0 mmol/L,患者死亡率即开始升高,当血清钾离子浓度≥6.0 mmol/L,患者死亡率升高达3.31倍,MACE发病率升高1.88倍[29]。
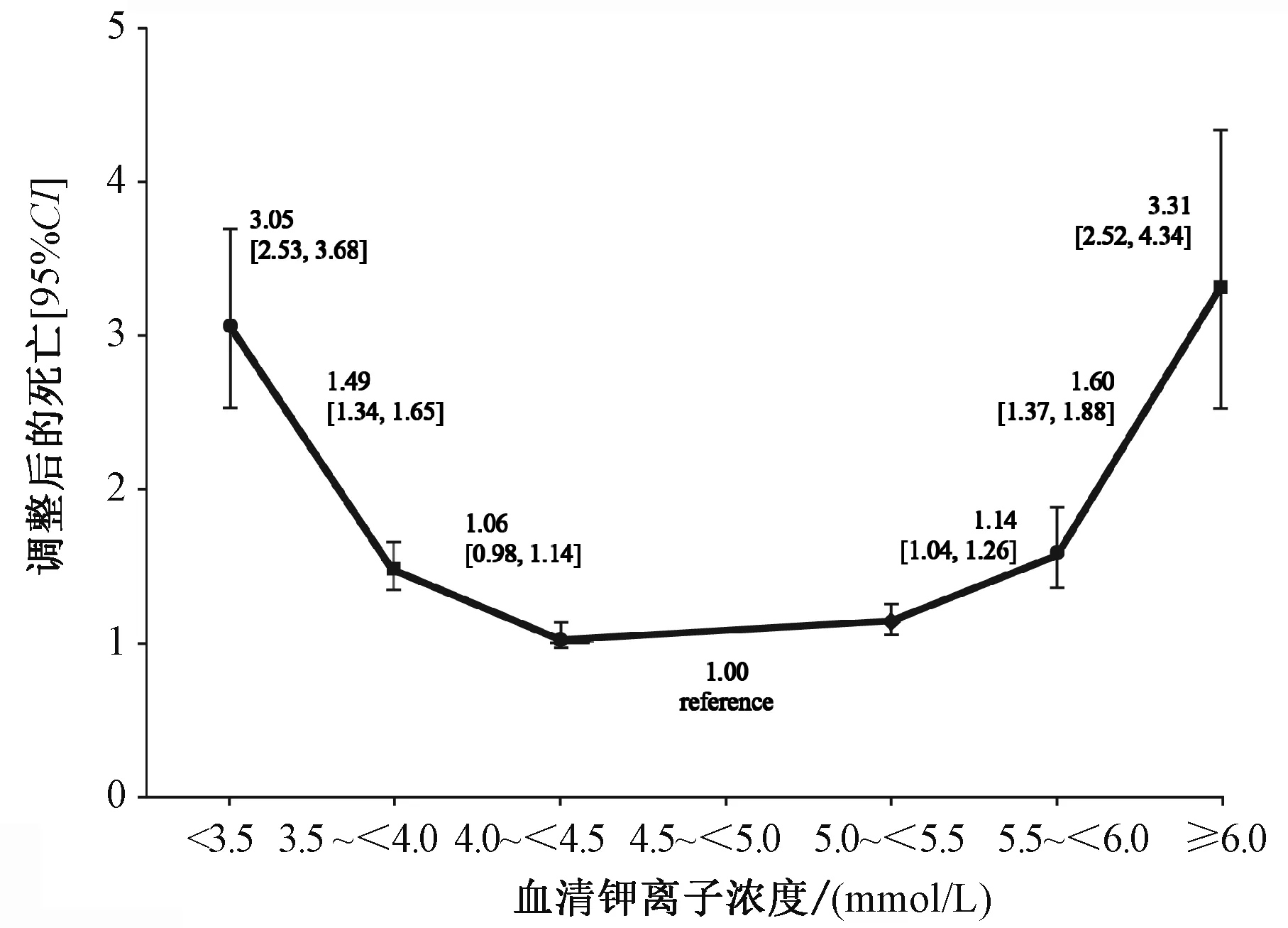
在Poisson回归模型中,针对患者年龄、性别、种族,糖尿病、充血性心力衰竭、冠状动脉疾病、脑血管意外和β受体阻断剂、非二氢吡啶钙通道阻滞剂、袢利尿剂、噻嗪类利尿剂、RAAS抑制剂的使用,对心血管事件发生率、死亡率进行了调整;每种血清钾离子浓度的估计值具有95%置信区间in the Poisson regression model, the incidence and mortality of cardiovascular events were adjusted by age, gender, race, diabetes, congestive heart failure, coronary artery disease, cerebrovascular accident and the use of beta blockers, non dihydropyridine calcium channel blockers, loop diuretics, thiazide diuretics and RAAS inhibitors; the estimated value of each serum potassium ion concentration has a 95% confidence interval图1 血清钾离子浓度与死亡率之间的关联Fig 1 Correlation between serum potassium concentration and mortality
3.2 高钾血症增加肾脏疾病不良预后的发生
美国一项回顾性分析评估了不同人群中血钾水平与全因死亡率之间的相关性,该研究分析了来自不同地区的911 698例患者的电子病历数据,随访18个月,结果显示,高钾血症可增加CKD、心力衰竭、糖尿病以及无合并症患者的死亡风险,与其他疾病人群相比,CKD患者死亡率受血钾水平变化的影响更大[12]。上述结果与既往相关研究的结论一致[30-31]。
2018年,Kovesdy等[5]对27个国际队列进行Meta分析,以评估血钾水平与CKD不良结局之间的关系,结果显示,血清钾离子浓度与CKD不良结局风险的关系呈U型曲线,与4.2 mmol/L的参考值相比,血清钾离子浓度为5.5 mmol/L的患者全因死亡率的风险比为1.22(95%CI=1.15~1.29)。研究结果显示,进行血液透析的慢性肾衰竭患者中,透析前血钾水平升高是患者死亡率较强的独立预测指标,血清钾离子浓度>5.6 mmol/L与患者的死亡率呈正相关[32]。而在腹膜透析患者中,相关研究也得出了同样的结论[4]。
3.2.1 高钾血症增加RAAS抑制剂停药风险:对于CKD患者而言,RAAS抑制剂在控制血压的同时,可有效降低蛋白尿水平,早期应用可有效延缓CKD向终末期肾病进展,因此,CKD患者使用RAAS抑制剂获得了多项指南推荐。但CKD患者在使用RAAS抑制剂时,因抑制了醛固酮分泌,容易发生高钾血症,导致RAAS抑制剂停用或减量[33-34]。Palaka等[35]于2019年发表的一项纳入123个研究的系统综述结果显示,血清钾离子浓度为5.5~5.9、≥6.0 mmol/L患者的RAAS抑制剂停药风险是血钾水平正常(血清钾离子浓度为4.5~4.9 mmol/L)患者的1.47、2.79倍,且停药风险随高钾血症严重程度增加而增加。相关研究结果表明,RAAS抑制剂的停药或使用不足量使CKD G3、G4期,糖尿病和心力衰竭患者的不良心肾结局发生率和死亡率显著升高[34,36]。
3.2.2 高钾血症与肾脏疾病进展:荷兰的一项事后分析纳入了1 338例伴有肾病和2型糖尿病的患者,评估血钾水平对肾脏结局的影响,结果表明,随着血钾水平的升高,患者肾脏疾病进展(血肌酐水平翻倍或发展为终末期肾病)的风险增加[37]。2018年,Provenzano等[38]对2 443例非透析肾脏疾病患者的多中心队列研究结果显示,相比高钾血症缓解、无高钾血症的患者,慢性、新发高钾血症的患者进展为终末期肾病的风险升高30%。从病理机制角度推断,当血钾升高时,抑制近端小管氨的生成和髓质转移,由此导致的代谢性酸中毒可能会促进CKD的疾病进展。此外,有研究结果表明,治疗代谢性酸中毒可延缓肾脏疾病的发展[39]。
4 总结
高钾血症是CKD及心力衰竭,特别是CKD G4、G5期患者常见的并发症,一旦急性发作,会导致心律失常等严重危害。而且,高钾血症是一种长期持续的状态,容易反复发作,且复发率高、复发间隔逐渐缩短,增加了个人和社会的经济负担,同时增加了严重心血管疾病和肾脏疾病的不良预后及死亡的风险。
目前,高钾血症的纠正期治疗主要包括去除高钾血症的病因、保护心脏(钙剂)、促进细胞外钾离子转移至细胞内和清除体内钾离子(利尿剂、阳离子交换树脂、环硅酸锆钠等新型钾离子结合剂等)等方法。维持期的治疗主要包括低钾饮食控制、停用或减量RAAS抑制剂、应用小剂量利尿剂、纠正酸中毒、定期透析和口服传统或新型钾离子结合剂等方法[40]。
高钾血症作为CKD患者的“隐形杀手”,需要通过定期监测血钾水平、低钾饮食和口服药物控制等慢性管理手段,长期维持血钾水平的稳定,以真正达到预防高钾血症反复发作、提高患者生活质量的目的。
