脊髓过表达KCC2对大鼠吗啡耐受中NMDAR和PKC表达的影响
2021-01-20闵继斌叶先才王志坚刘胜兵
闵继斌,叶先才,王志坚,刘胜兵
(1.嘉善县中医院,浙江 嘉兴 314100;2.嘉兴学院医学院,浙江 嘉兴 314000)
吗啡及其衍生物是临床解除疼痛的主要药物,是临床应用广泛的镇痛药,长期应用吗啡后其镇痛效果会渐弱,出现吗啡耐受,甚至痛觉过敏。KCC2参与Cl-稳态,成熟神经元胞内的氯离子外排作用可以使成熟神经元胞内保持低氯离子浓度,从而使γ成氨基丁酸离子型受体发挥抑制性作用。KCC2参与各种病因导致的痛觉过敏,脊髓损伤可以引起神经系统KCC2表达改变[1]。脊髓损伤等可以导致脊髓中运动神经元胞膜的KCC2表达下调,引起Cl-在细胞内聚集。研究发现脊髓KCC2表达变化与炎性痛或一些病理性疼痛相关[2-3]。大鼠吗啡处理后,KCC2在脊髓的表达可明显降低。基因治疗是作为靶向性的生物基因治疗方法,其具有较强的靶向性。用编码人类神经营养因子3腺相关病毒(AAV-NT3)治疗脊髓T9段受伤的大鼠,AAV-NT3基因治疗同运动结合减缓脊髓损伤后肌肉痉挛[4]。通过在脊髓鞘内注射病毒包装的KCC2,从而在脊髓过表达KCC2,从而有效缓解神经损伤导致的疼痛过敏。脊髓过表达KCC2后是否对吗啡耐受产生影响及相关机制尚未有研究[5]。本研究通过大鼠脊髓鞘内递送KCC2,使其在脊髓过表达,检测相关通路蛋白表达,探讨KCC2过表达延缓吗啡耐受的相关机制。
1 材料与方法
1.1 材料
DMEM培养基和胎牛血清(Gibco),invitrogen lipofectamine 2000 转染试剂盒(Invitrogen),苯巴比妥钠(上海上药新亚药业有限公司),吗啡(东北制药集团沈阳第一制药有限公司),250-300g雄性SD大鼠(浙江省实验动物中心),KCC2抗体、NMDAR抗体和PKC抗体(Cell signaling technology)。
1.2 方法
1.2.1 过表达腺病毒载体构建,转染细胞:构建腺病毒载体后,将对数生长期的293T细胞制成细胞悬液,计数,接种接种于24孔培养板(细胞数为2×104)37℃、5%CO2培养箱培养至细胞融合度达到约80%。根据invitrogen lipofectamine 2000转染试剂使用说明,加入适量质粒和转染试剂。6 h后观察细胞状态,更换为新鲜的完全培养基。转染24~48 h后观察质粒上荧光标记基因的表达情况。
1.2.2 腺病毒感染后的表达检测:取不同剂量腺病毒原液,加入到HEK293细胞中,24~48小时后观察细胞生长情况,收集细胞、提取蛋白,供western blot检测实验使用。
1.2.3 实验分组及脊髓插管模型制备:30只SD雄性大鼠随机分为三组,Ⅰ组为KCC2基因治疗组,Ⅱ组为GFP对照组,Ⅲ组为空白对照组,每组大鼠为10只。戊巴比妥钠(4 mg/100g)腹腔注射,待麻醉后固定四肢,消毒颈部去毛后,在两耳中线下分离肌肉到寰枕后膜,针头挑破后,见脑脊液。PE-10导管经寰枕后膜插入至脊髓腰椎膨大部止,PE-10管体外部分用石蜡封口,防止脑脊液流出。Ⅰ组大鼠鞘内注射病毒上清液(108/ml)20μL,Ⅱ组鞘内注射control vector20μL,Ⅲ组鞘内注射生理盐水20μL。2周后,各组通过脊髓置管吗啡,每日2次。吗啡注射量为15 ug/kg,连续7 d。
1.2.4 Western检测脊髓KCC2、NMDAR和PKC表达:取各组大鼠4只,苯巴比妥钠经腹腔注射麻醉,冰上迅速分离脊髓,取脊髓L4/5段,超声破碎脊髓,常规方法提取组织蛋白;SDS-PAGE凝胶电泳后,蛋白转移到PVDF膜上(100 V,120 min),5%脱脂牛奶封闭1 h,孵育一抗(KCC2)兔抗,4℃过夜,TBST洗一抗(5 min/次,3次),孵育二抗(羊抗兔,37℃,2 h),TBST洗二抗(5 min/次,4次),ECL试剂盒曝光显色。
1.3 统计学处理
统计学分析用SPSS 19.0软件进行,正态分布的计量资料用均数±标准差(±s)表示,结果用t检验,P<0.05为差异有统计学意义。
2 结 果
转染24~48 h后观察质粒上荧光标记基因的表达情况,荧光率大于80%。见图1,图2。

图1 15 ul(100×)
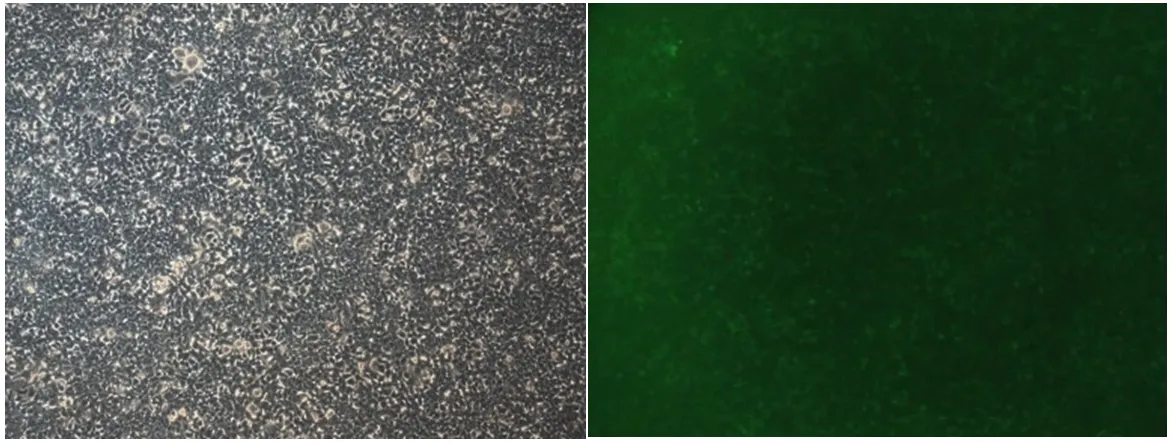
图2 30 ul(100×)
取不同剂量腺病毒原液,加入到HEK293细胞中,24~48小时后观察细胞生长情况,收集细胞、提取蛋白,western blot检测。用Flag抗体检测到130-180KD之间存在特异性条带,KCC2基因融合蛋白大小:127 KDa。见图3。

图3
KCC2腺病毒包装KCC2基因鞘内注射2周后,western blot检测,脊髓KCC2表达明显升高。见图4。

图4
吗啡处理后,KCC2基因脊髓鞘内注射组,western blot检测,NMDAR表达下降。见图5。

图5
吗啡处理后,KCC2基因脊髓鞘内注射组,western blot检测PKC表达下降。见图6。
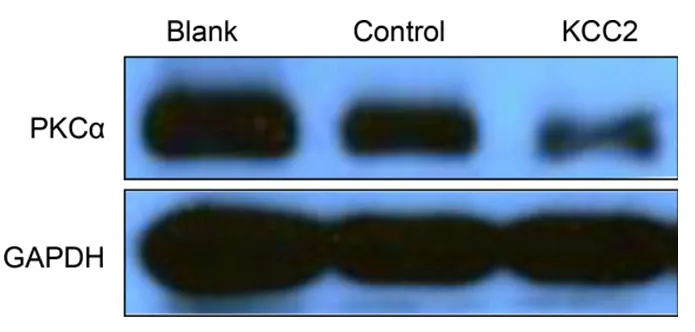
图6
3 讨 论
研究发现,通过脊髓鞘内注入慢病毒包装的KCC2,在脊髓过表达KCC2后,可以恢复神经损伤而影响的Cl-稳态,恢复Cl-稳态抑制由于神经损伤导致的脊髓NMDAR活化,从而有效缓解神经损伤导致的疼痛过敏[5]。脊髓过表达KCC2后是否对吗啡耐受产生影响的研究,可以有效联系疼痛过敏与吗啡耐受,具有现实意义。兴奋型氨基酸(Excitatory amino acid,EAA)是中枢神经系统重要的神经递质,NMDAR是一种EAA受体,由不同亚单位组成四聚体或五聚体,NMDAR通常高表达在吗啡耐受中,NMDAR参与了脊髓鞘内吗啡耐受中的作用,NMDAR参与吗啡耐受的过程与胞内胞浆Ca2+释放及PKC激活有关,并对G蛋白的表达产生一定的影响,Ca2+激活PKC、PKA及CaMKII等。有研究表明抑制PKC或其他蛋白激酶的激活能够延缓或减轻大鼠因重复给药导致的吗啡耐受和依赖[6-7]。阿米替林可以通过PSD-95/NMDAR /nNOS/PKC通路缓解吗啡耐受,表现为突触NMDAR的表达下调,抑制PKC的表达[8]。吗啡耐受过程中NMDAR活化,故通过KCC2基因脊髓鞘内注射,在脊髓过表达KCC2来抑制吗啡耐受中NMDAR的活化。本研究发现,KCC2过表达后进行吗啡耐受处理,NMDAR和PKC表达下调,初步说明NMDAR和PKC参与KCC2过表达后的吗啡耐受调节,其更深的机制,还需进一步探讨。
