棉花转录因子基因GhMYBPA1的克隆及表达分析
2021-01-08张安红赵战胜王志安肖娟丽罗晓丽
张安红,赵战胜,王志安,肖娟丽,刘 圆,罗晓丽
(1.山西农业大学(山西省农业科学院)棉花研究所,山西 运城 044000;2.棉花种质资源利用与分子设计育种山西省重点实验室,山西 运城 044000;3.新疆生产建设兵团第六师农业科学研究所,新疆 五家渠 831300)
类黄酮(Flavonoids)是一类多酚类次生代谢产物,其不但参与植物的花、果实和种子颜色的形成,而且在抵御逆境胁迫、抗氧化、抗衰老等方面发挥着较大的作用[1]。植物类黄酮生物合成主要受结构基因和调节基因两类基因的控制。目前,调控类黄酮生物合成的调节基因已在葡萄、拟南芥、玉米、金鱼草、矮牵牛、苹果等多种植物中被克隆得到,而且这些调节基因大多属于编码MYB、MYC、bZIP、WD40和锌指蛋白等的基因家族[1-4],其中,MYB类转录因子是植物中数量最大、功能多样化的转录因子之一,也是花青苷(一种黄酮类化合物)合成途径中重要的调控因子,主要调控花青素上游结构基因的表达,在植物生命活动中扮演着重要的角色[5-6]。MYB蛋白根据保守结构域的个数分为R1-MYB、R2R3-MYB和R3-MYB共3类[7-8],其中,R2R3-MYB主要参与调控花青苷合成途径[9]。近年来,棉花MYB转录因子的研究已在非生物胁迫的功能研究方面取得较大进展,但是关于GhMYBPA转录因子研究还相对较少。高巍等[10]对海岛棉转录因子基因GbMYB60研究发现,该基因受甘露醇、NaCl、低温、高温等非生物逆境以及脱落酸、乙烯利、茉莉酸甲酯和水杨酸等植物激素的诱导上调表达。丁震乾等[11]研究发现,抑制GhRAX3基因表达致使棉花叶片相对含水量和总抗氧化物酶活性显著降低,叶片离子渗漏率和丙二醛含量显著升高,使棉花耐干旱胁迫能力下降。李菲等[12]克隆了棉花GhMYB11基因,该基因在黄萎病菌侵染以及在干旱、盐和氧化胁迫处理后的棉花幼苗叶片中表达显著上调,推测GhMYB11基因可能在棉花生物和非生物胁迫反应中起重要调控作用,是陆地棉品种抗逆性遗传改良的重要候选基因。胡雪虹等[13]研究发现了1个新的MYB类转录因子,克隆并命名该基因为GbMYB5,对该基因进行表达分析,结果表明,其在棉花的茎、叶、蕾、絮和未成熟的种子中均有表达,尤以叶片中的表达量最高,说明MYB类转录因子具有较强的抗逆功能。MYBPA是调控黄酮类次生代谢物质原花青素合成途径的主要MYB转录因子之一,在器官形态建成、激素和逆境因子应答等过程中起重要的作用[14-15]。
本研究从陆地棉品种中棉35中克隆到1个新的MYB基因,命名为GhMYBPA1(基因登录位点为XM_016869420),利用生物信息学分析了其核苷酸序列以及编码的氨基酸序列,并通过实时荧光定量PCR技术分析了该基因在不同组织及逆境胁迫下的表达模式,旨在为进一步研究该基因在抗逆过程中的功能奠定基础。
1 材料和方法
1.1 试验材料
供试材料为陆地棉品种中棉35,由山西农业大学棉花研究所生物技术室保存。
1.2 试验方法
1.2.1 植物材料培养与处理 棉花种子经硫酸脱绒后播种于装满蛭石的营养钵中,在(26±2)℃的温室中进行萌发和生长;待棉花幼苗长出2片真叶时,分别随机采取部分棉花的根、茎、叶以及棉花生长发育的花期分别采集花,用于不同组织基因的表达分析。另外,选取长出3片真叶生长一致的棉花,分别对幼苗进行NaCl(200 mmol/L)处理、低温(4 ℃)处理和20%的PEG 6000处理,于0(CK),1,3,6,12 h分别收集盐、低温、干旱胁迫处理的幼苗,用于检测基因的非生物胁迫响应。材料取样后进行液氮速冻,置于-80 ℃冰箱保存,备用。
1.2.2 总RNA提取和cDNA制备 参照文献[16]的方法进行,利用TRIzol试剂提取棉花不同胁迫处理时间的幼苗总RNA。单链cDNA合成参照SuperScriptTMⅢ First-Strand Synthesis System试剂盒操作说明书进行,用于基因克隆和定量PCR分析。
1.2.3 棉花GhMYBPA1基因克隆 根据GenBank中已公布的棉花GhMYBPA1(2016年公布的GhMYBPA1XM_016869420)基因序列信息合成引物GhMYBPA1-F(5′-ATGGCAGAGCACCTTGTTG-3′)和GhMYBPA1-R(5′-TTAAATGAGTAGTGATTCGGCG-3′),以提取的棉花cDNA为模板进行PCR扩增。PCR扩增程序:95 ℃预变性3 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸80 s,共35个循环;最后72 ℃延伸10 min。扩增产物经1%琼脂糖凝胶电泳检测,并进行凝胶回收、纯化,后与pMD19-T载体连接、转化大肠杆菌感受态细胞、阳性克隆筛选及菌落PCR的鉴定,将阳性菌落送交上海生工生物工程公司进行测序。
1.2.4 棉花GhMYBPA1基因的生物信息学分析 采用DNAMAN软件进行多序列比对和保守性分析;采用MEGA 5软件构建系统进化树;通过在线分析软件ProtParam tool(http://expasy.org/protparam/)分析目的蛋白的理化性质。
1.2.5 实时定量PCR(qRT-PCR)分析 设计GhMYBPA1基因引物F(5′-AGATCAACTGGTTATGCTT GCT-3′)和R(5′-AACACAAATGTACATCGCACAC-3′)。以棉花基因Ubiquitin(登录号为AY189972)作为内参基因,扩增引物为F(5′-AAGACCTACACCAAGCC CAAG-3′)和R(5′-ACACTCCGCATTAGGACACTC-3′)。以棉花根、茎、叶和花及各个胁迫处理时间点的样品cDNA为模板进行PCR扩增,分析GhMYBPA1基因的组织表达模式及不同非生物胁迫下的表达模式。qRT-PCR所用的反应体系为25 μL。扩增条件:95 ℃预变性1 min;95 ℃变性10 s,53 ℃退火30 s,72 ℃延伸30 s,共40个循环。每个试验重复3次,并采用2-ΔΔCt计算方法求得棉花根、茎、叶、花和不同逆境胁迫处理下样品的相对表达量。
2 结果与分析
2.1 GhMYBPA1基因全长cDNA克隆及生物信息学分析
根据GenBank中已公布(基因登录位点为XM_016869420)的棉花GhMYBPA1基因序列信息合成引物,从提取的棉花cDNA中克隆得到GhMYBPA1基因的全长序列,GhMYBPA1全长cDNA为825 bp(图1),其中,编码序列CDS 630 bp,编码210个氨基酸,3′和5′端非编码区分别为150,160 bp。预测分子质量约为20.183 ku,等电点为6.42。氨基酸序列比对结果发现,GhMYBPA1序列中包含2个保守结构域,分别位于第13-63位和第66-114位氨基酸,属于R2R3型MYB转录因子(图2)。
图1 棉花GhMYBPA1基因扩增片段大小
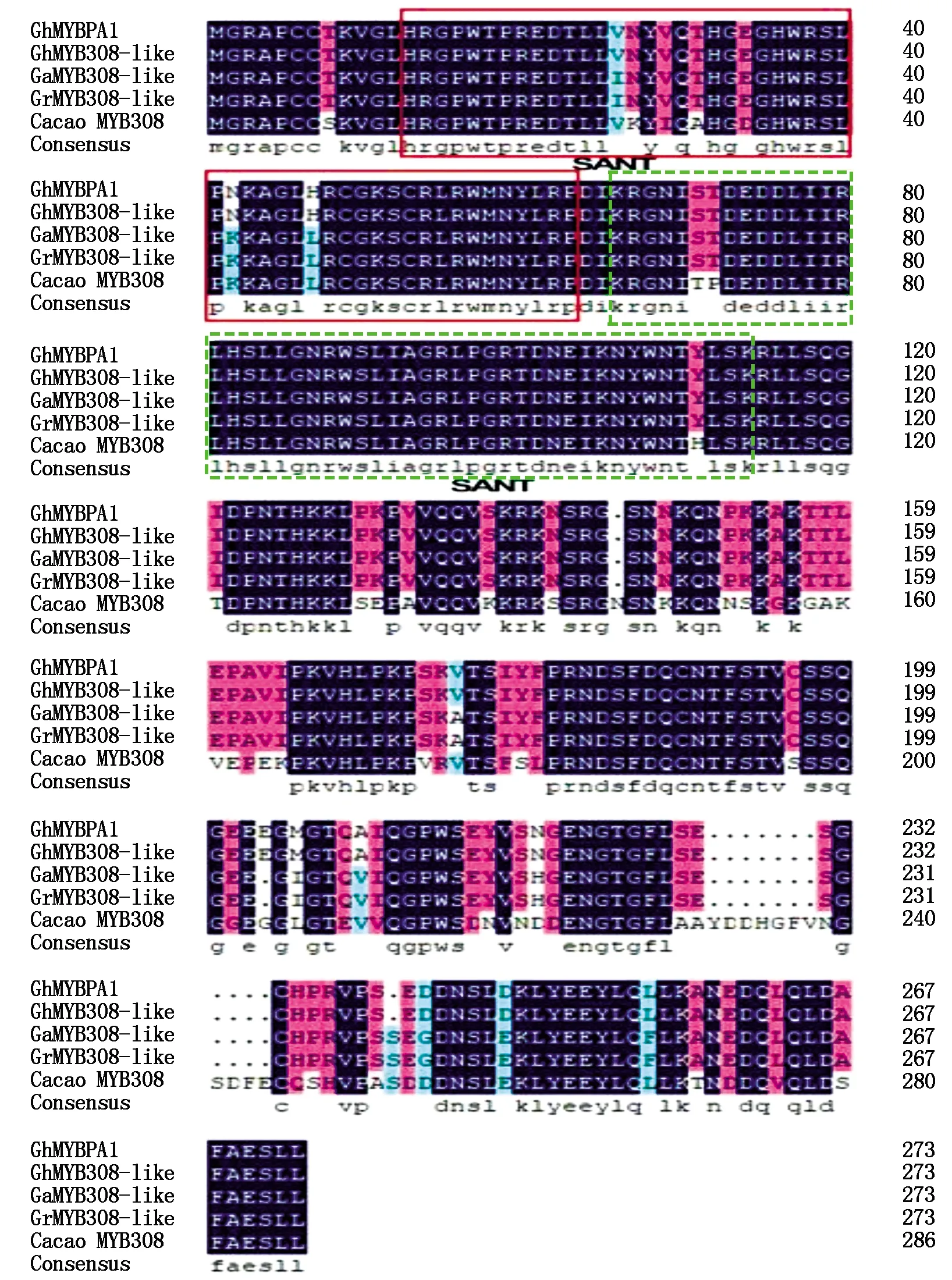
实线框和虚线框分别代表2个SANT保守结构域。
同源性分析结果表明,GhMYBPA1蛋白与亚洲棉(GaMYB12-like XM_017769421)、雷蒙德氏棉(GrMYB308-like XM_012619612)、陆地棉(GhMYB308-like XM_016825942)、可可(TheobromacacaoMYB308 XM_007051442)、月季(RosachinensisMYB8-like XM_024317461)、枣(ZiziphusjujubaMYB308-like XM_016033215)、胡桃(JuglansregiaMYBHv1-like XM_018991195)、蓖麻(RicinuscommunisMYB30-like XM_002518832)的氨基酸序列相似度分别为99%,96%,96%,76%,60%,53%,54%,49%(图3)。
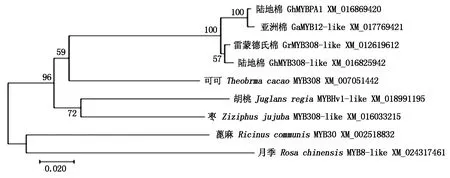
图3 GhMYBPA1蛋白系统进化树分析
2.2 GhMYBPA1基因在不同组织中的表达分析
以棉花不同组织的cDNA为模板,对GhMYBPA1基因在棉花的根、茎、叶、花等组织中的表达情况进行分析,结果表明(图4),GhMYBPA1基因在棉花的根、茎、叶、花组织中均有表达,其表达量表现为花>叶>根>茎,组织间差异均显著,其中,在花和叶片中的表达量较高,而在根和茎中的表达量相对较低。说明GhMYBPA1基因功能可能涉及多个方面。
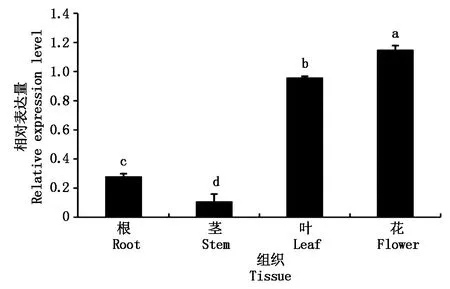
不同小写字母表示0.05水平差异显著。图5-7同。
2.3 逆境胁迫下GhMYBPA1基因表达分析
在各种非生物逆境胁迫下对GhMYBPA1基因进行分析,结果表明,棉花植株在200 mmol/L NaCl胁迫下,GhMYBPA1基因表达量显著升高,在3 h时,基因表达量达到最高,之后表达量显著降低(图5);在4 ℃低温胁迫1 h时,GhMYBPA1基因表达量达到最高,为未处理对照表达量的4.8倍,在低温胁迫3,6,12 h时,GhMYPBA1基因的表达量呈下降趋势(图6);植株在PEG模拟干旱胁迫下,在处理1 h后GhMYBPA1基因相对表达量开始显著增加,且随着处理时间的增加而增加(图7)。结果表明,GhMYBPA1基因的表达受到高盐、低温和干旱胁迫时均有响应,由此推测,GhMYBPA1基因在棉花响应高盐、低温和干旱等非生物胁迫中起着一定的作用。
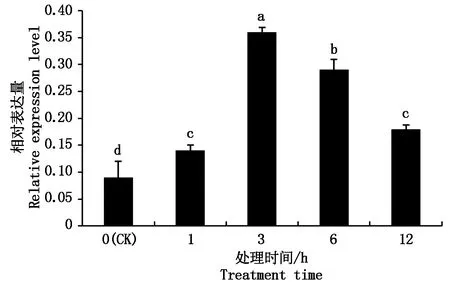
图5 盐胁迫后GhMYBPA1基因的相对表达量

图6 低温胁迫后GhMYBPA1基因的相对表达量
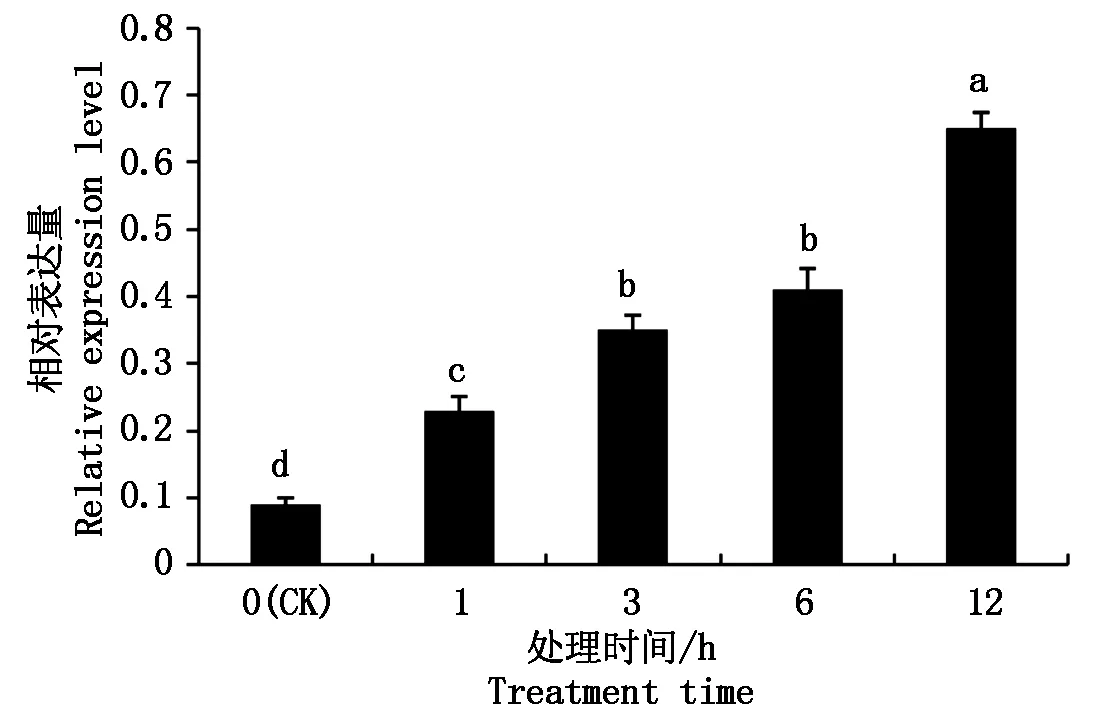
图7 干旱胁迫后GhMYBPA1基因的相对表达量
3 讨论与结论
MYB类转录因子是植物中数量最大、功能多样化的转录因子之一,其调控过程受多种激素及环境诱导,在植株的生长发育过程、逆境胁迫、次生代谢中起着重要作用,是改良植物遗传特性的良好基因资源。目前,大多数MYB转录因子的功能尚待进一步研究。在类黄酮代谢途径中,MYB转录因子通过结合与某些关键酶基因启动子中的重要顺式作用元件,调控类黄酮生物合成途径中基因的表达,有效地调节类黄酮生物合成途径[17]。吕东等[18]克隆了红肉苹果MpMYBPA1基因,并对该基因的表达模式进行了分析,结果发现,在红肉苹果中低温有利于MpMYBPA1基因的表达,并且该基因受ABA调控。白蓓蓓等[19]克隆了芒果MinMYBPA基因,初步确定该基因与芒果果实花青素合成相关。雒珺瑜等[20]研究得出,蕾期棉花叶片中花青素含量与绿盲蝽抗性呈显著正相关,表明植物中的次生代谢物质具有抵御害虫危害的作用,棉花叶片原花青素提取物能够抑制棉花主要害虫的生长。目前,棉花中有关GhMYBPA调控的原花青素的研究与原花青素合成相关的功能基因还未见报道。
本研究从陆地棉中克隆得到1个MYB转录因子基因GhMYBPA1(基因登录位点为XM_016869420),GhMYBPA1全长cDNA为825 bp,其中,编码序列开放阅读框630 bp,编码210个氨基酸,3′和5′端非编码区分别为150,160 bp。氨基酸序列比对结果发现,GhMYBPA1序列中包含2个保守结构域,属于R2R3型MYB转录因子,系统发育分析发现,GhMYBPA1与亚洲棉GaMYB12-like最为相近。
本研究克隆了GhMYBPA1基因,并在不同组织器官的表达及其在低温、干旱、盐等非生物逆境胁迫下对其进行了表达分析,该基因在棉花根、茎、叶、花中均有表达,在花中相对表达量最高,其次是叶,并且受到高盐、低温和干旱处理诱导,可以推测其在低温、干旱、盐等非生物逆境响应中发挥着重要作用,为后续基因功能的研究提供了理论支撑。
