自身免疫性肝炎外周血干扰素γ诱导蛋白16炎症小体的表达及临床价值
2020-12-29王建英张伟阳钟建平许文芳陈将南金法祥
王建英 张伟阳 钟建平 许文芳 陈将南 金法祥
自身免疫性肝炎(AIH)是机体对肝细胞产生自身抗体及自身反应性T细胞致肝脏炎性病变。免疫炎性反应常伴随着炎症细胞和免疫细胞的浸润,炎症因子的大量释放和淋巴细胞的聚集。干扰素γ诱导蛋白16是干扰素诱导HIN-200家族的一员。近来研究发现IFI16与多种细胞活动相关,包括炎症反应、免疫反应、细胞周期调节等,当病毒、细菌等外源物质侵袭时,IFI16作为细胞核和细胞质异常双链DNA传感器首先启动炎病反应,传递信号的同时释放炎性介质促进单核巨噬细胞、淋巴细胞到达受损部位[1],形成宿主抵御病原微生物感染的第一道防线。其在AIH患者外周血中的表达及价值尚不清楚。本文探讨IFI16炎症小体在AIH发生发展中的作用,为研究AIH炎症小体调控机制及治疗AIH提供一定的理论依据。
1 资料与方法
1.1 临床资料 选取2016年1月至2019年6月本院就诊的AIH患者43例,均经肝脏活组织检查并经临床确诊。诊断标准参考2008年国际免疫性肝炎小组(IAIHG)提出的AIH简化诊断积分系统及2010年美国肝病学会(AASLD)更新的有关AIH的诊断和治疗指南[2-3]。排除肝炎病毒感染、药物性、酒精性和遗传代谢性肝病等。激素治疗前评分≥15分明确诊断AIH。缓解是指症状消失,血清转氨酶、胆红素、IgG正常,肝组织正常或无活动性肝硬化[4]。对照组来源于本院同期健康体检者,均取得患者同意并签署知情同意书。
1.2 方法 采取患者及健康对照组外周静脉血,离心后收集血清,ELISA法检测IFI16和IL-17A的表达水平,并同时检测炎症效应分子Caspase-1、IL-1β和IL-18水平。其中IL-17A、Caspase-1、IL-1β和IL-18试剂盒购自eBioscience公司,IFI16试剂盒购自于美国Sigma公司。酶标仪为美国Thermo Multiskan FC。严格按试剂说明书操作。
1.3 统计学方法 采用SPSS17.0统计软件。正态分布计量资料用(±s)表示,两组间比较采用student’st检验,多组间比较采用方差分析,两两比较采用LSD法。计量资料用n(%)表示,组间比较采用χ2检验。相关性分析采用Pearson检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 43例AIH患者,29例为活动期患者,男2例,女27例;平均年龄(45.60±11.29)岁。14例为缓解期患者,男1例,女13例;平均年龄(46.18±11.56)岁。健康对照组35例,男4例,女31例;平均年龄(47.78±12.26)岁。三组性别、年龄差异无统计学意义(t=0.94,P=0.65)。
2.2 血清IFI16、IL-17与炎症效应分子在AIH中的表达 见表2。
表2 IFI16、IL-17A与炎症效应分子在AIH中的表达(±s)
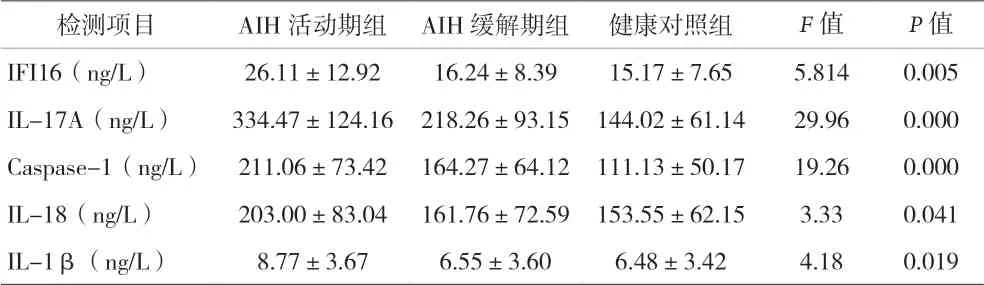
表2 IFI16、IL-17A与炎症效应分子在AIH中的表达(±s)
检测项目 AIH活动期组 AIH缓解期组 健康对照组 F值 P值IFI16(ng/L) 26.11±12.92 16.24±8.39 15.17±7.65 5.814 0.005 IL-17A(ng/L) 334.47±124.16 218.26±93.15 144.02±61.14 29.96 0.000 Caspase-1(ng/L) 211.06±73.42 164.27±64.12 111.13±50.17 19.26 0.000 IL-18(ng/L) 203.00±83.04 161.76±72.59 153.55±62.15 3.33 0.041 IL-1β(ng/L) 8.77±3.67 6.55±3.60 6.48±3.42 4.18 0.019
2.3 AIH患者血清IFI16与IL-17及炎症效应分子相关性分析 AIH患者血清中IFI16表达水平与IL-17、Caspase-1、IL-18和IL-1β水平呈显著正相关(r=0.534、0.692、0.521、0.596,P<0.001),见图1~4。

图1 IFI16表达水平与IL-17的相关性

图2 IFI16表达水平与Caspase-1的相关性
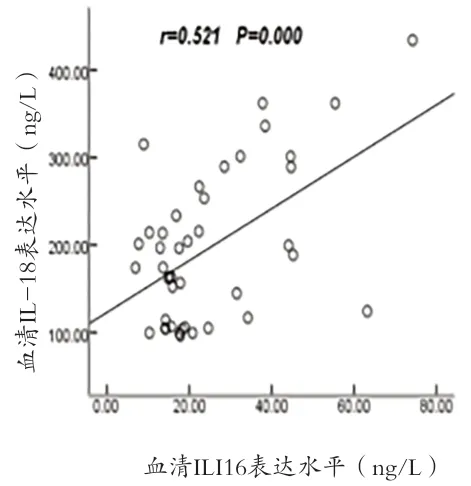
图3 IFI16表达水平与IL-18的相关性

图4 IFI16表达水平与IL-1β的相关性
3 讨论
炎症小体基本包含三种蛋白,分别是感受器,如NOD样蛋白家族(NLRs)和AIM2 样蛋白家族(ALRs),接头蛋白凋亡相关斑点样蛋白(ASC)和效应分子半胱天冬蛋白酶前体(pro-caspase-1)。炎症小体感受感染性和非感染性刺激后活化Caspase-1,剪切IL-1β、IL-18前体,使其成熟并发挥促炎作用[5]。干扰素γ诱导蛋白16(IFI16)是近年新发现的一种细胞核内DNA感受分子,其主要位于细胞核中,识别进入核内的dsDNA,与配体相结合后介导自身炎症小体的形成及活化[6]。有研究发现在自身免疫性疾病如系统性红斑狼疮中,会出现抗IFI16抗体和IFI16表达增高的现象。最新研究证实,IFI16+细胞的数量与慢性乙型肝炎(CHB)和HBV相关的慢性肝衰竭(HBV-ACLF)患者的炎症程度显著相关,可能是HBV-ACLF肝损伤发病机制的重要原因[7],表明IFI16可能在炎症性肝损伤的发生和发展过程中具有重要的作用。
Th17细胞是较多类型适应性免疫中IL-17的主要来源,IL-17家族成员主要有IL-17A、IL-17B、IL-17c、IL-17D(IL-27)、IL-17E(IL-25) 及 IL-17F,IL-17家族细胞因子通过靶细胞上的表面受体介导其生物学功能。IL-17RA表达在多种细胞上,在IL-17刺激下诱导促炎分子,导致过度炎症和明显的组织损伤。自身免疫性肝炎发生时,Th17活化增多,并分泌一系列炎症因子,促进肝脏炎性反应和肝脏损伤[8]。研究证实,在AIH患者血清中IL-17表达增高,在小鼠AIH模型中抑制IL-17能够减弱炎性肝损伤[9]。研究认为IL-17及产生IL-17细胞与自身免疫性肝病密切相关[10]。Huang等[11]首次确认IL-17C/IL-17RE在AIH发生中的作用,抑制该轴的活性有可能成为治疗该病的新型药物靶点。
有报道称IFN-γ,TNF-α,IL-17及IL-22等炎性因子诱导角质形成细胞,能够上调IFI16的表达[12],但具体机制未明确。本资料结果显示,AIH患者血清中IFI16、IL-17、Caspase-1、IL-1β和IFI16表达水平均显著高于健康对照组,并随疾病缓解而下降,提示IL-17、炎症小体IFI16及炎症效应分子均参与AIH炎症性肝损伤的发生发展过程。同时通过相关性分析,发现外周血IFI16水平与IL-17A、 Caspase-1、IL-18与IL-1β均呈显著正相关,因此推测在AIH发病过程中,活化CD4+T细胞向Th17细胞分化,其分泌主要效应因子IL-17诱导上调IFI16表达,促进IFI16对Caspase-1的活化,活化的Caspase-1剪切IL-1β、IL-18前体,成熟的IL-1β和IL-18发挥促炎作用,诱导肝细胞炎性应答,造成免疫失衡进一步诱发AIH,但具体机制仍需进一步研究。
综上所述,IFI16在自身免疫性肝炎发生发展中的起重要作用,在AIH发病过程中由坏死或凋亡细胞产生的自身dsDNA的识别,进而诱导肝细胞炎性应答,但IFI16在AIH发病机制中的作用尚需探索,明确其作用有可能使其成为AIH早期诊断、治疗与预后判断的一个新的切入点。
