2014—2018年我国口服中成药抽检结果的大数据分析与思考
2020-12-23王田田宋婉婷蔡绮薇
王田田 宋婉婷 蔡绮薇

摘要 目的:基于国家药品抽检结果数据,分析评价我国中成药产品质量状况,为相关监管部门和药品生产企业提供参考。方法:收集2014—2018年间,国家药品监督管理局和各省局公布的药品抽检通告,对5 433条不合格批次数据进行归类统计,重点分析口服固体和口服液体中成药制剂的质量问题。结果:中成药片剂、胶囊剂的不合格批次数较多,分别占口服剂型不合格批次总数的47.60%和26.47%,其次是丸剂与颗粒剂。检查项是口服中成药最常见的不合格项,不合格内容以装(重)量差异、水分和微生物限度为主。结论:近5年间我国中成药质量状况总体乐观,周期性药品抽检结果回顾有利于发现药品质量问题趋势,为药品质量监督水平和药品全产业链质量控制水平的提高提供有益参考。
关键词 药品抽检;大数据;中成药;口服固体制剂;口服液体制剂
Abstract Objective:Based on the national drug sampling results data, to analyze and evaluate the quality of Chinese patent medicine products in my country, and provide references for relevant regulatory authorities and drug manufacturers. Methods:The drug sampling notices issued by the national and provincial drug administrations from 2014 to 2018 were collected. Classification and statistics of 5 433 unqualified batch data were conducted. And we focused on the quality problems of oral solid and oral liquid Chinese patent medicine preparations. Results:There were many unqualified batches of Chinese patent medicine tablets and capsules, accounting for 47.60% and 26.47% of the total number of unqualified batches of oral dosage forms, followed by pills and granules. The inspection items were the most common unqualified items of oral Chinese patent medicines, and the unqualified contents were mainly the difference in loading (weight), moisture and microbial limits. Conclusion:In the past five years, the quality of Chinese patent medicines in my country is generally optimistic. The review of the results of periodic drug inspections is conducive to discovering the trend of drug quality problems and provides a useful reference for the improvement of the level of drug quality supervision and the level of quality control of the entire drug industry chain.
Keywords Drug sampling and testing; Big data; Chinese patent medicines; Oral solid preparations; Oral liquid preparations
中圖分类号:R95;F203 文献标识码:A doi:10.3969/j.issn.1673-7202.2020.22.028
药品监督抽检是监控药品质量安全可靠的保障手段之一。从1952年开始,我国开始药品检验工作,期间卫生部陆续出台检验要求,直至1984年,《药品管理法》第一次以法律的形式对药品检验工作做出相关规定。自药品检验工作以来,抽检模式也历经多次变化调整,药品抽检从无计划到有计划,计划时间的范围从短期到长期,抽检侧重点从生产环节到生产环节+流通环节,等,至2006年,国家食品药品监督管理局出台《药品质量抽查检验管理规定》,提出药品抽查检验分为国家和省(区、市)两级,国家药品抽验以评价抽验为主,省(区、市)药品抽验以监督抽验为主[1-2]。《药品管理法》(2015年)规定:国务院和省、自治区、直辖市人民政府的药品监督管理部门应当定期公告药品质量抽查检验的结果。定期对药品抽检结果进行统计分析,有利于分析药品质量状况,指导生产质量控制,为药品质量持续改进提供依据和方向。
中成药是以中医药理论为指导,以中药材或饮片为原料的一类药品,具有成分复杂、质量难以控制的特点。已有相关研究表明中成药的生产加工、流通和销售等环节易出现质量问题[3]。中成药大类剂型有40多种,其中以口服剂型为主,在药品抽检中也是以口服剂型类中成药不合格居多。已有的文献报道,如汉中市的药品抽验分析[4]、镇江市的药品抽检情况分析[5]、近三年商洛市的药品抽验结果研究[6]、某医院中药材与饮片的质量控制[7]、国家药品抽验2017、2018年中成药的质量分析[8]等,大多只针对某局部地域(如某省市或地区)、单一单位(如某医疗机构)或有限时间(如某年)进行药品抽检结果的统计分析,难以体现药品抽检结果的规律性。对于中药抽检结果的分析,如研究2017年我国中药饮片的质量概况[9]、研究亳州中药饮片的质量现状[10]、锦州市的中药饮片抽验结果分析[11]、近7年济南市中药材及中药饮片的质量研究[12]、2017年安徽省的中药饮片不合格状况分析[13]等,大多针对中药饮片,鲜有专门针对中成药制剂的总结。
因此,笔者收集整理2014—2018年间,国家药品监督管理局和31个省级药品监督管理局公布的药品质量公告,以口服剂型类中成药为研究对象,基于抽检大数据从剂型、品种、不合格项等方面进行总结分析,以期为相关监管部门和药品生产企业提供参考。
1 资料与方法
1.1 资料来源 国家药品监督管理局(以下简称国家局)官方网站、全国31个省级药品监督管理局官方网站所公布的药品质量公告。由表1可见,2014—2018年国家局和各省局网络发布的中成药不合格批次数总计5 433批。
1.2 研究方法 采用微软Excel软件对抽检不合格品种数据进行整理分析,記录不合格药品品名、公告日期、剂型、生产企业、生产批号、检验标准、不符合规定项目、检验单位等分项信息,对各分项数据进行统计分析。
2 中成药抽检结果与分析
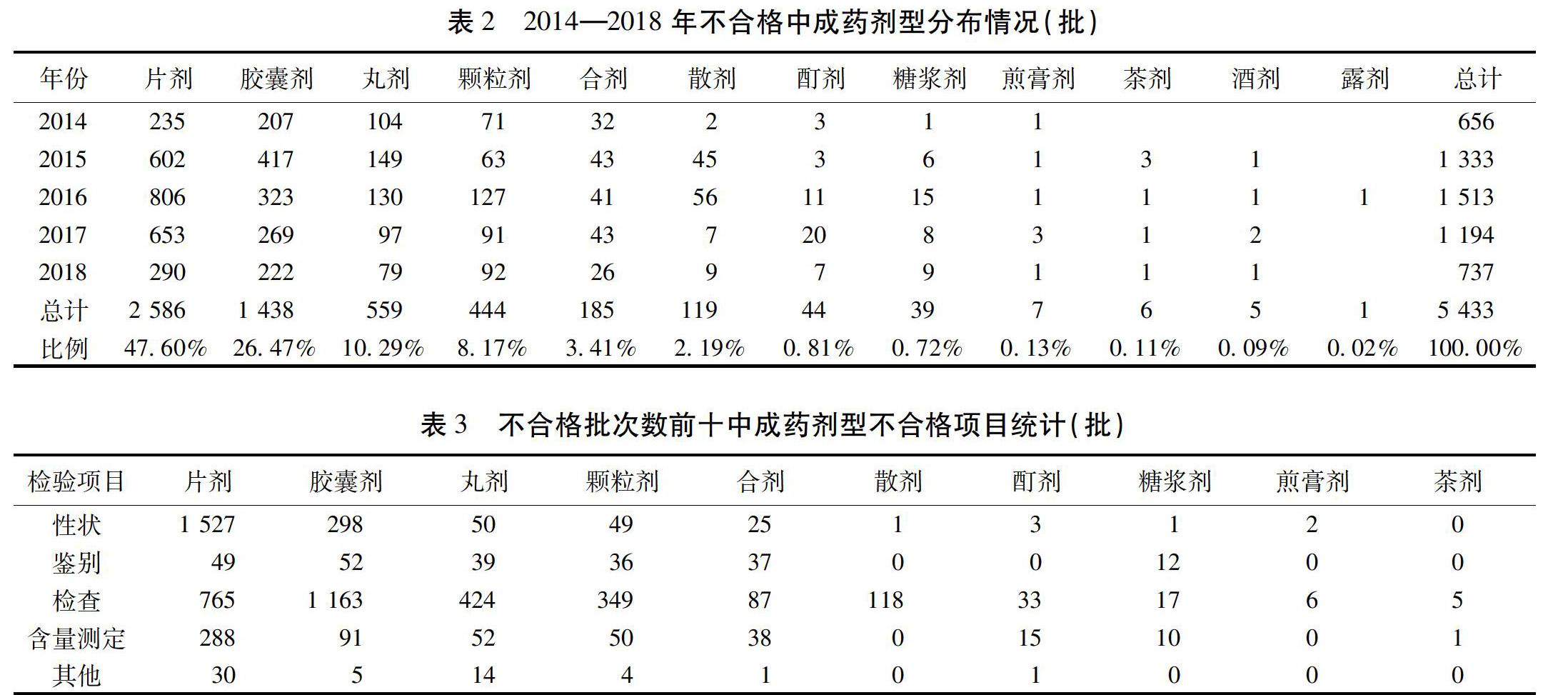
2.1 不同剂型药品不合格批次统计 2014—2018年中成药(口服剂型)不合格批次统计结果见表2。口服类不合格中成药共涉及12个剂型,分别是片剂、胶囊剂、丸剂、颗粒剂、合剂、散剂、酊剂、糖浆剂、煎膏剂、茶剂、酒剂和露剂。片剂、胶囊剂、丸剂、颗粒剂、合剂、散剂为不合格口服中成药的主要剂型。其中,片剂与胶囊剂不合格批次占口服中成药的比重较大,片剂高达47.60%,胶囊剂为26.47%。根据《中华人民共和国药典》(2015版)规定,合剂系指饮片用水或其他溶剂、采用适宜的方法提取制成的口服液体制剂(单剂量灌装者也可称“口服液”)[14]。此处合剂亦包括口服液。
2.2 主要剂型不合格项目统计 不合格项目主要分为4类,分别是性状项、鉴别项、检查项与含量测定项,其他项目或不明者归为其他项。由于同一批药品可能同时有多项不合格项,所以不合格项目总数一般大于或等于不合格批次数。根据《中华人民共和国药典》(2015版)规定,性状项下记载药品的外观、质地、断面、臭、味、溶解度以及物理常数等,在一定程度上反映药品的质量特性。鉴别项包括经验鉴别、显微鉴别和理化鉴别。检查项规定药品或在加工、生产和贮藏过程中可能含有并需要控制的物质或其限度指标,包括安全性、有效性、均一性和纯度等方面要求[15]。含量测定指用化学、物理或生物的方法,对中药中的有效成分或指标成分进行测定,以评价其内在质量[16]。中药片剂不合格项主要为性状,其次为检查和含量测定。其余口服剂型均以检查项不合格为主。此外,胶囊剂的性状项,丸剂、颗粒剂、合剂、酊剂和糖浆剂的含量测定项应予以关注。见表3。
2.3 主要剂型不合格项目分析
参见表4。4类不合格项中,性状项不合格多为生产工艺问题;包装质量不合格或是流通贮存时处理不当,导致药品受潮等;含量测定不合格多由于药品在生产时投料不适当或是原料药含量不合格;鉴别项不合格多集中在薄层色谱法鉴别,即不合格药品中未含有该药品的指标性成分。检查项为各口服中成药主要不合格项,其具体检查项目繁多,不合格原因复杂,与各药品剂型有明显的相关性,以下着重分析各主要剂型的检查项。
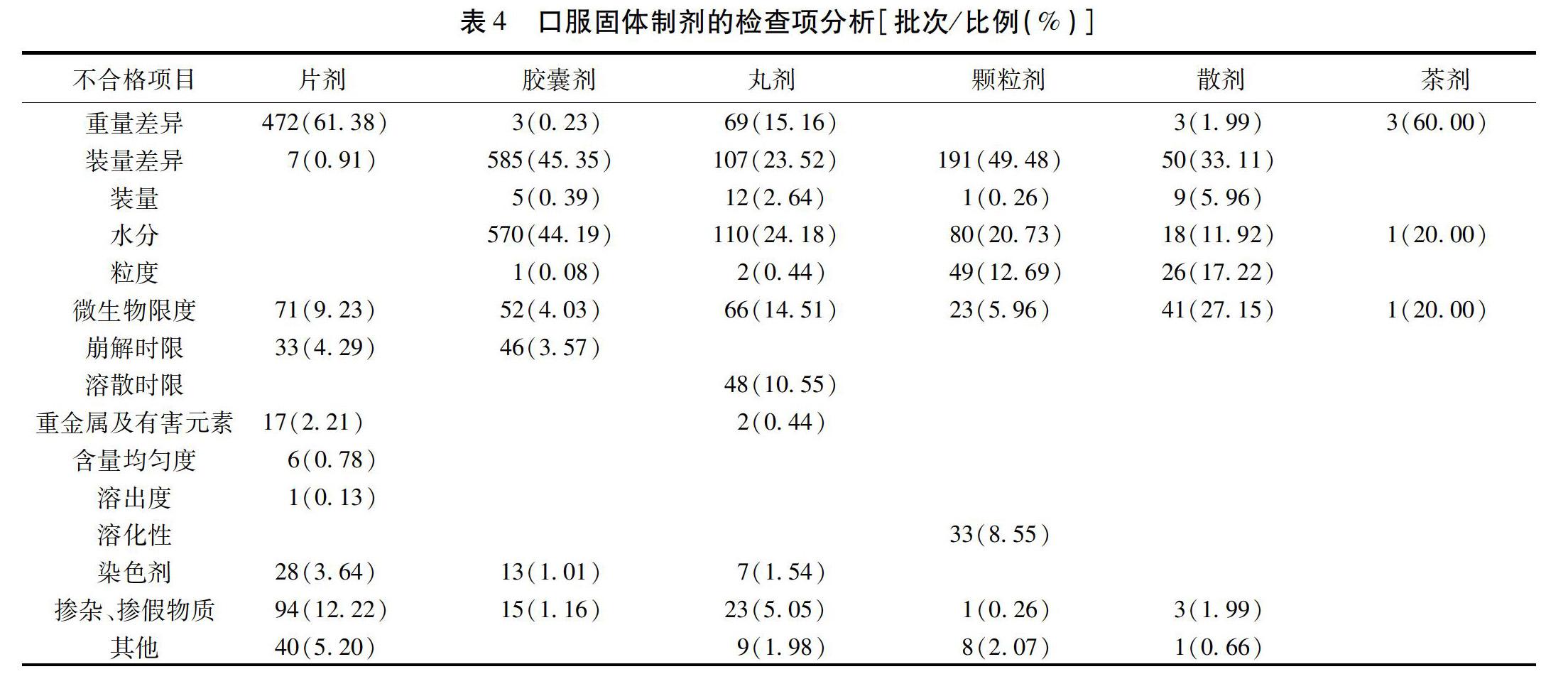
2.3.1 口服固体制剂的检查项分析 中药口服固体制剂中,常见的检查不合格项有重量差异、装量差异、装量、水分、粒度、微生物限度、崩解时限、溶散时限、重金属及有害元素、相对密度、含量均匀度、溶出度、溶化性、染色剂和掺杂掺假物质等。其中,重量差异、装量差异、水分占比较大,微生物限度与检出掺杂掺假物质分布较广,装量、粒度、染色剂、崩解时限与重金属及有害元素以及各剂型特性问题占比相对较小。
重量差异与装量差异在多数剂型不合格项中占比较大,重量差异可占片剂的61.38%、茶剂的60.00%;装量差异占胶囊剂的45.35%、颗粒剂的49.48%、散剂的33.11%;在丸剂中,重量差异与装量差异分别占15.16%和23.52%。药品存在重量差异与装量差异会导致药物有效成分含量不均,影响药效的发挥。在药品的生产流通链条中,重量差异与装量差异不合格原因主要是在生产环节未实施有效质量控制。中药口服固体制剂的制备大多涉及粉体,粒径合适、表面光滑、水分适当等的粉体具有良好的流动性与充填性。中成药制剂处方中常包括中药饮片原粉和(或)中药浸膏粉,成分复杂,含有纤维素、淀粉、糖类、黏液质、蛋白质、矿物质等多种成分,其粒径粒形、密度、表面能量等存在较大的差异,加入辅料混合后易造成粉体的均匀性、流动性、可压性、黏性和引湿性不符合要求,质地不均、流动性差的粉末在分剂量过程中易导致重量差异与装量差异不合格[17]。其他方面如提取方法、制粒方法、设备调整等不适当[18],质量检查不严格,辅料选择不当,包装材料的质量不合格等,亦会造成装量差异与重量差异不符合要求。
水分不合格在胶囊剂中较为突出,占比高达44.19%,在丸剂、颗粒剂、散剂和茶剂中也较为多见,分别占24.18%、20.73%、11.92%、20.00%。水分不合格会引起药品结块、发粘,进而影响药物崩解或有效成分的溶出释放。造成水分不合格的外在原因主要有生产车间湿度过高、包装密封性差、贮存环境湿度过大等。内在因素主要为药物中含有吸湿性成分,如胶囊剂、颗粒剂和散剂的内容物多为粉体,中药粉体易吸湿是水分不合格的重要原因。此外,胶囊剂的空心胶囊质量不合格或材质选择不当,本身水分较多或容易吸湿也会造成胶囊剂水分不合格。造成丸剂水分过多的原因还有生产时干燥未符合要求,干燥过程一直是丸剂生产工艺的难点,因药物成分的不同,干燥的方式、温度、时间等不尽相同,不恰当的干燥方法不仅会造成水分的不合格,还会影响药物的有效成分含量、溶散时限、性状等。
微生物限度是所有药品的必检项目,其不合格的可能原因主要包括药材未经过消毒灭菌、企业的生产环境未达到GMP要求、操作人员污染、灭菌程序疏漏、质检工作不到位、包装质量不合格或在流通贮存时遭到污染等。
染色、掺杂、掺假等非法添加的现象较为常见。在中成药中检出的染色剂多为工业用染色剂,如金胺O、金橙Ⅱ、胭脂红、苏丹Ⅰ和苏丹Ⅳ、柠檬黄、日落黄、酸性红73和808猩红等。这些染色剂对人体危害极大,如金胺O可引起中毒,皮炎,还具有致畸致癌的作用等,但其价格低,染色效果好,是良好的工业染料,我国法律禁止其作为食品添加剂[19]。中成药中检出的染色剂多是由原料药带入的,例如从元胡止痛片检出金胺O,元胡止痛片由醋延胡索和白芷两味药组成,在药材及饮片的抽检结果发现,延胡索不合格的主要原因是被检出金胺O,二者相互对应。此外,还有在骨折挫伤胶囊中检出金橙Ⅱ,在骨筋丸胶囊中检出苏丹Ⅰ、苏丹Ⅳ,在二十五味珊瑚丸中检出808猩红等,相应的在3种制剂的处方原料红花中检出金橙Ⅱ、血竭中检出苏丹Ⅰ和苏丹Ⅳ、朱砂中检出808猩红。
掺杂、掺假现象主要体现在检出土大黄苷、松香酸、三七茎叶皂苷、樟脑、异性有机物、游离槲皮素、山柰素、异鼠李素、槐角苷、醋酸泼尼松、西地那非等非药物成分上。炎可宁片、牛黄解毒片和牛黄消炎片等含大黄为原料药的药品被检出土大黄苷,证明存在用伪品混淆正品的现象。检出松香酸的主要是风湿关节炎片、小活络丸、跌打丸和跌打活血散等原料药中含有乳香和没药的药品,乳香和没药为树脂类贵重药材,有商家通过非法添加松香以获取不法经济效益,这在药材和饮片市场上是较为常见问题。复方丹参片被检出三七茎叶皂苷和樟脑,心可宁片被检出樟脑,表明企业存在为降低生产成本用三七茎叶皂苷提取物代替三七粉,用樟脑代替冰片的现象。复方丹参片、牛黄解毒片被检出异性有机物,说明企业存在擅自更改生产工艺,用药材原粉代替药材提取浸膏压片,降低生产成本的行为。银杏叶片、银杏叶滴丸等银杏叶制剂检出槐角苷和游离槲皮素、山柰素、异鼠李素不合格,表示企业存在银杏叶提取物中非法添加槐角提取物或使用掺杂槐角提取物的不合格银杏叶提取物现象,且抽检多不合格药品则多集中在2015年和2016年,2017年和2018年较少,说明自2015年“银杏叶事件”后,国家局颁布的相关补充检验方法起到了很大的监督作用。以上药品中掺杂、掺假现象与药品的原料药质量和相关工艺控制密切相关。
重金属及有害元素对人体有着极大的危害,可破坏人体重要器官系统,引起中毒,甚至有致癌风险。中成药中的重金属及有害元素主要来自原料药,如黄连上清片中检出砷盐,主要是因为原料药中的黄连含有砷盐。中药材中重金属及有害元素的来源主要有3个方面,药材本身富集、植物的生長环境以及生产过程中引入[20]。另外,中成药的辅料的加入以及流通、贮藏过程中保存不当也会导致污染。
崩解时限不合格主要存在于片剂和胶囊剂。崩解时限是药效发挥的关键,影响崩解时限的因素有药材本身含有黏性较强的物质、制粒过程中用的黏合剂的用量、种类及浓度、制粒的时间长短、颗粒水分高低、润滑剂的种类和用量、崩解剂的种类和数量[21-22]。另外,影响胶囊剂的崩解时限不合格因素除原药材成分、赋形剂、水分、生产工艺、空心胶囊的质量等以外,包装材料对胶囊剂在贮存期崩解时限亦有显著影响。怀春影等[23]提出高密度聚乙烯塑料瓶对空气和水分有一定透析作用和平衡作用,故对胶囊剂崩解时限和稳定性比蜡封玻瓶好。但一般来说,玻璃瓶的密封性、防潮效果要好于塑料瓶,有利于保证胶囊剂的水分和微生物限度等合格[24],应根据药品选择合适的包装材料。
装量是对多剂量包装的固体、半固体和液体制剂进行的最低装量检查。装量不合格多集中在丸剂和散剂,其不合格的主要原因是生产人员操作不当、灌装设备精度不高、包装质量不合格导致渗漏以及药品内容物的流动性差等。
粒度不合格主要集中在颗粒剂和散剂,影响原因有制粒过程控制不适当、粉碎筛选不合格、原辅料粒子容易粘合、包装不合格,贮存受潮等。
溶散时限是丸剂特有的检查项。溶散时限与丸药的药效密切相关,丸药主要通过表面润湿,进行毛细管作用、膨胀作用及溶化作用来溶散,在生产时,药料的性质、粉料细度、赋形剂的性质和用量、丸粒的含水量、泛丸速度、丸粒的大小、干燥方法及温度[25]是影响丸药溶散时限的主要原因。另外,在流通贮藏过程中防潮不当,造成水分不合格也会影响溶散时限。
含量均匀度与溶出度集中在片剂,含量均匀度主要和药物与辅料混合的均匀度以及可溶性成分在干燥过程中的“迁移”有关。药物与辅料的量比、粒子形态及原、辅料粒度都会影响药物与辅料混合的均匀度。可溶性成分在干燥过程中的迁移是造成片剂含量不均匀以及着色片产生色斑导致性状项不合格的重要原因[26]。另外,因性状项为中药片剂数目最多的不合格项,此处一并予以分析。根据《中华人民共和国药典》(2015版)规定,片剂外观应完整光洁色泽均匀。片剂的性状问题除色斑外,常见有松片、裂片、花斑等。松片主要与颗粒质量、压片机运行有密切的关系,通常由于中药材的成分和粉碎度、黏合剂与湿润剂以及水分的选择处理不当,导致颗粒质量下降,进而导致松片,或是因为压片机运行时压力不足、压片机运行转速过快、冲头长短不齐而出现松片。裂片主要与压力调节不当、颗粒粗细的均匀程度及压片时颗粒含水量有密切关系[27]。花斑可能是粘合剂用量过多、颗粒过硬或润滑剂未充分混匀或是压片时油污从上冲落入颗粒中,产生油斑[28]。除以上生产过程中的原因外,包装不当、流通贮存时受潮等均可导致松片、裂片和花斑的现象。溶出度与药物的生物利用度密切相关,影响溶出度的因素很多,与原料、辅料和生产工艺都有关,其中选择合适的崩解剂和粘合剂是调整溶出度的常用方法[29]。
溶化性集中在颗粒剂,检出的不溶物多为焦渣,主要是在浓缩或干燥药液时,温度过高的缘故。除焦渣外,还可能存在生产过程中引入的其他杂质,如提取过滤筛网选择不当引入不溶性药屑,或在其他工艺环节生成其他不溶物[30]。
2.3.2 口服液体制剂的检查项分析 参见表5。口服液体制剂的不合格项有重量差异、装量差异、装量、微生物限度、pH值、乙醇量、相对密度。其中,装量、微生物限度、pH值和相对密度占比较大,乙醇量主要集中于酊剂,装量差异与重量差异占比较小。与口服固体制剂相比,除微生物限度这一不合格项以及不合格原因相同外,其他不合格项偏重于液体制剂容易产生的问题。
装量是口服液体制剂的共性问题,且占比较重,占合剂的16.85%、酊剂的82.86%、糖浆剂的52.94%、煎膏剂的14.29%。其不合格原因主要是灌装工艺的问题,如在灌装过程中漏液、灌装机计量不准确、不稳定等。此外,有的厂家直接用存在个体差异口服液药瓶作为装量标准,这也会导致装量不合格。过去大多企业采用容量法来控制液体制剂装量,张春丽等提出采用重量法替代容量法,且较容量法更准确、无污染、低损耗,适于在线控制液体制剂的生产装量[31]。另外,由于包装质量的问题而产生漏夜等情况也会造成装量不合格。液体制剂的装量差异和重量差异不合格原因同装量不合格原因。
pH值主要集中在合剂和糖浆剂,pH值不合格会导致微生物的滋生、影响防腐剂的抑菌效果、以及药物成分析出沉淀或分解。药品的制备工艺、药物成分组成的变化、贮存环境的温湿度的高低、有无污染等都会影响pH值。
相对密度主要集中在糖浆剂和煎膏剂,因其多为饮片浸出液所制的复方制剂,其所含成分复杂不明,不宜用成分定性定量的方法来控制质量。因此,将拟定的相对密度作为《中华人民共和国药典》中该剂型各品种的质量控制指标,基于这样一个事实:当浸出液成分未知时,浸出物含量越高的成品,其相对密度越大,质量越好[32]。所以,生产时投料量与原料质量是相对密度是否合格的关键因素。
乙醇量主要集中于酊剂,因为不同浓度的乙醇对药材中各种化学成分的溶解能力不同,制剂中乙醇的浓度大小对有效成分的含量、制剂中杂质的种类和含量以及制剂的稳定性都有一定影响[33]。乙醇量不合格原因主要包装质量的不合格,储存不当,导致乙醇挥发或是制备工艺问题,未控制好乙醇浓度。
3 讨论与建议
3.1 实施科学药品抽验与检测 药品抽查检验须制定科学的抽检计划,要充分利用历史抽检的数据,通过对数据进行分析,建立周期性回顾机制,动态更新抽检方案,科学调整计划,提高抽检的合理性。比如对近5年来抽检大数据的统计分析发现,不合格口服中成药多集中于个别剂型,而且不同品种的不合格项分布已存在一定集中分布规律。针对这一特点,在药品抽检时,建议着重抽检剂型为片剂、胶囊剂、丸剂、颗粒剂的中成药,以及高频次不合格的中成药品种,并对其高频次不合格项进行重点检验。此外,尚存在对同一企业同一批次药品重复抽检的情况,建议各药品监督管理机构可共享抽检计划和数据,避免重复抽检,造成资源浪费。
3.2 降低中药材及饮片质量风险 由抽检统计结果可知中成药的非法添加物质部分来源于原料药,即中药材和饮片。在对中药材及饮片的抽检结果分析中也发现非法掺假、染色以及增重现象常见,如白矾中加铵盐和铁盐,阿胶和龟甲胶中检出牛皮源成分,延胡索中非法添加金胺O,朱砂用808猩红、酸性红73等染料染色。这些不法行为大大影响了中药材和饮片的安全性与质量可控性。建议相关部门加大监管力度,建立良好的市场秩序。建议相关生产企业要树立良好形象,讲求信誉,对中成药质量从源头抓起。
3.3 提高药品生产企业质量控制水平 药品抽检的不合格结果,揭示了生产企业的生产工艺不过关、生产操作不规范、包装质量不合格、质检工作不过硬,甚至投料偷工减材、用伪品代替正品等问题。但对于药品的质量控制来说,药品抽检属于事后监督行为。人用药品注册技术国际协调会于2009年正式确立“质量源于设计(QbD)”理念,启示我们应从源头上实现药品质量防控[34]。建议生产企业强化质量主体意识,以质量为先,在制订内控标准时从严要求,做到检验高标准、药品高质量,在各生产环节中充分防控风险[35]。相关监管机构也应该对药品不合格率较高的生产企业做重点抽查,加大惩戒力度,建立良好的药品市场秩序。在药品监督检查中,将药品质量抽检与GMP、GSP等相关检查相结合[36],从药品生命周期的视角,全面防控并降低药品质量风险。
3.4 其他 笔者在收集数据时发现,国家局和大多省级药监局抽检结果公告中未公布抽检基数,只有北京、辽宁、广东、海南和宁夏在已公布的质量公告中全部公布抽检基数。个别省份出现合格药品批次数与不合格药品批次数之和与抽检基数不等的现象。因此笔者未对药品不合格率进行统计分析。建议统一药品抽检结果公告的基本内容和格式,并尽可能提供详尽的药品抽检信息。目前,中国食品药品检定研究院已建立“全国药品抽检信息平台”[37],期待平台开放数据,以利于公众参考。
4 结语
笔者对国家药品监督管理局以及各省级药品监督管理局公布的2014—2018年药品抽检结果,进行了统计分析,总计5 433条不合格批次数据,以口服中成药为主,包括药品质量不合格项、内容和品种等信息。在统计结果基础上,围绕药品抽检、中成药原料质量风险防控和生产过程质量管控水平提升等方面进行了讨论与建议。周期性药品抽检结果的回顾有利于发现药品质量问题趋势,为提高药品质量监督水平提供了参考。
参考文献
[1]吴晋.应用国家药品抽验信息系统提高药品抽验工作效能的探讨和建议[J].海峡药学,2017,29(3):278-280.
[2]顾振华.食品药品安全监管工作指南[S].上海:上海科学技术出版社,2017:452.
[3]祁永飞,包晗,王玉琨.中成药质量监管问题和原因分析及对策探讨[J].中国医药工业杂志,2018,49(1):119-123.
[4]王春艳,刘学平.汉中市药品抽检质量分析与对策[J].西北药学杂志,2018,33(1):125-128.
[5]陈娜,张碧月.2012~2015年镇江市药品监督抽验情况及质量分析[J].药品评价,2017,14(23):55-57,64.
[6]柯园,李静,赵淑敏,等.2012-2014年度商洛市药品监督抽验情况质量分析[J].亚太传统医药,2016,12(12):141-142.
[7]梁杏珍.医院药房中药材与中药饮片质量控制回顾性分析[J].深圳中西医结合杂志,2017,27(19):189-190.
[8]劉静,王翀,冯磊,等.基于国家药品抽验工作的中成药质量和安全问题分析[J].中国现代中药,2019,21(3):1-5.
[9]张萍,李明华,石岩,等.2017年国家中药饮片专项抽验质量概况[J].中国药事,2018,32(10):1330-1335.
[10]陈群,王险峰,殷玉峰.亳州中药饮片质量现状及对策[J].临床合理用药杂志,2018,11(31):162-163.
[11]常乐,王屾,胡佳.锦州市抽检中药饮片质量现状分析[J].中国卫生产业,2017,14(13):171-172.
[12]牟英迪,信珊珊,李禾,等.2011—2017年济南市中药材、中药饮片质量分析[J].中成药,2019,41(3):675-677.
[13]胡士高,金斌.2017年國家食品药品监督管理总局通告安徽省中药饮片不合格情况分析[J].现代中药研究与实践,2018,32(4):71-74.
[14]国家药典委员会.中华人民共和国药典(四部)[M].北京:中国医药科技出版社,2015:通则26.
[15]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:凡例7-8.
[16]梁生旺,贡济宇.中药分析[M].北京:中国中医药出版社,2016:21-22.
[17]杨晓玲.中药硬胶囊剂中存在的问题及其应对措施[J].化工设计通讯,2018,44(10):198.
[18]陈曼,胡启飞,韩峰,等.中药胶囊剂装量差异的影响因素与对策研究进展[J].中国药房,2016,27(34):4879-4882.
[19]刘喆,迟鸿悦,赵彩秀,等.DART-Q-Orbitrap MS法快速检测豆制品中碱性橙Ⅱ和金胺O[J].质谱学报,2019,40(1):42-49.
[20]张慧莉.我国中药材中重金属污染现状分析及对策研究[J].山东化工,2018,47(1):56-57.
[21]李禄辉,刘伟芬,宗兰兰,等.盐酸莫西沙星片处方筛选及制备工艺的优化[J].国际药学研究杂志,2017,44(9):894-900.
[22]刘淑集,许雅洁,刘智禹,等.基于崩解时限的牡蛎糖原片剂配方组合优化研究[J].渔业研究,2016,38(6):453-459.
[23]怀春影.胶囊剂崩解问题探究[J].世界最新医学信息文摘,2016,16(4):141-142.
[24]周建波,王跃生,王金钱,等.中药硬胶囊剂存在的质量问题及对策[J].江西中医学院学报,2012,24(1):40-44.
[25]徐岩,于丽新,石晶,等.影响中药丸剂溶散时限的因素及解决方法[J].中国冶金工业医学杂志,2007,24(S1):25-27.
[26]张汝华.屠锡德.工业药剂学[M].北京:中国医药科技出版社,2001:338.
[27]刘莉,曲慧霞,鄂恒杰,等.中药片剂压片工艺面临的四大问题[J].黑龙江医药,2011,24(4):572.
[28]胡雅军,李春敏.浅谈如何解决中药片剂生产中的常见问题[J].中国中医药现代远程教育,2009,7(4):66-67.
[29]赵宏云,成良钰.片剂生产中溶出度的常见影响因素及控制措施[J].中国高新技术企业,2015,21(23):72-73.
[30]孔明枫,凌雨鸥.影响颗粒剂溶化性的因素分析及解决方法探讨[J].赣南医学院学报,2002,22(1):46-47.
[31]张春丽,刘中丽,李竞,等.重量法控制液体制剂装量的初步研究[J].中国医药工业杂志,2012,43(8):700-702.
[32]艾伟霞,石新华,雷超.中药糖浆剂相对密度的定标方法[J].中国医药指南,2011,9(21):257-258.
[33]卓菊,宋金玉.中药制剂检测技术[M].北京:中国医药科技出版社,2017:120.
[34]徐冰,史新元,吴志生,等.论中药质量源于设计[J].中国中药杂志,2017,42(6):1015-1024.
[35]蔡丹宁,江燕.2013-2015年湖北省药品质量监督抽验结果分析[J].中国药房,2017,28(1):126-130.
[36]王海涛,吴彬,倪健.我国药品质量监督抽验情况分析及建议[J].中国药事,2017,31(10):1107-1112.
[37]郗昊,冯磊,朱炯,等.基于大数据技术的信息共享平台辅助国家药品抽检工作现状分析及展望[J].中国医药导刊,2019,21(1):50-54.
(2019-04-18收稿 责任编辑:苍宁)
