白茅根乙酸乙酯部提取物舒张小鼠气管平滑肌机理
2020-12-22沈金花曾晓月
沈金花,曾晓月
(中南民族大学 生命科学学院,医学生物研究所&武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉430074)
支气管哮喘,简称哮喘,是一种以可逆性支气管收缩、黏液增生以及气道高反应性为特征的慢性气道疾病[1].哮喘的发病机制十分复杂且因人而异,如离子通道病变、免疫系统紊乱、基因异常、炎症反应及呼吸道结构的改变等.哮喘已成为严重威胁全人类健康的慢性疾病之一,也给患者和全社会带来了沉重的负担.临床上常用的治疗哮喘的药物主要有茶碱、β2受体激动剂、抗胆碱药、皮质激素等[2].中药治疗哮喘具有悠久的历史,利用现代科学技术研究,有望发现可靠有效的用于治疗或缓解哮喘的中药[3].
白茅根(Rhizomaimperatae)为禾本科植物白茅的干燥根茎.其性味甘寒,具有凉血、清热利尿的作用,主要活性成分有糖类、三萜类、黄酮类等.目前,白茅根已经在治疗恶性肿瘤、慢性肝炎、过敏性皮炎等方面得到应用[4].目前,尚未见文献报道过白茅根对哮喘的作用.因此,本文提取白茅根乙酸乙酯部来检测此物对小鼠气管平滑肌的影响,以此探究其对哮喘的影响.
1 材料与方法
1.1 材料和仪器
白茅根(北京同仁堂药房);胶原蛋白酶、木瓜蛋白酶、牛血清蛋白、乙酰胆碱、硝苯地平(美国Sigma).生理钙溶液、零钙溶液、rTASM 解离液、细胞外液、电极内液、酶Ⅰ、酶Ⅱ,参考文献[2]配置.
HV-4型离体组织器官恒温灌流系统、BL-420S生物机能实验系统(成都泰盟科技);张力换能器( JH-2型,北京航天医学工程研究所);膜片钳放大器(EPC-10,德国HEKA);膜片钳显微镜(IX51,日本OLYMPUS);MP-225显微操作仪、P-97 Flaming/Brown电极拉制仪(美国Sutter Instrument Company);玻璃微电极(外径1.4 mm,南京泉水教学实验器材厂);玻璃微电极抛光仪(2002-C,华中科技大学);中草药粉碎机(FW135,天津市秦斯特仪器).
8周龄BABL/c雄性小鼠,购自湖北省疾病预防控制中心,严格按照《中南民族大学实验动物使用与福利指导手册》的指导方案进行动物研究和处理.
1.2 白茅根乙酸乙酯部提取物的制备
将白茅根粉碎,称取白茅根粉1000 g于室温下浸泡于80% 的乙醇溶液5 d(固液比1∶16 ).过滤得滤液,将滤液旋转蒸发得乙醇浸膏.依次用石油醚、乙酸乙酯、正丁醇萃取此浸膏,获得相应的提取物.旋转蒸发浸膏获得白茅根乙酸乙酯部提取物,并置于真空干燥箱中保存备用.
1.3 小鼠离体气管环的处理与上样
断颈法处死小鼠,取出小鼠气管组织,置于盛有冰浴PSS的解剖盘中将主气管周围多余组织清理干净.最终在靠近气管三角区剪取长约7 mm的气管,将其用两个三角钩固定住后挂到张力换能器上,置于预热的含有6 mL PSS的恒温水浴槽内,水浴槽内保持持续通氧状态,水浴温度维持在37 ℃.上样后,将初始前负荷调节为约300 mg并持续15 min,每15 min后更换PSS溶液,重复4次.平衡结束后,使用80 mmol·L-1KCl或100 μmol·L-1ACh进行预刺激,使离体气管环获得充分刺激,再用PSS洗脱使其恢复至基线,组织在基线状态休息30 min后开始实验.
1.4 小鼠气管平滑肌细胞的制备
将获得的气管及肺组织迅速固定于含有冰浴解离液的解剖盘中,将主气管及支气管周围多余组织清除,并剪下呈“Y”形的肌条组织.快速置于预热(37 ℃)的P酶中,每6~7 min中轻弹几下EP管使肌条组织伸展开,共消化21~23 min.在P酶中消化完后,将肌条组织转移到预热的H酶中,5 min后,用冰浴的BSA溶液清洗两次,然后将组织转移到一约含500 μL的BSA溶液的EP管中,通过弹EP管使肌条组织分散成单个细胞.打开EP管盖,置于0 ℃冰箱保存备用.
1.5 全细胞电流记录
通过EPC-10膜片钳,采用步阶式(从-70 mV~+40 mV)刺激方式作用于细胞,阶刺激为1000 ms.记录小鼠单个气管平滑肌细胞L型钙离子通道全细胞电流.
2 结果与分析
2.1 EAERI对高钾诱导的预收缩的气管环的舒张作用
EAERI能剂量依赖性舒张由高钾溶液诱导的小鼠离体气管环的收缩,最大舒张比值为(99.7±0.9)%,IC50=0.66 mg·mL-1,IC75=1.053 mg·mL-1(图1a,1b),选取IC75用于后续实验.10 μmol·L-1Nifedipine(L型钙通道的一种选择性阻断剂)可以完全舒张由高钾诱导的收缩的小鼠离体气管环(图1c),并且对静息状态下的气管环张力无影响(图1d).因此,可知EAERI通过抑制L型钙通道来舒张由高钾诱导的气管环的收缩.
2.2 EAERI抑制高钾诱导的Ca2+内流
在0 Ca2+条件下,高钾不能诱导离体气管的收缩,而浴液恢复到生理钙环境后可引发气管收缩.此收缩可被1.053 mg·mL-1EAERI抑制(图2a).在提前孵育1.053 mg·mL-1EAERI条件下,浴液由零钙溶液恢复到生理钙溶液后,高钾仅引起离体小鼠气管环一个轻微短时的收缩(无统计学意义)后即恢复到基线(图2b),表明EAERI通过抑制Ca2+经L型钙离子通道流入细胞内,由此舒张由高钾诱导的小鼠气管环的收缩.
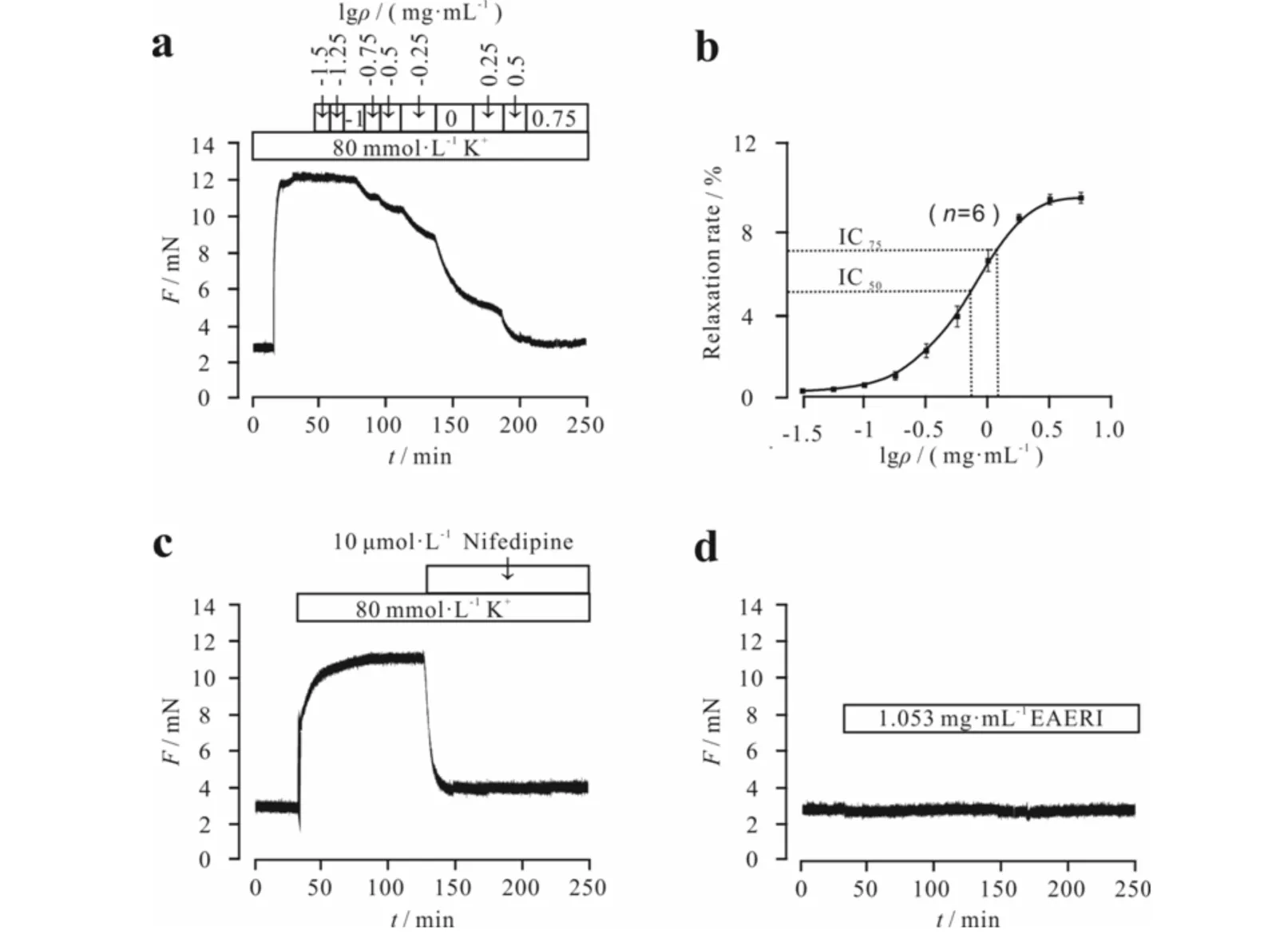
a) EAERI剂量依赖性地抑制高钾诱导的预收缩的气管环;b) EAERI抑制高钾诱导的预收缩的气管环的量效曲线;c) 10 μmol·L-1 Nifedipine完全阻断高钾诱导离体小鼠气管环的收缩;d) EAERI对小鼠离体气管环静息状态下张力无影响图1 EAERI对高钾诱导的预收缩的气管环的舒张作用(n=6)Fig.1 Relaxation effect of EAERI on the precontracted trachea induced by high K+(n=6)
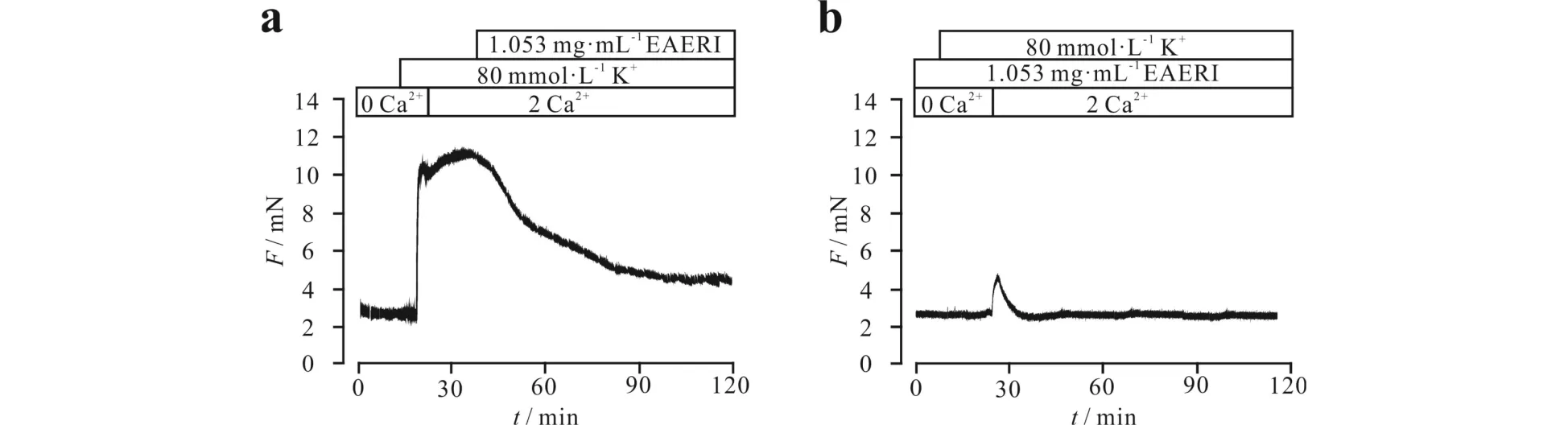
a) 无外钙条件下高钾不引起气管收缩;b) 提前孵育EAERI可抑制外钙内流引起的气管收缩图2 EAERI对高钾诱导的外钙内流的抑制作用Fig.2 Inhibitory effect of EAERI on Ca2+ influx induced by high K+
2.3 EAERI抑制L型钙通道全细胞电流
记录急性分离的气管平滑肌细胞的L型钙通道电流时采用步阶电压刺激(-70 mV~+40 mV),发现EAERI阻断L型钙通道电流的变化情况与Nifedipine的效果一致(图3).当不存在Nifedipine或者EAERI时,在刺激电压大于-30 mV后开始出现L型钙通道电流并逐渐增大,而在刺激电压大于10 mV后电流随即呈变小趋势;当加入Nifedipine或EAERI后,电流能被抑制,表明EAERI的作用与Nifedipine类似,即EAERI能通过阻断L型钙离子通道抑制细胞外Ca2+流入细胞内.
乙酰胆碱(ACh)是一种常见的神经递质,可作为激动剂作用于平滑肌细胞膜上的离子通道,使胞内钙离子浓度升高,最终引起气管平滑肌收缩,其主要作用于钙离子通道(VDCCs)和非选择性阳离子通道(NSCCs)[5-6].由ACh引起的气管环的预收缩也能被EAERI剂量依赖性地抑制(图4a),舒张值为(99.68±0.47)%,IC50=1.053 mg·mL-1,IC75=1.584 mg·mL-1(图4b),说明EAERI能舒张由ACh诱导气管环的收缩.
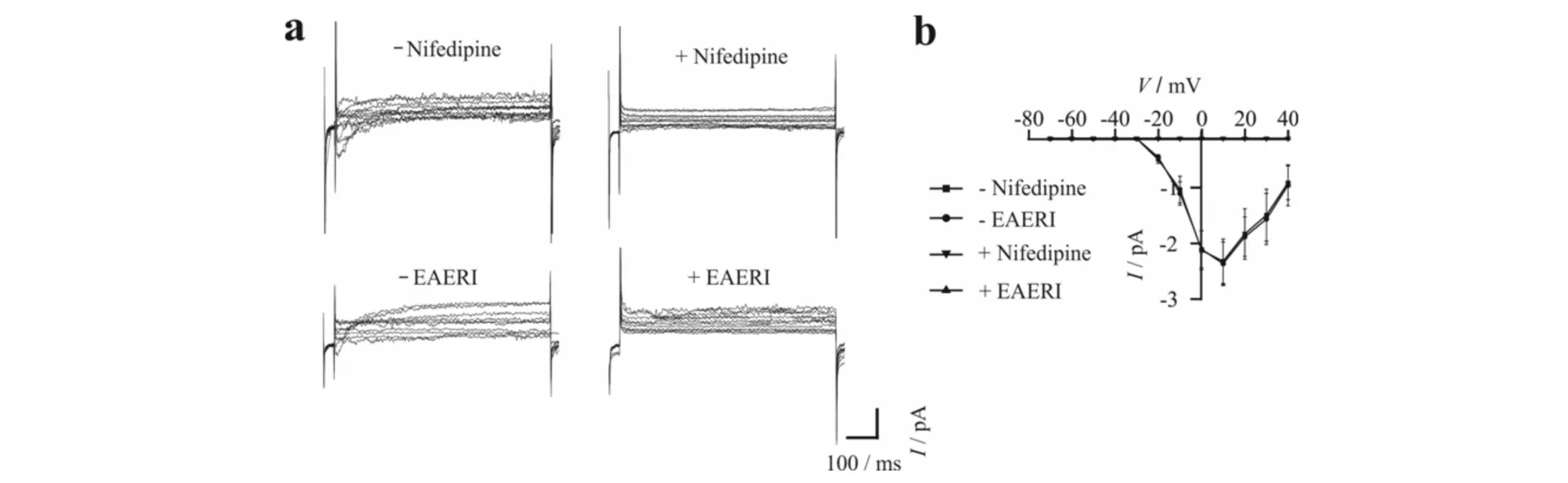
a) EAERI作用于气管平滑肌细胞的VDCCs时间-电流图;b) EAERI作用于气管平滑肌细胞的VDCCs电压-电流图图3 EAERI对VDCCs电流的阻断作用Fig.3 Inhibitory effect of EAERI on VDCCs currents
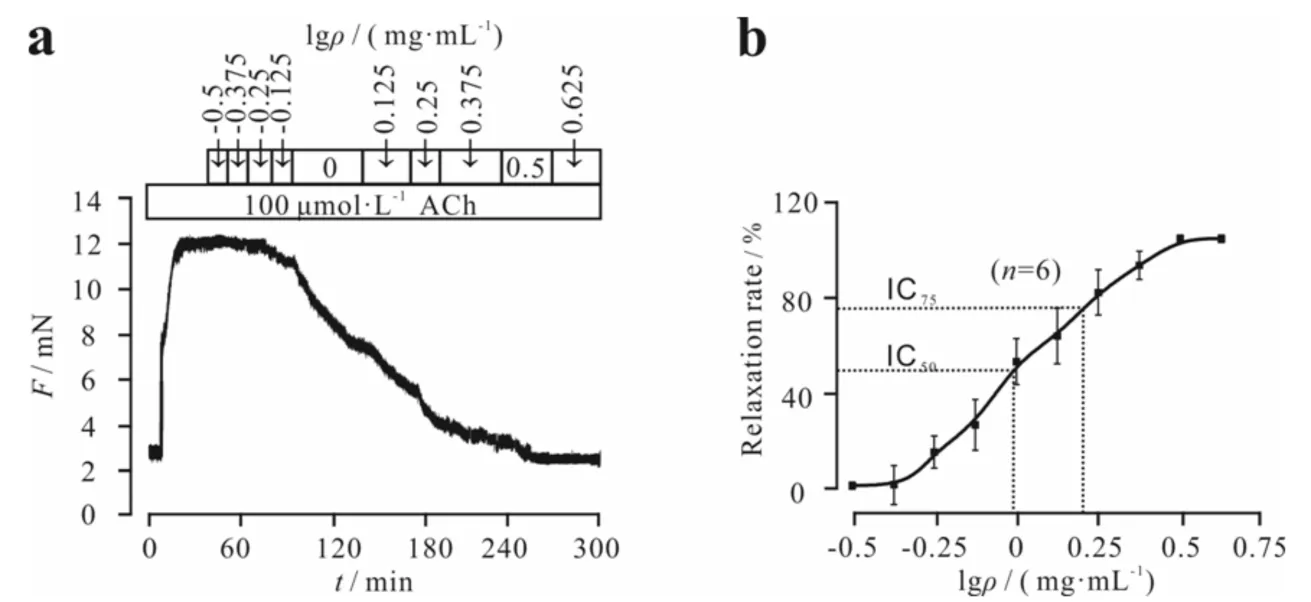
a) EAERI抑制ACh诱导的预收缩的气管环的量效曲线;b) EAERI剂量依赖地抑制ACh诱导的预收缩的气管环图4 EAERI对ACh诱导的预收缩的气管环的舒张作用Fig.4 Relaxation effect of EAERI on precontracted tracheal ring induced by ACh
先由ACh诱导气管环产生一个稳定的收缩,加入Nifedipine后气管环部分舒张,再加入1.584 mg·mL-1EAERI后气管环可基本完全舒张(图5a).
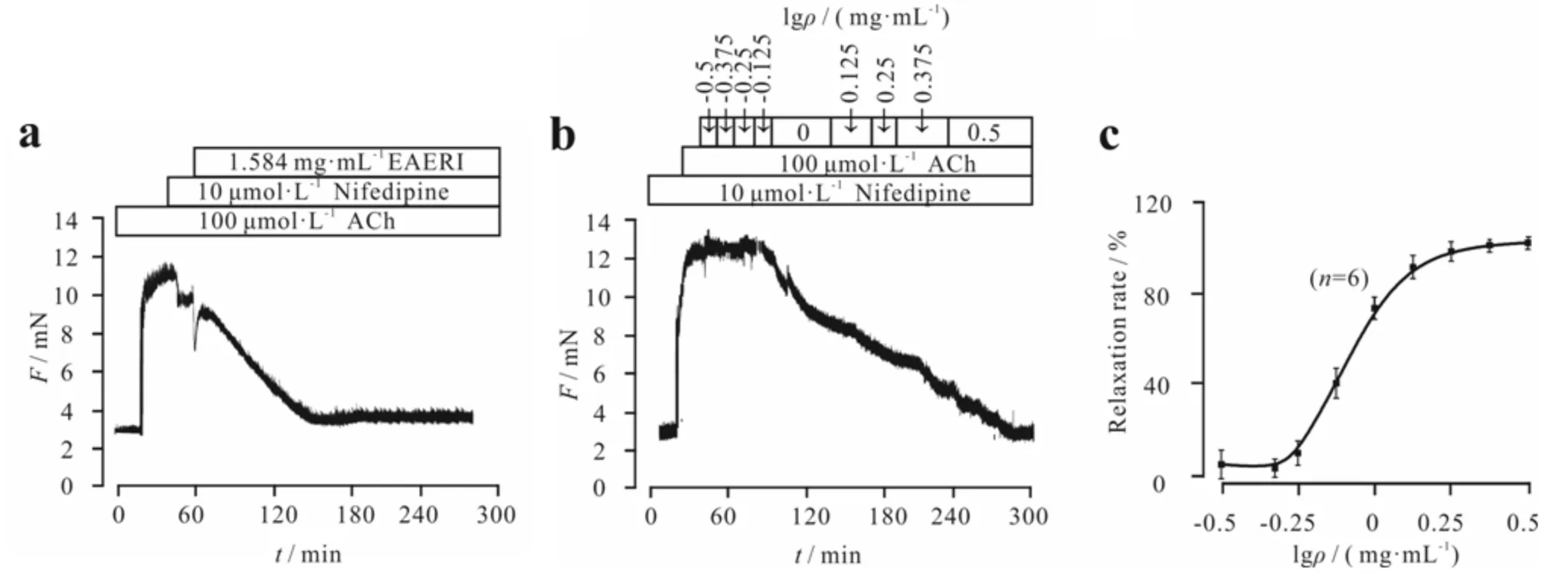
a)EAERI对排除VDCCs后的气管环的影响;b,c) 排除VDCCs后EAERI 舒张ACh预收缩的气管环的量效曲线图5 排除VDCCs通道后EAERI对ACh诱导的预收缩的气管环的舒张作用(n=6)Fig.5 Relaxation effect of EAERI on precontracted tracheal ring induced by ACh without VDCCs(n=6)
提前孵育Nifedipine,ACh仍能诱导小鼠气管环产生稳定收缩,说明除了L型钙通道外还有其他通道参与此收缩,且该收缩呈剂量依赖性地被EAERI舒张(图5b),图5c为舒张百分比统计图.以上结果表明:除了L型钙通道外,EAERI还能通过其他通道来舒张由ACh诱导的小鼠气管环的收缩.
2.4 EAERI抑制ACh诱导的内钙释放
细胞处于零钙溶液下, ACh仅能诱导气管环产生一个瞬时微弱的收缩,而当细胞外溶液浓度恢复到生理溶液浓度后,气管环可产生一个持续稳定的收缩,且能被EAERI舒张(见图6b,图6a为对照组).在提前孵育EAERI的条件下,ACh不能诱导气管环产生明显收缩(图6c).提前孵育Nifedipine,ACh仍能在零钙条件下诱导气管环产生一个瞬时微弱的收缩,同样在恢复到生理钙条件后可诱导小鼠气管环产生持续稳定的收缩,并能被EAERI舒张(图6d).提前孵育Nifedipine,零钙条件下ACh能诱导一个瞬时微弱的收缩,细胞外液换成生理溶液后气管环出现一个持续稳定的收缩,此收缩能被30 μmol·L-1Pyr3、30 μmol·L-1Gadolinium和EAERI各舒张一部分(图6e和图6f).以上实验结果表明:EAERI可能通过阻断NSCCs通道抑制内钙的释放,进而舒张由ACh诱导的小鼠气管环的收缩.
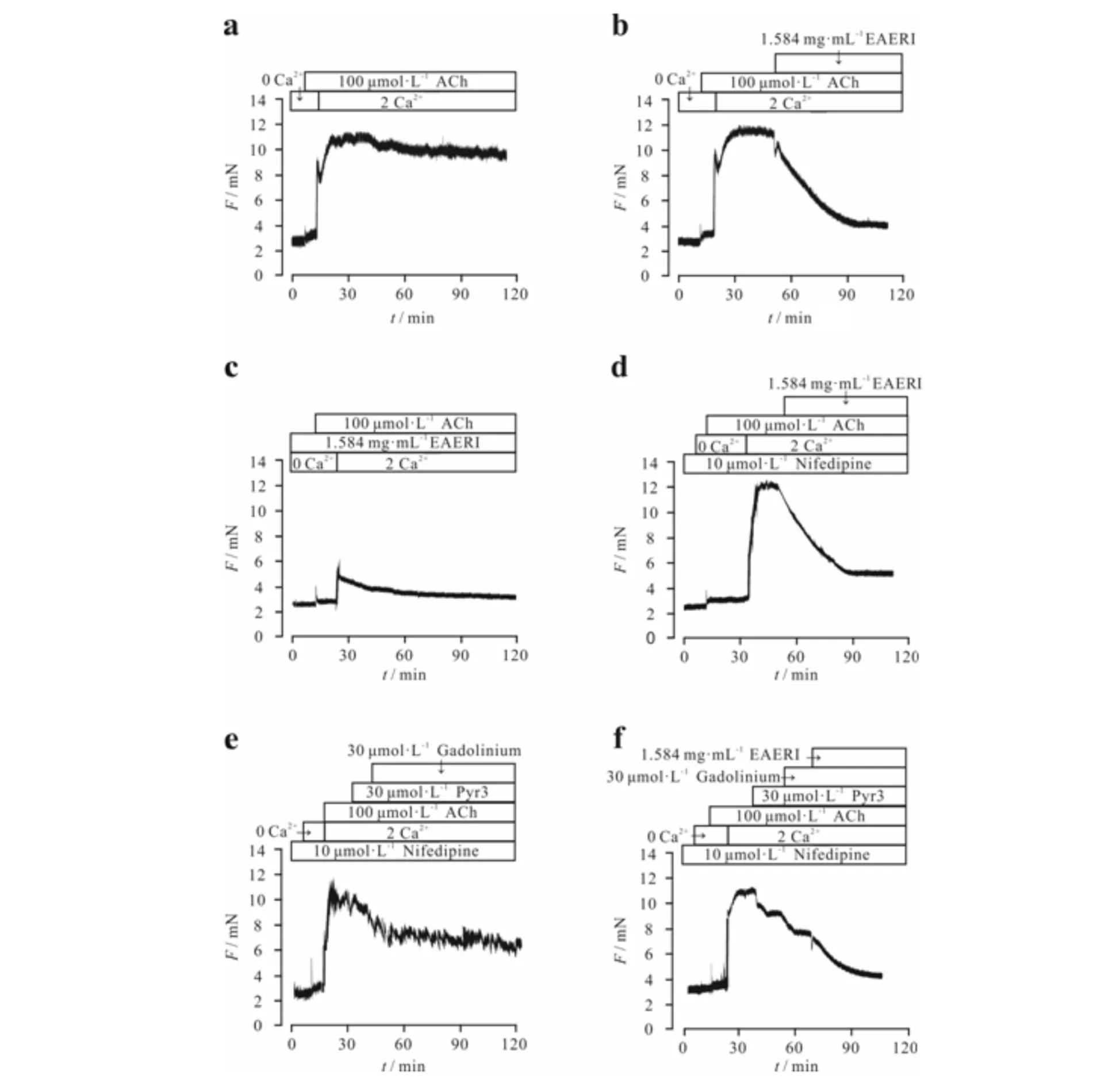
a) ACh诱导的稳定收缩依赖于外钙内流;b) EAERI对此条件下ACh诱导的气管收缩的影响;c) 提前孵育EAERI, ACh不能诱导气管环产生明显收缩;d) 排除VDCCs影响,EAERI对ACh诱导的钙内流的阻断作用;e) 提前孵育Nifedipine,Gadolinium和Pyr3对ACh诱导的收缩的舒张作用;f) Gadolinium和Pyr3作用后, EAERI对其剩余收缩部分的舒张作用图6 EAERI对ACh引起的内钙释放的抑制作用Fig.6 Inhibitory effect of EAERI on Ca2+ influx activated by ACh
2.5 EAERI对组织活性的影响
当EAERI作用于高钾或ACh诱导的收缩的小鼠气管环后,在洗脱掉EAERI后,再用高钾或ACh刺激,气管环都可再次产生收缩,但恢复不到原始状态(图7).此实验结果表明:EAERI对预收缩的气管环有舒张作用,而洗脱后气管环无法恢复到原始状态.原因可能是由于瞬时的洗脱无法将药物完全洗掉,残留的药物使得气管环收缩力下降.
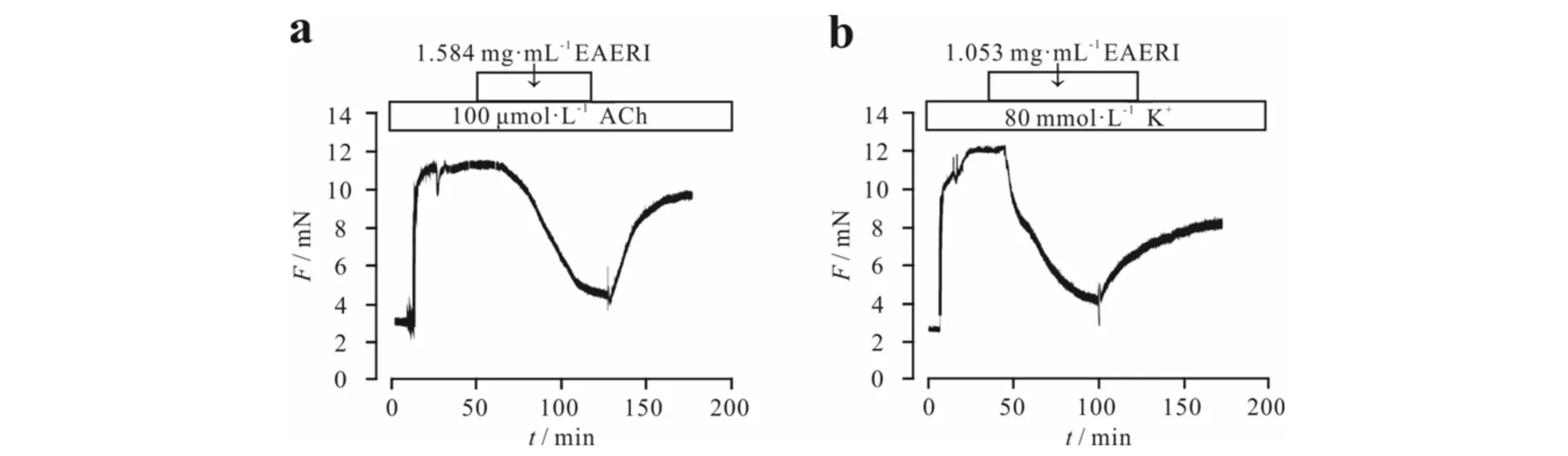
a) EAERI舒张ACh预刺激的气管环后,将EAERI洗脱,用ACh再刺激组织,气管环仍能收缩,但收缩力下降b) EAERI舒张高钾预刺激的气管环后,将EAERI洗脱,用高钾再刺激组织,气管环收缩力下降图7 EAERI对组织活性的影响Fig.7 Effect of EAERI on tissue activity
3 讨论
哮喘的发病机制复杂,有些甚至尚未阐明清楚,但是许多研究结果都表明:Ca2+相关的离子通道在哮喘中有着重要作用[7-9],而气管平滑肌细胞的过度收缩会威胁到哮喘患者的生命[10-11].目前,哮喘还无法得到根治,只能使用一些支气管扩张药物进行缓解治疗[12-13].中医治疗哮喘的研究也在不断进行,以期找到新型的用于治疗哮喘的药物[14].
用高钾溶液或ACh溶液可以诱导气管平滑肌异常收缩,以此来模拟哮喘发病时的状态.EAERI可以舒张由高钾诱导的预收缩的气管环,与使用Nifedipine的作用效果一致.当组织通过零钙与生理钙溶液转换实验,表明EAERI舒张高钾诱导的气管环收缩是由于EAERI抑制外钙内流.进一步通过单细胞水平记录VDCCs电流,发现EAERI与Nifedipine一样可以阻断VDCCs电流,即EAERI通过阻断L型钙离子通道来抑制Ca2+内流从而舒张气管环.ACh是一种常用的M受体激动剂,可以激活多种离子通道,使细胞外钙内流以及肌浆网中钙外流到细胞质中,最后使细胞质中钙离子浓度升高,从而出现气管平滑肌收缩的现象.EAERI能够舒张由ACh诱导的气管环的收缩.预孵Nifedipine以排除L型钙离子通道影响,发现EAERI仍能够舒张剩余的收缩.进一步研究发现,TRPC通道阻断剂Gadolinium和Pyr3可分别舒张此剩余的收缩,表明EAERI可以通过阻断NSCCs抑制Ca2+内流,从而舒张气管环.通过文献分析发现,ACh还可以激活钾离子通道及BK通道,此类通道的开放与否也与细胞的收缩舒张有关[15]. 因此,可进一步研究EAERI是否通过调节钾离子通道而在舒张气管平滑肌上起一定的作用.
综上所述,EAERI可以通过抑制L型钙离子通道、NSCCs通道来抑制细胞内钙离子浓度升高,从而舒张气管平滑肌.此研究提示EAERI有望成为一种支气管扩张药物用于治疗哮喘.