螺旋藻渣营养成分分析及其发酵产物功能活性评价
2020-12-22付云庞一扬赵谋明刘小玲
付云,庞一扬,赵谋明,2,刘小玲,*
(1.广西大学轻工与食品工程学院,广西南宁530004;2.华南理工大学食品科学与工程学院,广东广州510000)
螺旋藻是工业化规模养殖的微藻之一[1],其蛋白质含量丰富,氨基酸种类齐全,被誉为天然食物之冠[2]。螺旋藻渣是工业上螺旋藻粉生产过程中的沉积物。广西北部湾是螺旋藻粉的重要生产基地,每年大量的螺旋藻渣被以污水排放的形式进行处理,小部分作为水产饲料低价销售[3],这导致螺旋藻渣资源不仅没有被充分利用,反而成为了螺旋藻生产企业的经济负担,然而目前关于螺旋藻渣资源的回收利用相关的研究却鲜有报道。因此,螺旋藻渣资源开发应用不仅可以提高螺旋藻的经济价值,降低企业生产成本,同时也为废弃蛋白质资源的开发利用提供了一条新途径。
本研究以广西北部湾螺旋藻渣为原材料,分析螺旋藻渣的基本营养组成、常量元素和重金属含量,评价螺旋藻渣的可利用性,然后以5种不同来源益生菌对其进行液态发酵,评价螺旋藻渣发酵产物的抗氧化、降血脂及抑菌等功能活性,为科学合理开发利用螺旋藻渣提供技术支撑,同时,也为后续研究螺旋藻渣发酵产物中功能活性物质的种类及机理奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
供试菌株:金黄色葡萄球菌(Staphylococcus aureus CGMCC14519)、大肠杆菌(Escherichia coli CGMCC-112252)、沙门氏菌(Salmonella typhimurium CGMCC-11190)、志贺氏菌(Shigella flexneri CGMCC110599):中国普通微生物菌种保藏管理中心;枯草芽孢杆菌(Bacillus subtilis YA215)、地衣芽孢杆菌(Bacillus licheniformis YA269)、蜡样芽孢杆菌(Bacillus cereus YA184)、保加利亚乳杆菌(Lactobacillus bulgaricus YB177):课题组研究人员从北部湾海洋中分离并保存;罗伊氏乳杆菌(Lactobacillus reuteri LT906):轻工与食品工程学院613实验室筛选;酵母菌(Arxula adeninivorans NBRC10858):日本生物资源中心。
1.1.2 培养基
螺旋藻渣培养基(g/L):螺旋藻渣15 g、果糖10 g、NaCl 10 g。制备固体培养基时添加2%琼脂粉,调节pH值至7.0,121℃高压灭菌20 min。
LB培养基(g/L)提供:蛋白胨10 g、酵母浸粉5 g、NaCl 10 g。制备固体培养基时添加2%琼脂粉,调节pH值至7.0,121℃高压灭菌20 min。
1.1.3 试剂
螺旋藻渣:广西生巴达生物科技有限公司(冷链运输后快速冻结放于-20℃备用)。
氢氧化钠、氯化钠、三氯乙酸、磷酸氢二钠、磷酸二氢钠、硫酸铜均为分析纯:成都金山化学试剂有限公司;DPPH、ABTS、牛磺胆酸钠、胆酸钠、甘氨胆酸钠、胰蛋白酶(250 U/mg)、胃蛋白酶(3 000 U/mg)、福林酚、果糖:北京索莱宝科技有限公司;蛋白胨、酵母浸粉、琼脂粉:北京奥博星生物技术有限责任公司。
1.2 仪器与设备
UV-6100紫外可见分光光度计:上海美谱达仪器有限公司;CR21N高速冷冻离心机、L-8900全自动氨基酸分析仪:日立公司;SUNRISE酶标仪:帝肯(上海)贸易有限公司;ZQZY-85CS振荡培养箱:上海知楚仪器有限公司;SQP电子天平:赛多利斯科学仪器有限公司;SW-CJ-2F洁净工作台:苏州安泰空气技术有限公司;GI80TW高压蒸汽灭菌锅:致微(厦门)仪器有限公司;DHP-9082电热恒温培养箱:上海齐欣科学仪器有限公司;SKD-800自动凯氏定氮仪:上海沛欧分析仪器有限公司;SZF-06A自动脂肪测定仪:上海新嘉电子有限公司;SX-2-2.5-10马弗炉:余姚金电仪表有限公司;Agilent 7700e电感耦合等离子体质谱仪:安捷伦科技有限公司(日本)。
1.3 方法
1.3.1 主要营养成分测定
水分含量:105℃恒温烘干法参照GB 5009.3-2016《食品安全国家标准食品中水分的测定》;蛋白质含量:GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》;灰分含量:GB 5009.4-2016《食品安全国家标准食品中灰分的测定》;脂肪含量:GB 5009.6-2016《食品安全国家标准食品中脂肪的测定》;总糖含量:GB/T 9695.31-2008《肉制品总糖含量的测定》。
1.3.2 常量元素和重金属含量的测定
常量元素、砷、铅、铬、镉及甲基汞的测定均采用电感耦合等离子体发射谱法(inductively coupled plasma atomic emission spectrometry,ICP-OES),对应的国家标准分别为DBS52/019-2016《食品安全地方标准食品中钾、镁、钙、铁、锌、磷、铜、钠的测定》、GB 5009.11-2014《食品安全国家标准食品中总砷及无机砷的测定》、GB 5009.12-2017《食品安全国家标准食品中铅的测定》、GB 5009.123-2014《食品安全国家标准食品中铬的测定》、GB 5009.15-2014《食品安全国家标准食品中镉的测定》和GB 5009.17-2014《食品安全国家标准食品中总汞及有机汞的测定》。
1.3.3 总氨基酸测定
称取螺旋藻渣样品5.00 g,根据GB 5009.124-2016《食品安全国家标准食品中氨基酸的测定》使用氨基酸自动分析仪进行氨基酸测定。
1.3.4 螺旋藻发酵产物的制备
将活化后的Bacillus subtilis YA215、Bacillus licheniformisYA269、LactobacillusbulgaricusYB177、Lactobacillus reuteri LT906和Arxula adeninivorans NBRC10858(5种菌悬液浓度均为108CFU/mL)分别接种于螺旋藻渣液体培养基中,200 r/min、37℃摇床培养24 h,8 000 r/min离心20 min,分别收集发酵上清液,冷冻干燥。
1.3.5 可溶性蛋白含量测定
参照LOWRY OH等[4]和林智等[5]的方法并稍作修改,将5种菌株发酵螺旋藻渣的冻干产物分别复溶于超纯水,使其终浓度均为50 mg/mL,采用福林酚法测定发酵产物中可溶性蛋白含量,空白对照为未进行发酵的螺旋藻渣液体培养基冻干产物。
1.3.6 多肽含量测定
参照鲁伟等[6]的方法并稍作修改,将5种菌株发酵螺旋藻渣的冻干产物分别复溶于超纯水,使其终浓度均为50 mg/mL,然后各取2 mL,加入10%三氯乙酸2.0 mL,混匀,静置 10 min,5 000 r/min 离心 15 min,取0.5 mL上清液于另一试管中,再加入2 mL双缩脲试剂,混匀后静置15 min,3 000 r/min离心15 min后,取上清液于540 nm处测吸光度值,以加0.5 mL蒸馏水和2.0 mL双缩脲试剂作空白。
1.3.7 体外抗氧化活性测定
1.3.7.1 DPPH自由基清除能力的测定
参照邱现创等[7]和Bartolome等[8]的方法并稍作修改。称取1.0 mg的DPPH自由基,以95%乙醇为溶剂,配制浓度为0.127 mmol/L的DPPH自由基溶液,保存于4℃冰箱中,备用。在2 mL 0.127 mmol/L DPPH自由基溶液中加入1 mL 50 mg/mL的发酵冻干产物样品溶液,摇匀,室温25℃下静置30 min,517 nm下测定其吸光值AI;同时测定2 mL 0.127 mmol/L DPPH自由基溶于1 mL的95%乙醇混合液的吸光值AC;空白组为3 mL 50 mg/mL的发酵冻干产物样品溶液517 nm下吸光度A0,阳性对照为20 mg/mL抗坏血酸VC。DPPH自由基清除率计算公式如下:

式中:A0为阴性对照组,样品本身的吸光度值;AC为空白对照组,不加样品时的吸光度值;AI为样品组,加入样品时的吸光度值。
1.3.7.2 ABTS+自由基清除能力的测定
参照 Dai Chunhua等[9]和Queiroz Santos Vidiany A等[10]的方法并稍作修改。将0.2 mL 7.4 mmol/L ABTS溶液与0.2 mL 2.6 mmol/L K2S2O8混合后室温25℃下避光静置12 h,用pH 7.4的磷酸盐缓冲液(phosphate buffer saline,PBS)稀释 40~50倍,使其 OD734nm达到0.7左右,得到ABTS工作液。然后将3 mL ABTS工作液与200 μL 50 mg/mL的发酵冻干产物样品溶液混合,充分摇匀,静置6 min,734 nm处测定吸光值。空白对照为PBS缓冲液,阳性对照为20 mg/mL水溶性维生素E。ABTS+自由基清除率计算公式如下:

式中:A0为空白对照在734 nm处的OD值;A1为样品溶液在734 nm处的OD值。
1.3.8 体外降血脂活性测定
1.3.8.1 3种胆酸盐标准曲线的绘制
参考曾桥等[11]和钱雅雯等[12]的方法并稍作修改,以pH 6.3、0.1 mol/L磷酸缓冲液配制0.3 mmol/L胆酸钠、0.4 mmol/L甘氨胆酸钠和0.5 mmol/L牛磺胆酸钠溶液,分别取 3 种胆酸盐溶液 0、0.1、0.5、1.0、1.5、2.0、2.5 mL于10 mL具塞试管中,用0.1 mol/L,pH 6.3的磷酸缓冲溶液将胆酸盐溶液定容至2.5 mL,然后加入7.5 mL质量分数60%的硫酸溶液,将混合溶液70℃水浴20 min,取出后冰浴冷却至室温25℃,374 nm处测吸光值,绘制3种胆酸盐的标准曲线。经处理得到牛黄胆酸钠、甘胆酸钠、胆酸钠的线性回归方程分别为:y=15.849x+0.690 1,R2=0.999 3;y=39.856x+0.046 1,R2=0.994 7;y=39.162x+0.142 6,R2=0.993 1。
1.3.8.2 胆酸盐结合试验
参照于美汇等[13]的方法,分别移取3 mL 50 mg/mL不同发酵冻干产物样品溶液各3份于100 mL三角瓶中,每个三角瓶分别加入3 mL 10 mg/mL胃蛋白酶溶液和1 mL 0.01 mol/L的HCl溶液,37℃恒温振荡反应1 h(模拟胃消化环境),0.1 mol/L的NaOH溶液调节pH值至6.3。随后加入4 mL 10 mg/mL胰蛋白酶溶液,37℃下恒温振荡反应1 h(模拟肠道环境)。一份样品中加入4 mL 0.3 mmol/L甘氨胆酸钠;一份样品中加入4 mL 0.4 mmol/L甘氨胆酸钠;另一份样品中加入4 mL 0.5 mmol/L牛磺胆酸钠。37℃恒温振荡反应1 h,于4 000 r/min离心20 min,取上清液,用比色法于387 nm处测定吸光度值,每个样品平行测定3次。以10 mg/mL考来烯胺作为阳性对照,按照标准曲线计算剩余甘氨胆酸盐和牛磺胆酸盐含量,所加入胆酸钠或甘氨胆酸钠或牛磺胆酸钠总量减去剩余量所得差值与总量的比值即为结合率,以百分比表示。计算公式如下:

式中:c0为胆酸钠加入量,μmol;c1为胆酸钠剩余量,μmol。

式中:c2为甘氨胆酸钠加入量,μmol;c3为甘氨胆酸钠剩余量,μmol。

式中:c4为牛磺胆酸钠加入量,μmol;c5为牛磺胆酸钠剩余量,μmol。
1.3.9 抑菌活性测定
1.3.9.1 指示菌菌悬液的制备
将保存于-80℃冰箱内的5种指示菌(Staphylococcus aureus CGMCC14519、Escherichia coli CGMCC-112252、Salmonella typhimurium CGMCC11190、Shigella flexneri CGMCC110599和Bacillus cereus YA184)菌种接种于LB固体培养基中,37℃恒温培养24 h。再将活化好的菌种挑单菌落,接种于100 mL LB液体培养基中,200 r/min、37℃摇床培养24 h,此时指示菌菌悬液浓度为107CFU/mL~108CFU/mL。
1.3.9.2 抑菌率测定
吸取100μL指示菌菌悬液于100mLLB培养液中,试验组添加10mL50mg/mL不同发酵冻干产物样品溶液,空白组不添加发酵冻干产物样品溶液,进行抑菌试验。培养12 h后,测定菌液在600 nm波长下吸光度值。通过试验组与空白组的菌液浓度计算出抑菌率[14-15]。

式中:A1为空白组吸光度值;A2为试验组吸光度值。
1.4 数据统计与分析
所有试验均进行3次平行试验,试验数据均采用IBM SPSS Statistics 19与Origin 9.1进行数据分析,以平均值±标准差的形式呈现。
2 结果与分析
2.1 螺旋藻渣组成成分分析
螺旋藻渣中主要成分含量见表1。

表1 螺旋藻渣中主要成分含量(干基)Table 1 Contents of the basic components in spirulina residue(dry basis)
螺旋藻渣主要营养成分含量如表1所示,螺旋藻渣中水分含量为6.28%,灰分含量为7.41%,脂肪含量为4.39%,粗蛋白含量达48.08%,总糖含量为5.37%,色素类物质含量为28.47%。董育红等[16]曾报道指出螺旋藻中水分含量为4.50%,灰分含量6.20%,粗蛋白含量为69.30%,脂肪含量5.36%,总糖含量10.44%。虽然螺旋藻渣营养成分中蛋白质含量、脂肪含量和总糖含量低于螺旋藻本身,但它依然是一种蛋白质含量较高的低值副产物原料,具有一定的利用价值。
2.2 螺旋藻渣元素含量分析
螺旋藻渣中常量元素含量见表2,螺旋藻渣中重金属含量见表3。
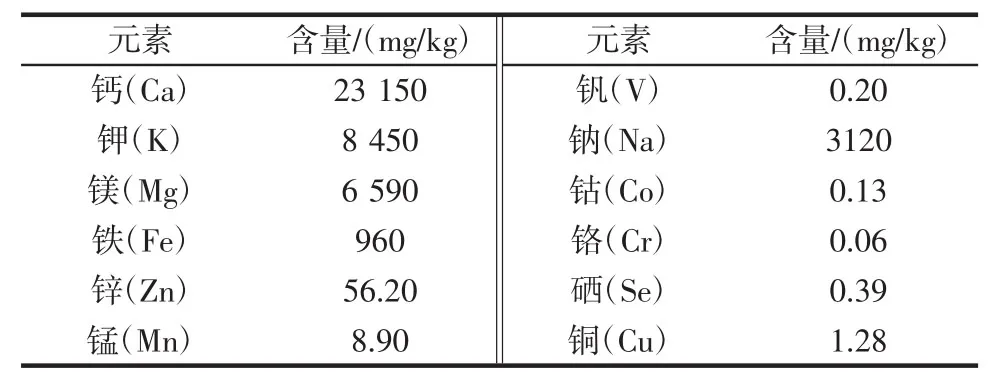
表2 螺旋藻渣中常量元素含量(干基)Table 2 Contents of major elements in spirulina residue(dry basis)

表3 螺旋藻渣中重金属含量(干基)Table 3 Contents of heavy metal in spirulina residue(dry basis)
螺旋藻渣常量元素含量如表2所示,其中钙含量较高为23 150 mg/kg,微量元素钾、铁、锌等含量也很丰富,所以将螺旋藻渣开发为动物饲料是一种良好的元素补充剂。螺旋藻渣中重金属元素含量如表3所示,与国标GB 5009.268-2016《食品安全国家标准食品中多元素的测定》的比较,由表可知螺旋藻渣中含有铅为0.01 mg/kg,其他重金属元素均未检出,符合国家食品安全标准。
2.3 螺旋藻渣氨基酸组成与总氨基酸含量
螺旋藻渣中氨基酸组成对其作为菌种发酵原料具有重要的参考意义,螺旋藻渣氨基酸组成如表4所示。

表4 螺旋藻渣的氨基酸组成(干基)Table 4 Amino acids composition of spirulina residue(dry basis)
由表4可见,螺旋藻渣中含有氨基酸种类齐全,总量达到370.2 mg/g。闫春宇等[17]研究显示螺旋藻中总氨基酸含量在309.94 mg/g~505.95 mg/g;螺旋藻渣中总氨基酸含量与此研究中的报道值相近。与螺旋藻相比,螺旋藻渣中各氨基酸含量均低于螺旋藻,但氨基酸含量的总体趋势未发生变化,特别是谷氨酸、天冬氨酸、丙氨酸、亮氨酸含量尤为突出。因此,螺旋藻渣氨基酸含量高、种类丰富,可作为培养菌种生长繁殖的良好基料。
2.4 不同发酵冻干产物中可溶性蛋白含量分析
不同发酵冻干产物中可溶性蛋白含量见图1。

图1 不同螺旋藻渣发酵冻干产物中可溶性蛋白含量Fig.1 Soluble protein content in lyophilized products of different spirulina residue fermentation
图1表明,不同菌种发酵螺旋藻渣的上清液冻干产物中,可溶性蛋白含量最高的是地衣芽孢杆菌YA269发酵产物,含量为27.6 mg/mL,其次为枯草芽孢杆菌YA215和罗伊氏乳杆菌LT906发酵产物,含量分别为21.4 mg/mL和15.2 mg/mL,酵母菌NBRC10858和保加利亚乳杆菌YB177发酵产物与空白组没有显著性差异(P>0.05)。枯草芽孢杆菌和地衣芽孢杆菌分别是中性蛋白酶和碱性蛋白酶的重要生产菌株[18-19],因此其发酵产物中可溶性蛋白的来源可能是蛋白酶和部分螺旋藻渣蛋白的混合物。万心怡等[20]和徐海燕等[21]研究表明罗伊氏乳杆菌生长代谢过程中产生的细菌素是一类具有蛋白特性的物质,故推测罗伊氏乳杆菌发酵产物中可溶性蛋白部分为细菌素。
2.5 不同发酵冻干产物中多肽含量分析
不同菌种发酵螺旋藻渣的发酵产物中多肽含量见图2。
由图2可知,发酵产物中多肽含量相对较高的为枯草芽孢杆菌YA215和地衣芽孢杆菌YA269发酵液,两者并无显著性差异(P>0.05)。在发酵过程中,由于枯草芽孢杆菌YA215和地衣芽孢杆菌YA269自身代谢产生的蛋白酶能酶解螺旋藻渣蛋白,因而发酵产物中多肽含量比其他3种菌株发酵液偏高。
2.6 不同发酵冻干产物的抗氧化能力
不同螺旋藻渣发酵产物对DPPH和ABTS+自由基清除能力如图3所示。

图2 不同螺旋藻渣发酵冻干产物中多肽含量Fig.2 Poly peptide content content in lyophilized products of different spirulina residue fermentation

图3 不同螺旋藻渣发酵冻干产物对DPPH和ABTS+自由基清除能力Fig.3 The free radical scavenging capacity of different spirulina residue fermentation lyophilized products to DPPH and ABTS
5种螺旋藻渣发酵冻干产物中,枯草芽孢杆菌YA215、地衣芽孢杆菌YA269和罗伊氏乳杆菌LT906有较好的清除DPPH自由基的能力,但三者数值较为接近,并无太大差异性(图3A)。在ABTS+自由基清除能力上,5种菌株发酵液均有一定的清除ABTS+自由基效果,枯草芽孢杆菌YA215和地衣芽孢杆菌YA269发酵液清除ABTS+自由基能力最为突出,清除率均达到75%以上(图3B)。因此,总体来说,枯草芽孢杆菌YA215和地衣芽孢杆菌YA269发酵产物抗氧化能力最强,其次为罗伊氏乳杆菌LT906,酵母菌NBRC10858和保加利亚乳杆菌YB177发酵产物抗氧化能力最弱。
2.7 不同发酵冻干产物的体外胆酸盐结合能力
体外胆酸盐的结合能力强弱是降血脂活性的重要体现[22],不同螺旋藻渣发酵冻干产物对胆酸盐结合能力见图4。

图4 不同螺旋藻渣发酵冻干产物对胆酸盐结合能力Fig.4 The capacity of different spirulina residue fermentation lyophilized products to bind sodium cholate
如图4所示,5种螺旋藻渣发酵产物对不同胆酸盐的结合能力趋势保持一致性。与阳性对照考来烯胺相比,胆酸盐结合能力相对较强的是罗伊氏乳杆菌LT906发酵产物,其次为枯草芽孢杆菌YA215和酵母菌NBRC10858发酵产物,最弱的是地衣芽孢杆菌YA269和保加利亚乳杆菌YB177。有研究报道指出,乳酸菌等益生菌在生长发酵过程中产生的胞外多糖及细菌素具有调控降血脂降血糖等功能活性[23]。因此,螺旋藻渣发酵产物的胆酸盐结合能力可能也与此有关。
2.8 不同发酵冻干产物的抑菌活性
不同螺旋藻渣发酵冻干产物对致病菌的抑菌率见表5。
由表5可知,酵母菌NBRC10858对食源性致病菌均没有抑菌效果,抑菌效果较好的是枯草芽孢杆菌YA215和地衣芽孢杆菌YA269发酵产物,这可能是由于其发酵产物中的可溶性蛋白和小分子多肽物质发挥了抗菌作用[24-25]。罗伊氏乳杆菌LT906和保加利亚乳杆菌YB177对5种致病菌也有不同程度的抑菌效果,这可能是由于乳酸菌生长代谢过程中产生的有机酸及细菌素起到了一定的抗菌作用。吴惠贞等[26]研究表明罗伊氏乳杆菌发酵液对大肠杆菌具有良好抑菌效果,且分析其抑菌物质可能是由小分子肽、有机酸和过氧化氢等组成。魏薇薇等[27]研究的保加利亚乳杆菌发酵液对金黄色葡萄球菌和大肠杆菌也有不同程度的抑菌效果。

表5 不同螺旋藻渣发酵冻干产物对致病菌的抑菌率Table 5 The inhibition rate of different spirulina residue fermentation lyophilized products to pathogenic bacteria %
3 结论
螺旋藻渣是一种蛋白质含量高,氨基酸种类丰富的副产物原料,经枯草芽孢杆菌YA215和地衣芽孢杆菌YA269两种菌株发酵后,发酵产物中可溶性蛋白和小分子多肽含量得到显著提高,且抗氧化能力增强,对食源性致病菌具有广泛的抑菌作用。同时,螺旋藻渣经罗伊氏乳杆菌LT906发酵后,其发酵产物表现出良好的体外降血脂活性。因此,若将发酵后的螺旋藻渣应用于饲料配料,则可提高动物的抗病性,从而有效提高螺旋藻渣的价值。本研究为螺旋藻渣资源的开发利用提供了一条新途径。
