氨基酸-纤维素复合材料的模拟酶对邻苯二甲酸酯塑化剂的降解
2020-12-22李霞郝思嘉韩爱玲杨亚瑜方国臻刘继锋王硕
李霞,郝思嘉,韩爱玲,杨亚瑜,方国臻,刘继锋,*,王硕 ,2,*
(1.天津科技大学食品营养与安全国家重点实验室,天津300457;2.南开大学医学院,天津300071)
邻苯二甲酸酯(phthalic acid esters,PAEs),是一类人工合成的有机化合物,作为一种增塑剂,广泛应用于食品包装材料的生产和加工中[1]。PAEs与聚合物基质的结合方式主要通过物理结合,而非化学共价键结合,因此在PAEs使用及处理过程中很容易以直接或间接方式从包装材料中渗漏到食品中,从而导致食品安全问题[1-2]。据统计人类通过食物、饮用水以及接触包装材料PAEs的每日摄取量可高达70 μg/kg[2-3]。此外,一些PAEs被认为是诱变剂、致癌物、肝毒素,即使在低浓度条件下也可能对人类健康造成威胁,例如损害人类的生殖健康和生长发育[1,4]。因此,如何有效控制PAEs日益引起人们的重视,美国环境保护局(United States Environmental Protection Agency,US EPA)和欧盟已经将6种PAEs列入优先控制污染物名单中。
目前报道了很多方法用来降低PAEs的污染,包括微生物转化[5]、光催化氧化[6]、吸附[7]、生物吸收[8]以及酶水解[9]等。微生物降解是降低PAEs污染的主要应用方法,但是它在自然环境中对PAEs的水解速度慢、效率低,且很难降解带有长链的PAEs。酶水解是一种高效降低PAEs污染的方法,有研究报道利用角质酶和酯酶可高效降解邻苯二甲酸二(2-乙基己)酯[di(2-ethylhexyl)phthalate,DEHP][9],但是由于天然酶复杂的制备工艺、低稳定性、高成本以及严格的反应介质使得天然酶的应用受到限制。因此开发一种既具有天然酶的催化活性又能克服天然酶本身弱点的人工模拟酶具有重要的科学价值。
近年来,以天然酶为模拟对象的模拟酶受到研究者的广泛关注,他们主要是通过模拟天然酶的催化机制和结构特征来获得催化活性。目前,常用做酯酶模拟物的材料有金属有机骨架[10]、碳纳米管[11]、氧化石墨烯[12]、聚合物[13]、多肽[14-15]等。丝氨酸蛋白酶作为一种重要的水解酶,可以有效水解酯键[16]。本研究以价格低廉的微晶纤维素作为骨架材料,连接丝氨酸蛋白酶活性位点氨基酸(丝氨酸、组氨酸、天冬氨酸),也称为催化三联体[17],构建一种酯酶模拟物,并研究此模拟酶对PAEs的降解效果,为食品和工业领域中塑化剂的降解提供了一定理论基础。
1 材料与方法
1.1 材料与试剂
微晶纤维素(microcrystalline cellulose,MCC)(分析纯):上海源叶生物科技有限公司;高碘酸钠(分析纯):上海麦克林生化科技有限公司;氢氧化钠、硼氢化钠、盐酸羟胺、磷酸二氢钠、磷酸氢二钠、溴化钾(分析纯):上海笛柏化学品技术有限公司;百里香酚蓝(分析纯):上海迈瑞尔化学技术有限公司;组氨酸(H)、天冬氨酸(D)、丝氨酸(S)、色氨酸(W)(分析纯):国药集团化学试剂有限公司;正己烷(色谱纯)、邻苯二甲酸(phthalic acid,PA,纯度 99.5%)、邻苯二甲酸二(2-乙基己)酯[di(2-ethylhexyl)phthalate,DEHP,纯度99%]、邻苯二甲酸二甲酯(dimethyl phthalate,DMP,纯度 99%)、邻苯二甲酸二丁酯(dibutyl phthalate,DBP,纯度 99%):上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
F-2500荧光分光光度计:日本Hitachi公司;TG16-Ⅱ离心机:长沙平凡公司;Merlin Compact扫描电子显微镜:德国Zeiss公司;QP2010 Ultral气相色谱质谱联用仪(gas chromatography-mass spectrometry,GC-MS):日本岛津公司;X射线光电子能谱仪(ESCALAB-MKII):英国VG公司;傅里叶红外光谱仪(IS 50):美国 Thermo Fisher公司。
1.3 方法
1.3.1 二醛基纤维素的制备
参照文献制备二醛基纤维素[18]:精确称取7.2 g微晶纤维素溶于445 mL水中,配置成悬浊液,再称取11.4 g高碘酸钠迅速加入到含有MCC的悬浊液中,为避免光照导致的氧化分解,反应需在避光下进行。将上述反应瓶置于磁力搅拌器上,在水浴温度48℃,转速1 000 r/min条件下进行搅拌。反应19 h后,将瓶中反应物进行离心,转速5 000 r/min,离心时间5 min,弃去上清液,沉淀加入超纯水重复多次进行离心洗涤,得到二醛基纤维素(2,3-dialdehyde cellulose,DAC)。
1.3.2 二醛基纤维素氧化程度的测定
利用盐酸羟胺滴定法测定DAC的氧化度值(oxidation degree,OD)[19],DAC 中的醛基可以与盐酸羟胺的氨基通过席夫碱反应,然后用氢氧化钠滴定反应释放出盐酸来计算氧化度。计算公式如下。

式中:V2为DAC消耗氢氧化钠的量,mL;V1为空白试验消耗氢氧化钠的量,mL;C为氢氧化钠的浓度,mol/L;m为称取的质量,g;161为纤维素中单位葡萄糖转化为50%二醛基的平均分子量。
1.3.3 氨基酸与纤维素复合材料的制备
称取0.1 g DAC溶于3.6 mL磷酸盐缓冲液(pH 8.0,25 mmol/L) 中,加入 0.4 mL 100 mmol/L氨基酸(amino acids,AAs)溶液,在25℃条件下搅拌反应6 h,再加入20 μL 2 mol/L硼氢化钠还原席夫碱。反应结束后,混合物置于透析袋中透析12 h,以除去未反应的氨基酸,从而得到氨基酸与纤维素复合材料(DAC-AAs)。
1.3.4 氨基酸与纤维素复合材料的表征
1.3.4.1 红外光谱测定
傅里叶红外光谱是一种灵敏度高的检测技术,它可以对样品的官能团及结构进行鉴定,以确定样品种类和性质。试验取复合材料与溴化钾混匀、研磨、压片后在25℃的条件下进行测定,仪器参数设置为扫描分辨率4 cm-1,扫描次数36次,扫描范围4 000 cm-1~500 cm-1。使用OMNIC软件对获得图谱进行分析。
1.3.4.2 X射线衍射测定
试验将复合材料放入X射线衍射仪样品室中,仪器参数设置为扫描范围 3°~50°,扫描速度 4°/min,然后进行测定。试验所得X射线衍射谱图用jade程序进行分析。
1.3.4.3 扫描电子显微镜测定
扫描电子显微镜通过电子束轰击样品表面,与样品表面相互作用而产生二次电子来对样品的形貌进行表征。试验用导电胶将样品固定,在5 kV电压下,通过具有牛津能量色散谱仪扫描电子显微镜对复合材料进行测量分析,得到其对应的扫描电子显微镜图。
1.3.5 纤维素上连接的氨基酸定量
通过测定色氨酸(W)的荧光光谱来定量连接到纤维素上的氨基酸量。在激发波长280 nm,发射波长350 nm,激发和发射狭缝宽度5 nm的条件下测定荧光光谱。
1.3.6 氨基酸与纤维素复合材料水解活性的测定
取400 μL复合材料溶液加入550 μL Tris缓冲液中,再加入 50 μL PAEs(2 000 mg/L),置于恒温振荡器上反应48 h。反应结束后,用正己烷提取反应物,取上层有机相用于GC-MS测定。试验以未加复合材料作为对照组。测定条件如下:采用DB-5柱(30 m×0.25 mm,0.25 μm);氦气作为载气;不分流进样;进样量为1 μL;色谱柱升温程序:初始温度100℃,保持3 min,以10℃/min升温至300℃,保持7min。质谱条件:EI离子源;电离能量为70 eV;离子源温度为230℃;传输线温度为250℃;离子采用全扫描方式检测。
降解率计算公式如下。
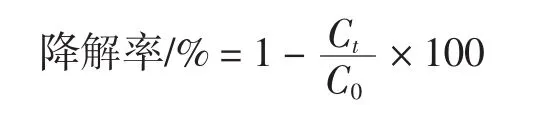
式中:Ct是试验组的 PAEs浓度,mg/L;C0是对照组中PAEs浓度,mg/L。
1.4 数据处理
所有数据均平行测定3次,采用origin 8软件进行数据整理和作图。
2 结果与分析
2.1 红外光谱分析
MCC、DAC和DAC-AAs的红外光谱图见图1。
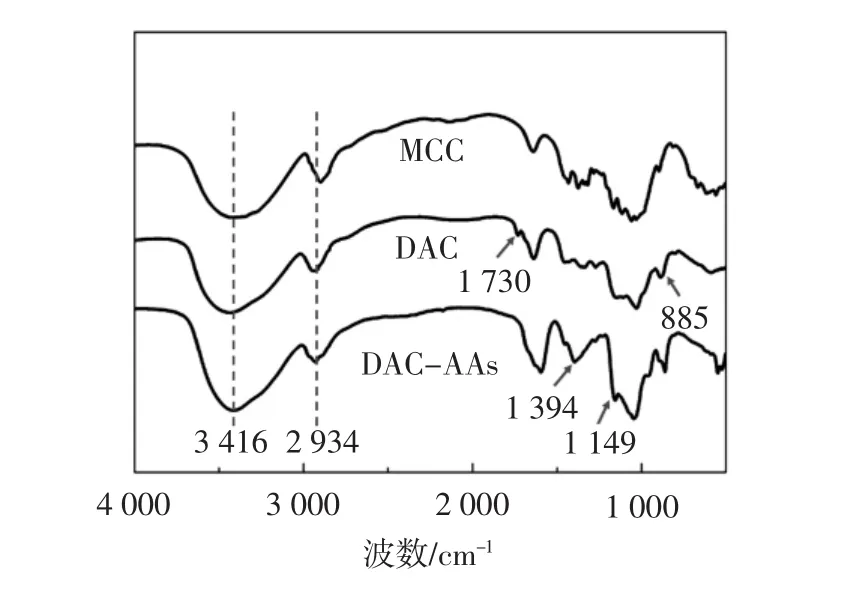
图1 MCC、DAC和DAC-AAs的红外光谱图Fig.1 Founer transform infrared spectra of MCC,DAC and DAC-AAs
由图1可知,3 416 cm-1处的吸收峰是葡萄糖单元中的O-H伸缩振动峰;2 934 cm-1处的吸收峰是吡喃葡萄糖环上的-CH2振动吸收峰[18]。相比于MCC,制备的氧化度78%的DAC在1 730 cm-1处呈现吸收峰,这是醛基(-CHO)的特征吸收峰;885 cm-1处是半缩醛的伸缩振动峰,这些说明MCC上C2-C3位上的仲羟基被成功氧化为醛基。当连接氨基酸后,1 730 cm-1处的峰变小,DAC-AAs在1 394 cm-1处出现新的峰,这是CN伸缩振动吸收峰,在1 149 cm-1是氨基酸羧基上的C-O振动,说明氨基酸被成功连接到纤维素上。
2.2 X-射线衍射分析
MCC、DAC和DAC-AAs的X射线衍射图谱见图2。
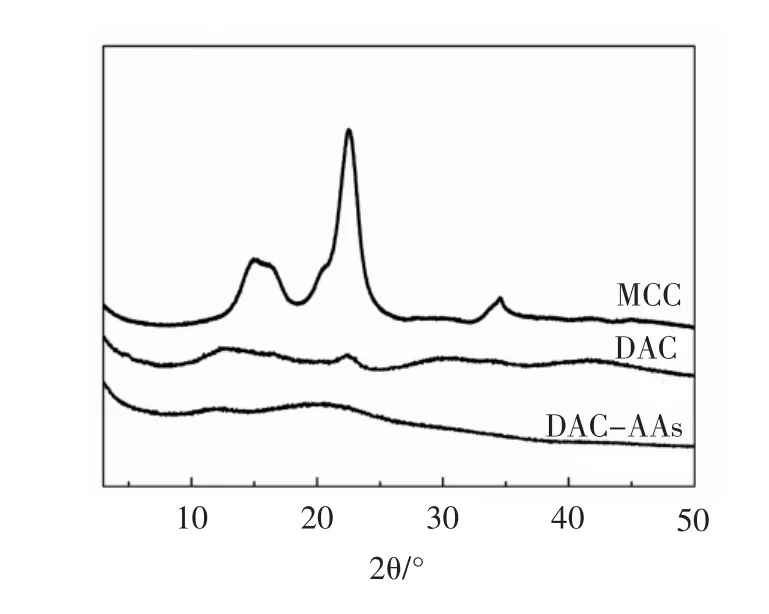
图2 MCC、DAC和DAC-AAs的X射线衍射图谱Fig.2 X-ray diffraction patterns of MCC,DAC and DAC-AAs
X-射线衍射分析是测定聚合物结晶度的常用手段,利用其衍射图谱可以定性物质的组成和结构。从图2可以看出,在MCC的内部存在着明显的结晶区,2θ 为 15.5°、22.5°、34.4°处有强的衍射峰。当 MCC 经过NaIO4氧化为DAC后,衍射峰减少,仅在22.5°附近存在小衍射峰,说明纤维素的结晶结构被破坏,纤维素大分子从高度有序排列变成无序排列。当连接氨基酸后,DAC-AAs没有衍射峰出现,说明没有结晶结构出现。
2.3 扫描电子显微镜分析
MCC、DAC和DAC-AAs的扫描电子显微镜图见图3。
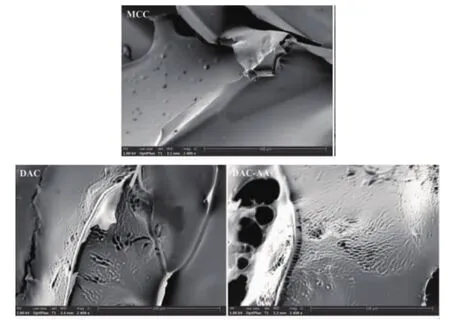
图3 MCC、DAC和DAC-AAs的扫描电子显微镜图Fig.3 Scanning electron microscope images of MCC,DAC and DAC-AAs
由图3可知,MCC的表面较光滑;DAC表面变得褶皱粗糙,呈现了裂纹和深浅不一的侵蚀条纹,说明NaIO4对MCC的结构具有侵蚀作用,这可能是由于经过NaIO4氧化之后,脱水葡萄糖单元的C2-C3键被破坏了,而葡萄糖苷环的断裂导致了表面的不平整,进一步增大了分子间的孔隙[20]。DAC-AAs是DAC进一步修饰氨基酸后的形貌,与DAC比形貌未发生较大变化,但粗糙面和侵蚀条纹更加明显。
2.4 定量纤维素上连接的氨基酸
不同浓度色氨酸的荧光光谱和定量色氨酸浓度的标准曲线图见图4。
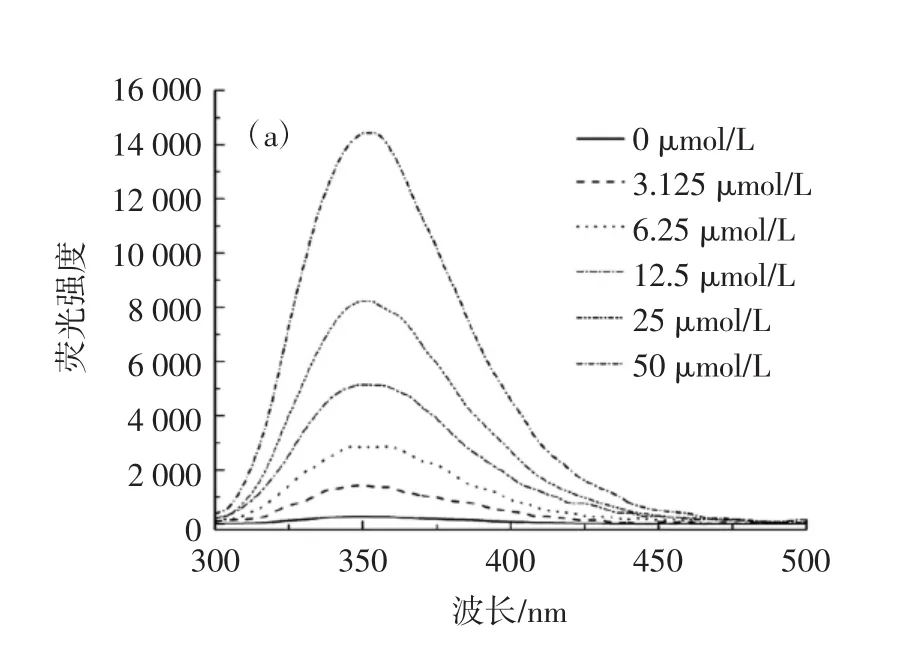
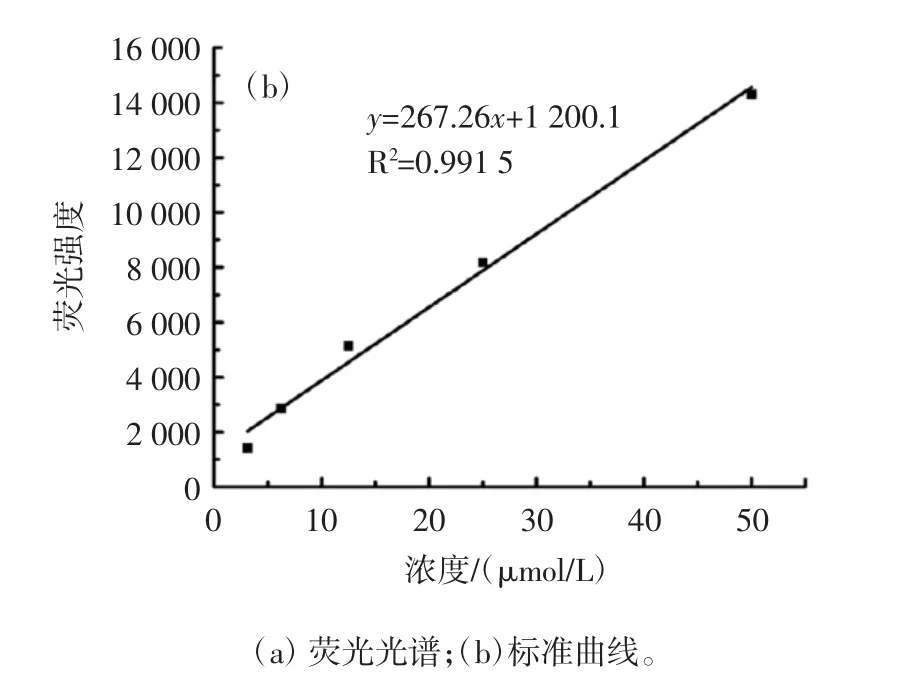
图4 不同浓度的色氨酸的荧光光谱和用于定量色氨酸浓度的标准曲线Fig.4 Fluorescence spectra of different concentrations of tryptophan and a standard curve for quantifying tryptophan concentration
试验采用荧光定量的方法来量化连接在纤维素上的氨基酸量。色氨酸(W)是天然氨基酸中具有荧光性质的氨基酸,在激发波长为280 nm处,它的发射波长为350 nm。用色氨酸代替丝氨酸、组氨酸和天冬氨酸结合到纤维素上,根据浓度及浓度对应的荧光强度绘制标准曲线,计算得到连接到纤维素上的氨基酸量为4.15 mg。
2.5 模拟酶的水解试验
为了验证构建的模拟酶是否具有降解塑化剂的能力,首先选择塑化剂中分布最广且占有率最高的DEHP为降解底物。据报道世界上40%~50%的PAEs是DEHP[21],它广泛分布于液体食物中,如橄榄油(>24 μg/g)、牛奶(约215μg/L)、白酒(5mg/kg)以及饮用水(约3.47μg/L)、地表水(0.013μg/L~18.5μg/L)、地下水(约 5.66μg/L)、污水(0.716 μg/L ~122 μg/L)中[3,22-24]。
试验分别研究了 DAC、H、S、D、DAC-H、DAC-S、DAC-D、DAC-HS、DAC-HD、DAC-SD、DAC-HSD 对DEHP的降解活性见图5。
结果发现,DAC不能够降解DEHP,而单独的氨基酸中除了H表现出较低的降解活性外,S和D均未显示出降解DEHP的能力,这是由于游离氨基酸没有形成一定的结构因而活性低。当氨基酸与纤维素结合后,构成的模拟酶对DEHP的降解能力均高于单独的氨基酸,说明纤维素作为支架材料有促进水解的作用;且DAC-H降解能力高于DAC-S,说明组氨酸对于模拟物水解活性起到重要作用,因为组氨酸的咪唑基在质子转移系统中既可以接受也可以给予质子[15,25]。相比于含两个氨基酸的复合材料,具有催化三联体的复合材料模拟酶具有最高的活性,对DEHP的降解率可以达到60.1%,这可能是由于天冬氨酸(D)羧基与组氨酸(H)咪唑基通过氢键作用,增加了组氨酸咪唑基上氮原子的pKa值,使其成为碱;咪唑基上的氮对丝氨酸羟基去质子作用,进一步对底物进行亲核进攻。
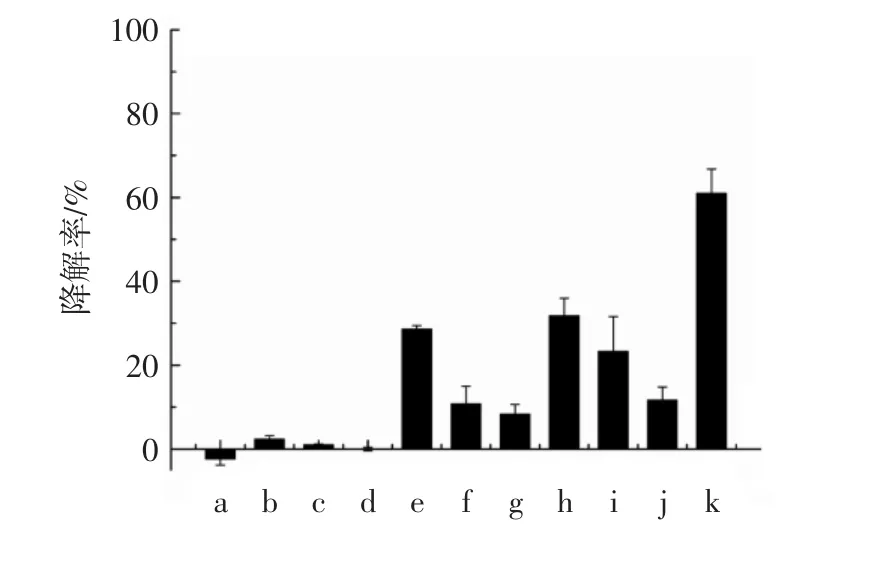
图5 不同的氨基酸与醛基化纤维素为基础的模拟酶对DEHP的降解Fig.5 The DEHP degradation rates by different DAC-AAs
2.6 温度对模拟酶催化活性的影响
温度对于模拟酶DAC-HSD降解DEHP的影响见图6。
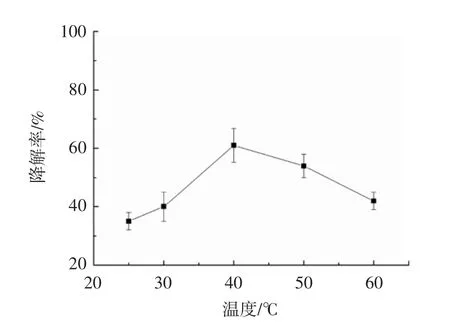
图6 温度对于模拟酶DAC-HSD降解DEHP的影响Fig.6 The effect of temperature on the degradation rates of DEHP by DAC-HSD
反应温度会影响活性位点的构型和酸碱催化中心取向。由于不同的热稳定性,酶具有各自最佳温度,催化反应的速率通常随温度增加,但是当酶达到最佳温度时,由于酶是自然界中的蛋白质,当继续升高温度,可能促使酶失活,反而导致酶促反应速率降低[26]。在氨基酸和纤维素组合物的模拟酶系统中,结果表明模拟酶的降解率随转变温度的升高先升高后降低,并且在40℃的温度条件下降解率达到最大值。结果表明,模拟酶DAC-HSD的最佳反应温度为40℃。
2.7 pH值对复合材料催化活性的影响
pH值对于模拟酶DAC-HSD降解DEHP的影响见图7。
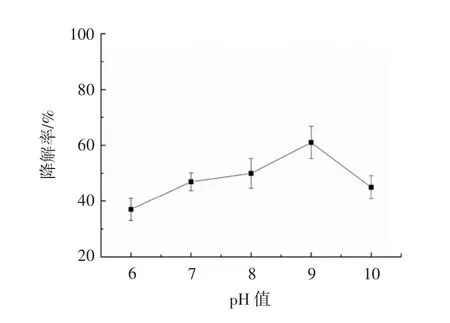
图7 pH值对于模拟酶DAC-HSD降解DEHP的影响Fig.7 The effect of pH on the degradation rates of DEHP by DAC-HSD
pH值是影响酶活性的另一个重要因素,它通过影响酶分子中氨基酸的质子化状态影响底物与酶分子间电荷转移,从而影响酶与底物的结合,最终影响酶催化的反应速度[26]。
当反应溶液的pH值高于或低于最适pH值时都会使酶的催化活性下降,且过酸或过碱还会导致酶变性失活。在氨基酸与纤维素复合材料的模拟酶体系中,结果表明在pH 6~10范围内,模拟酶对DEHP的降解率随pH值的升高先增加,当pH值为9.0时,降解率达到最大值,之后随着pH值的继续升高,模拟酶对DEHP的降解率呈下降趋势。表明复合材料模拟酶DAC-HSD的最佳pH值为9.0。
2.8 模拟酶对DEHP、DBP、DMP 3种底物降解的比较
模拟酶DAC-HSD对DMP、DBP和DEHP降解率见图8。
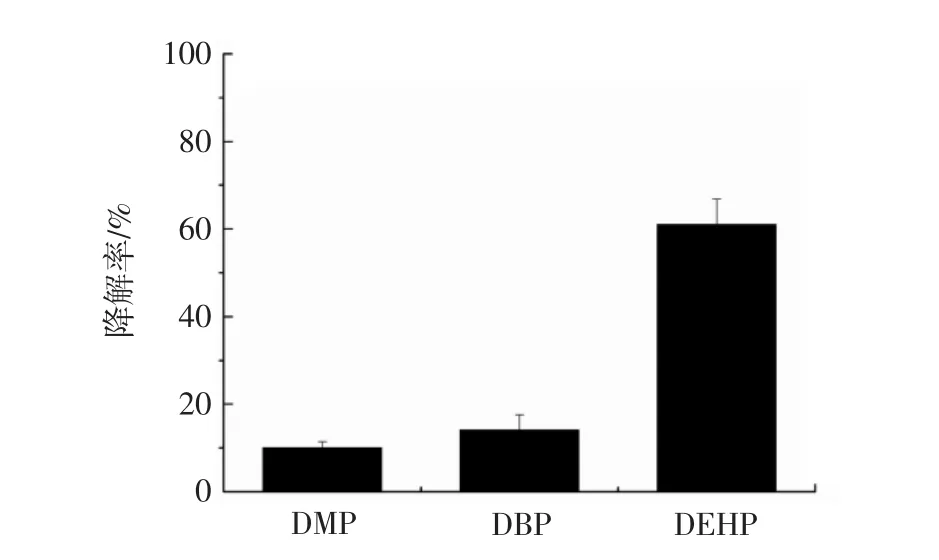
图8 模拟酶DAC-HSD对DMP、DBP和DEHP降解率的比较Fig.8 The degradation rates of DMP,DBP and DEHP by DAC-HSD
DBP和DMP是仅次于DEHP被普遍使用的塑化剂[3],因此选择这两种塑化剂进一步研究模拟酶是否具有降解另外两种底物的能力。
由图8可知,模拟酶对DEHP具有最高的降解率,其次是DBP、DMP,降解率顺序为:DEHP(60.1%)>DBP(14%)>DMP(9.9%)。这可能是由于侧链烷基链的长短影响了降解率,具有相对较短侧链的塑化剂在此模拟体系中较难降解,而链长的塑化剂则容易降解,这可能由于链长的PAEs相比于链短的PAEs对酶的亲和力更高[5]。
2.9 分析降解产物
模拟酶对DEHP的降解及产物分析见图9。
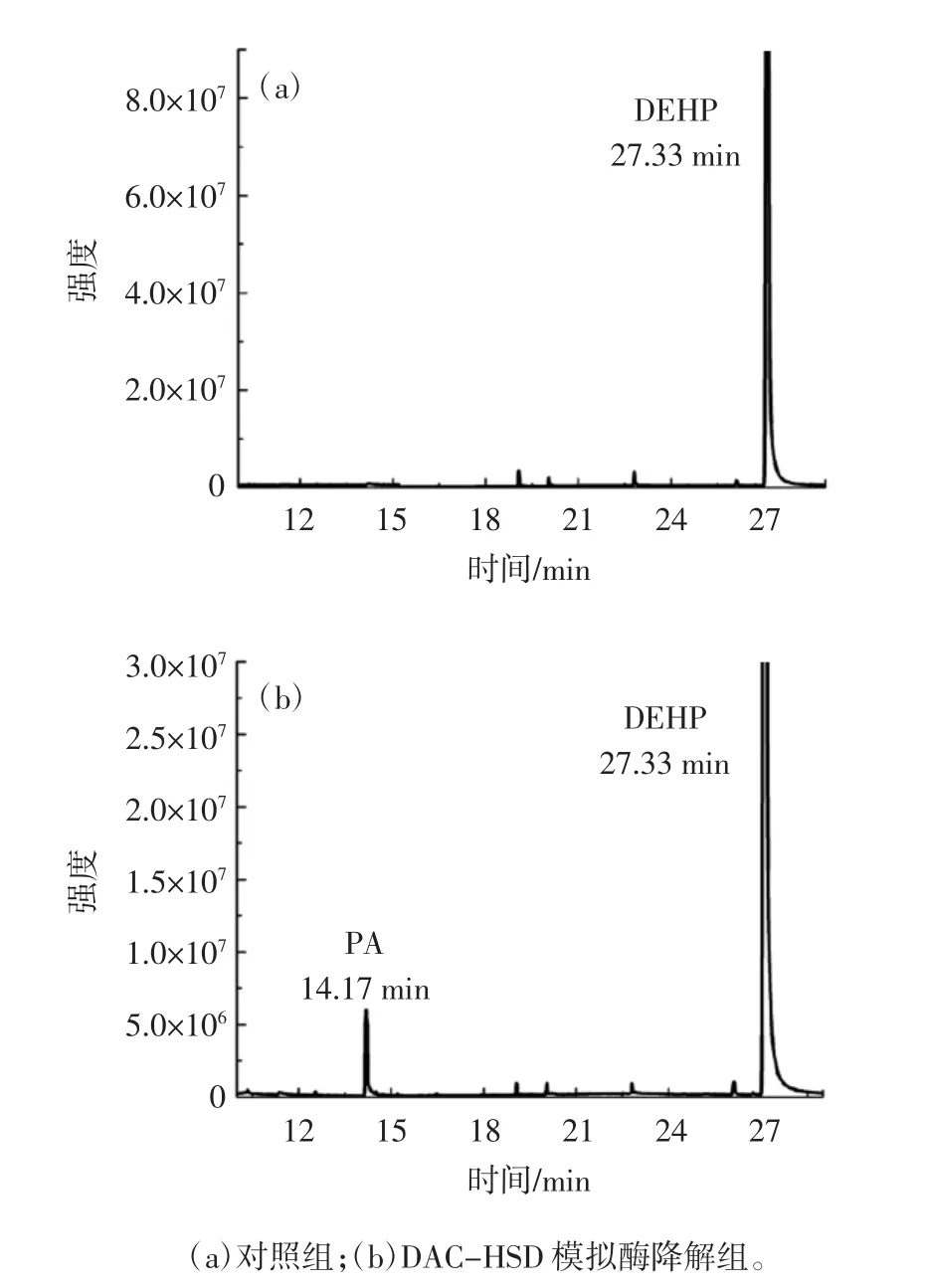
图9 GC-MS对DEHP降解及中间产物检测色谱图Fig.9 GC-MS chromatograms of DEHP and its degradation intermediates
DEHP降解后会产生相应的产物,试验进一步考察降解后产物,由图9可以看出,DEHP经过模拟酶DAC-HSD降解48 h后,产生的降解产物是邻苯二甲酸(PA),出峰位置在14.17 min。
3 结论
随着酶模拟物研究的迅速发展以及它们的突出优点,酶模拟物有可能成为天然酶最有力的竞争者,用于食品工业、化学、医学诊断等广泛领域,因此设计一种成本低、活性高的模拟酶愈发重要。本试验以成本低廉的MCC为原料,通过NaIO4选择性氧化2,3位羟基为双醛基,形成的DAC进一步通过席夫碱反应连接氨基酸,最后形成氨基酸-纤维素复合材料模拟酶。通过测定对DEHP塑化剂的降解率,证实DAC-HSD为最优模拟酶,它可以在pH 9.0、温度40℃条件下48 h内有效降解60.1%的DEHP;试验还进一步比较对另外两种塑化剂DMP和DBP的降解,发现降解率顺序:DEHP>DBP>DMP。本研究设计了一种经济有效的氨基酸-纤维素复合材料模拟酶,可以为食品和工业领域DEHP的降解提供重要参考。
