骆驼奶中外泌体对Ⅰ型糖尿病小鼠治疗的作用研究
2020-12-22张梦丹王浪李伟宋文丹肖袁俊陶帆倪伟胡圣伟
张梦丹,王浪,李伟,宋文丹,肖袁俊,陶帆,倪伟,胡圣伟
(石河子大学生命科学学院,新疆石河子832000)
随着人们饮食结构的改变,糖尿病患病率在逐渐上升,对我国人民健康的影响日趋严重,因此寻找方便可靠、安全绿色的方法来治疗糖尿病显得尤为重要[1]。骆驼奶是治疗慢性疾病一种食品[2],它的成分包括免疫调节蛋白、脂肪酸、重要矿物质、维生素和外泌体等,它具有抵抗炎症、保护肝脏和心脏、降低血糖等作用[3-7]。外泌体(exosome)由不同来源的细胞产生,是天然存在于人乳、牛乳等各种乳源液体的一种分泌小体,直径为30 nm~150 nm的膜状纳米囊泡[8-9],能够通过多种方式产生相互作用,如将受体与配体结合,进行胞吞作用等[10-11]。研究发现外泌体具有重要的生物学作用,可以作为检测和诊断疾病的生物标志物[12],同时也可以作为细胞间交流的特殊媒介[13-15]。
本试验通过超高速离心的方法分离了骆驼奶中的外泌体,通过电镜和反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR) 法鉴定提取的外泌体。利用高糖高脂饲料加链脲佐菌素(streptozotocin,STZ)诱导普通小鼠为糖尿病模型小鼠,灌胃外泌体溶液,对试验小鼠血糖和体重进行测量,初步探讨骆驼奶中外泌体降糖效果,为进一步研究外泌体的效果奠定基础,也为糖尿病的新药开发提供理论依据。
1 材料与方法
1.1 实验动物
5周~6周龄的雌性C57BL/6J小鼠:石河子大学;普通饲料、高脂高糖饲料:达尔文生物有限公司;小鼠均在25℃的动物室中分笼饲养,并保持自然光照,并自由摄入食物和水。
1.2 主要试剂与仪器
骆驼奶(泌乳期为6个月):新疆天山牧场;盐酸二甲双胍缓释片(批号H20060815):山西华元医药生物技术有限公司;链脲佐菌素(批号WXBC8740V):美国SIGMA公司;蛋白定量试剂盒:北京康为世纪生物科技有限公司;聚合酶链式反应(PCR)引物:北京睿博兴科生物技术有限公司合成;Trizol试剂、磷酸缓冲盐溶液(phosphate buffer saline,PBS)等:生工生物工程上海有限公司。
Accu-Chek Active罗氏活力血糖仪及血糖试纸:罗氏血糖健康医护公司;Beckman Optima XPN-100 Ultracentrifuge智能型高效离心机:贝克曼库尔特有限公司;精密电子天平:常州市衡正电子仪器有限公司;Varioskan LUX酶标仪:赛默飞世尔科技(中国)有限公司。
1.3 骆驼奶中外泌体的制备
收集骆驼奶样品40 mL~50 mL。参照Marika等的方法[16],使用超高速离心法获得外泌体,具体步骤:将新鲜的骆驼奶样品在4℃下于2 000 g离心20 min,收集乳上清;将收集的乳上清在4℃下以12 000 g离心30 min,收集上清;重复一次上步骤。将40 mL的脱脂乳上清液在4℃以110 000 g离心60 min以获得上清乳浆。再将收集的乳上清放入4℃以110 000 g离心2 h收集沉淀,获得外泌体。将沉淀外泌体悬浮在PBS缓冲液中,得到的外泌体溶液放入-20℃冰箱保存,待用。
1.4 外泌体的鉴定
使用透射电子显微镜(transmission electron microscope,TEM)观察了骆驼奶中外泌体的形态和粒径大小。将10 μL外泌体悬浮液装载在无定形碳包覆铜网上。通过加入10 μL中性的1%磷钨酸进行负染。然后通过在80 kV加速电压下运行的TEM检查网格中的外泌体。参照Yassin等的方法[17],使用RT-PCR的方法鉴定所提取的外泌体,将收集的外泌体使用Trizol法提取外泌体总RNA,使用反转录试剂盒反转录成cDNA,GAPDH基因作为参考基因,α酪蛋白基因(α Casein)、β酪蛋白基因(β Casein)和 κ酪蛋白基因(κ Casein)作为标志基因,详细引物序列见表1。

表1 标志基因引物序列Table 1 Marker gene primer sequences
1.5 T1DM模型小鼠的构建
在注射药品之前,将小鼠禁食12 h。使用时将STZ溶于0.1 mol/L柠檬酸缓冲液中,并以70 mg/kg腹腔内给药,每隔3 d测血糖,直至模型组血糖显示值大于11.1 mmol/L后,重新喂食普通饲料,两周后检测血糖,检测糖尿病小鼠血糖的稳定性,Ⅰ型糖尿病小鼠制备完成。
1.6 动物分组及给药方案
将C57BL/6J小鼠分为两组,健康组(对照组)和糖尿病模型小鼠组。将糖尿病模型小鼠随机分为3组:外泌体组、盐酸二甲双胍缓释片组、模型对照组,分组标记。
将所有的药物(包括生理盐水、外泌体溶液、盐酸二甲双胍缓释片溶液),均通过每日定时灌胃给各组的方式观察效果。对照组每天灌胃0.02 mL/g生理盐水,外泌体组每天灌胃5 mg/kg制备好的外泌体,盐酸二甲双胍缓释片组每天灌胃由生理盐水配制的250 mg/kg盐酸二甲双胍缓释片溶液,模型对照组每天灌胃0.02 mL/g生理盐水。
1.7 血糖及体重的检测
成功造模型后在第 0、10、20、30、40 d 测量血浆葡萄糖的浓度和小鼠体重。使用血糖测试仪分别对禁食6 h的小鼠尾静脉收集血液测血糖浓度。使用电子称测量小鼠体重,记录。
1.8 统计学处理
数据采用统计学软件进行处理分析,n=10,各组数据以x¯±s表示,P<0.05 为差异显著。
2 结果与分析
2.1 骆驼奶中外泌体的形态鉴定
使用传统超速离心法提取的骆驼奶中外泌体在透射电子显微镜下可以观察到结构完整,直径小于100 nm,清晰的圆形的囊泡见图1,借助传统的超高速离心法成功获得完整的外泌体。
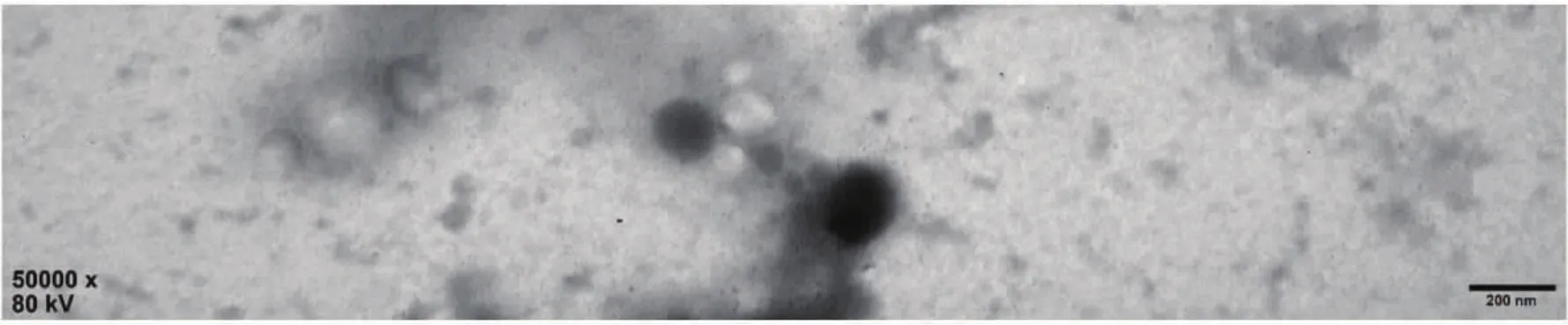
图1 透射电子显微镜下观察外泌体Fig.1 Exosomes observed under a transmission electron microscope
2.2 骆驼奶中外泌体标志基因的鉴定
使用RT-PCR法鉴定外泌体中标志基因。经过RT-PCR扩增后,产物经1%琼脂糖凝胶电泳分析,结果显示标志基因都正常表达且大小正确见图2。
2.3 小鼠形态特征观察
健康对照组小鼠生长及饮食状况正常,被毛有光泽。模型对照组小鼠出现多饮多食多尿现象,体重也明显减轻,具有糖尿病的典型症状。用外泌体和二甲双胍灌胃处理后,以上症状得到明显改善。
2.4 外泌体对T1DM小鼠血糖的影响
各组小鼠空腹血糖的变化见表2。
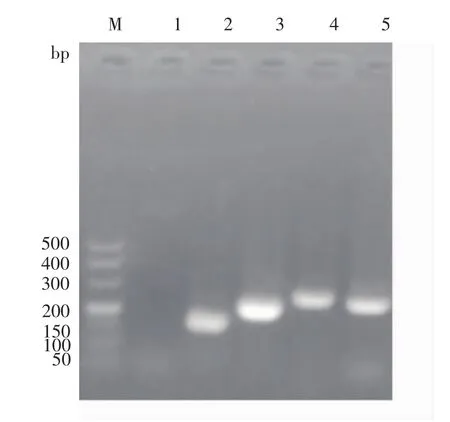
图2 外泌体内标志基因的鉴定Fig.2 Identification of marker genes in exosomes
表2 各组小鼠空腹血糖的变化(±s)Table 2 Changes in fasting blood glucose of mice in each group(x¯±s)
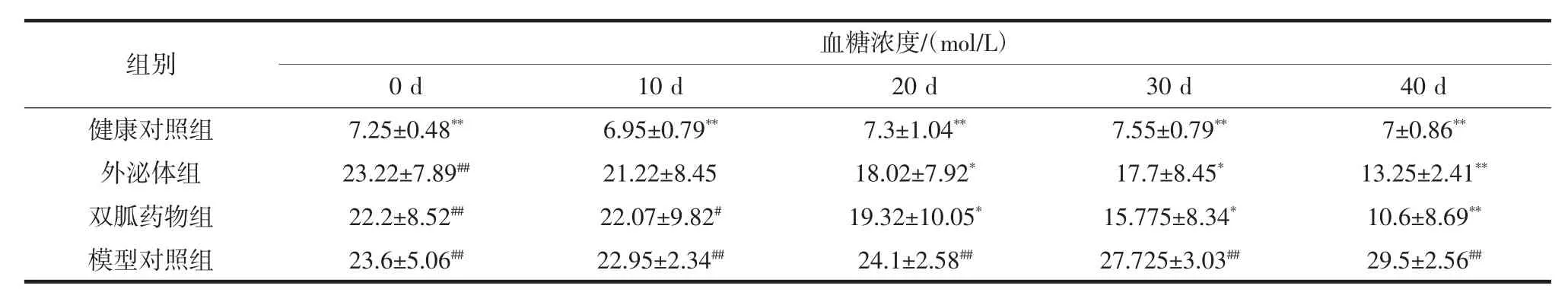
表2 各组小鼠空腹血糖的变化(±s)Table 2 Changes in fasting blood glucose of mice in each group(x¯±s)
注:##表示与健康对照组相比差异极显著(P<0.01);*表示与模型对照组相比差异显著(P<0.05);**表示与模型对照组相比差异极显著(P<0.01)。
组别血糖浓度/(mol/L)0 d 10 d 20 d 30 d 40 d健康对照组 7.25±0.48** 6.95±0.79** 7.3±1.04** 7.55±0.79** 7±0.86**外泌体组 23.22±7.89## 21.22±8.45 18.02±7.92* 17.7±8.45* 13.25±2.41**双胍药物组 22.2±8.52## 22.07±9.82# 19.32±10.05* 15.775±8.34* 10.6±8.69**模型对照组 23.6±5.06## 22.95±2.34## 24.1±2.58## 27.725±3.03## 29.5±2.56##
表2记录了0~40 d不同组的小鼠血糖浓度,结果表明,健康对照组的血糖浓度都是稳定在正常范围,模型对照组的血糖持续在高浓度,其中部分小鼠因血糖浓度过高死亡,这表明模型建造稳定。外泌体组和药物组与模型组比较小鼠的血糖发生明显的变化,在连续灌胃20 d后,血糖含量开始显著下降(P<0.05),直至灌胃结束,这两组与模型对照组的血糖相比表现为极显著差异(P<0.01)。外泌体与二甲双胍药物效果相比,效果相似,对小鼠高血糖具有明显的降低和控制作用,可见试验可以近一步研究外泌体的剂量,选取合适的浓度,更好的治疗糖尿病。
2.5 外泌体对T1DM小鼠体重的影响
各组小鼠空腹体重的变化见表3。
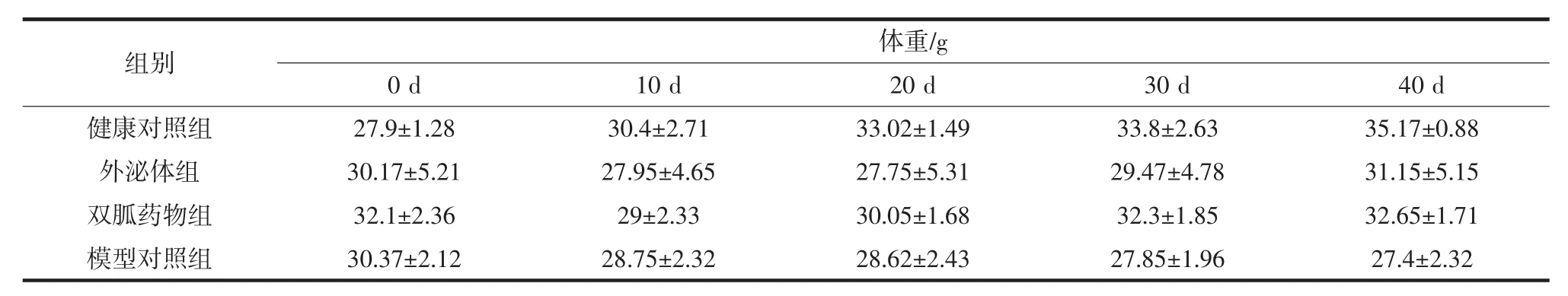
表3 各组小鼠空腹体重的变化Table 3 Changes in fasting weight of mice in each group
通过表3显示,直至灌胃结束后各组体重都发生了一定的变化。健康对照组的小鼠随着时间的变化,体重都在正常增加,模型对照组小鼠的体重,随着时间的变化,体重一直在降低,这属于糖尿病临床症状。而外泌体和二甲双胍组小鼠的体重都是先降低随后又小幅度升高,是随着血糖的变化,体重也相应发生了变化,灌胃结束后,体重接近健康对照组。
3 讨论与结论
糖尿病的主要临床表现是血糖浓度高,目前降糖药主要分为:胰岛素及其类似物、磺酰脲类促泌剂、二甲双胍类等,这些降糖药因具有见效快,作用久的优点在临床上获得了广泛的应用,但长期使用会让患者有其他的并发症。骆驼奶作为重要的经济农产品,很多研究表明它能够预防以及治疗糖尿病,能有效控制血糖含量并且保护肾脏和肝脏[18],但其作用机制尚不清楚。
研究发现脂肪组织巨噬细胞衍生的外泌体中携带的microRNA可以调节体内和体外胰岛素敏感性[19],这使研究者认为骆驼奶中的外泌体可能是骆驼奶治疗糖尿病的有效成分之一,并且可能是外泌体中含有的microRNA具有调节细胞分泌胰岛素的作用。已有相关研究表明口服外泌体给药方式具有一定免疫耐受性[20],同时也有相关研究表明外泌体在糖尿病心肌损伤的防治方面起重要作用[21],这为试验的可行性提供了依据。
本研究通过超速离心法分离鉴定了骆驼奶中的外泌体,对糖尿病小鼠进行40 d的灌胃处理,证明骆驼奶中外泌体能够降低STZ诱发的糖尿病的血糖浓度,起到治疗糖尿病的效果,而本试验的研究只是初步探究外泌体对糖尿病的治疗效果,后续应继续进行定量的研究,并且研究其作用途径以及机制,如外泌体中microRNA对糖尿病治疗所发挥的作用。
