干燥加热磷酸化修饰对鸭蛋清蛋白结构和抗氧化活性影响的研究
2020-12-22刘自单殷春雁李灿鹏
刘自单,殷春雁,李灿鹏
(1.红河卫生职业学院,云南红河661199;2.云南大学化学科学与工程学院,云南昆明650091)
机体的抗氧化能力依赖于抗氧化物质对氧自由基的清除能力[1]。正常情况下,抗氧化物质与自由基之间的作用处于平衡状态,平衡破坏可能导致细胞或组织损伤,甚至导致心血管疾病和癌症[2]。因此,迫切需要寻找一种安全、易吸收、营养、可食用,并具有很好抗氧化性的食品。鸭蛋是中国食品生产中最常用的蛋类之一,鸭蛋清蛋白(duck egg white protein,DEWP)容易被人体肠道所吸收[3]。目前,食品抗氧化性研究主要集中在从植物和动物资源中提取蛋白质[4]及筛选抗氧化肽,例如鱼类蛋白[5]、海产品[6]、牛奶[7]等,并且多集中在采用酶解法筛选抗氧化多肽[8-9]。
本课题组一直致力于采用干燥加热磷酸化修饰法对蛋清蛋白理化性质和功能进行研究,例如热稳定性[10-14]、起泡性和乳化性[11,14-16]、吸油性[14]、凝胶特性和胶体保水性[11,13]、被消化性[11]、磷酸钙可溶性[10-13]和抗氧化性[17]。干燥加热磷酸化过程中未加入有机试剂,是一种比较安全、简单、环保且容易实现工业化的食品改性方法。目前,已经报道了鸭蛋清蛋白具有抗氧化性[4],但鸭蛋清蛋白经磷酸化修饰后是否能影响其抗氧化性的研究尚未报道。本研究旨在确定干燥加热磷酸化修饰对鸭蛋清蛋白抗氧化的影响,为抗氧化性功能食品的开发提供一条新的思路。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
鸭蛋清蛋白的制备参照Naknukool等[3]的方法略作修改。具体为:取出新鲜鸭蛋蛋清,用1 mol/L HCl调节pH值至6.0,6 000 r/min离心20 min。取出上清液用10 kDa的透析袋透析1 d。冻干后获得鸭蛋清蛋白(native-duck egg white protein,N-DEWP)样品。
1.1.2 试剂
2,2-二氮-双-(3-乙基苯并噻唑-6-磺酸)-二铵盐(ABTS)、乙二胺四乙酸二钠:上海伊卡生物科技有限公司;1,1-二苯基-2-苦基肼(DPPH):上海源叶生物科技有限公司;亚铁嗪:Sigma;重硫酸钾:天津市风船化学试剂科技有限公司。其余试剂均为分析纯试剂。
1.1.3 仪器
UV-1800 PC型紫外-可见分光光度计:上海美谱达仪器有限公司;PHS-25型pH计:上海仪电科学仪器股份有限公司;FD-1-50真空冷冻干燥机:北京博医康实验仪器有限公司;FA 2004型电子天平:上海舜宇恒平科学仪器有限公司;实验室超纯水机:重庆圣德利医疗器械研究有限公司。
1.2 试验方法
1.2.1 干燥加热磷酸化鸭蛋清蛋白(phosphorylation of duck egg white protein,PP-DEWP)的制备
干燥加热磷酸化鸭蛋清蛋白的制备采用Li等[10]的方法。称取1 g N-DEWP样品,用焦磷酸钠溶液(100 mL,0.1 mol/L) 溶解,调节 pH 值为 3.0、4.0、5.0、6.0、7.0,冻干,然后85℃干燥加热1 d和3 d。用适量去离子水溶解干燥加热之后的样品,装入透析袋中透析2 d,再次冷冻干燥,得到干燥加热磷酸化鸭蛋清蛋白(PP-DEWP)样品。干燥加热鸭蛋清蛋白(dry-heating of duck egg white protein,DH-DEWP)样品的制备除不加入焦磷酸钠溶液外,同以上步骤。
1.2.2 磷含量的测定
样品中磷含量采用Chen等[18]的方法。总磷含量(Pt)的测定:在分解瓶中用2 mL 60%的高氯酸溶解10 mg蛋白样品,然后在电炉上加热至溶液澄清,继续加热30 min。冷却后加入10 mL去离子水,沸水浴20 min,冷却后定容到100 mL。配制混合液,混合液包括:(1)3 mol/L 稀 H2SO4,(2)2.5%钼酸铵溶液,(3)10%的抗坏血酸,按照体积比(1)∶(2)∶(3)∶蒸馏水=1 ∶1 ∶1∶2混合。分别取2 mL不同浓度的磷酸二氢钾标准溶液和定容后的PP-DEWP溶液,加入等体积的混合液,50℃水浴1 h,冷却后测定吸光度(820 nm)。根据磷标准曲线求出总磷含量。无机磷含量(Pi)的测定:在分解瓶中加入20 mg左右的PP-DEWP样品,加入5 mL水,再加入5 mL 10%三氯乙酸。3 000 r/min离心2 h,取上清液1mL定容到10 mL。分别取2 mL不同浓度的磷酸二氢钾标准溶液和PP-DEWP样品稀释液,加入等体积的混合液,混匀后在50℃水浴中加热1 h,冷却后在820 nm处测定吸光度值。
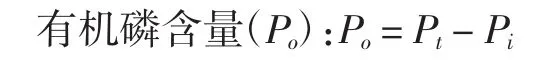
式中:Po为磷酸化修饰后样品中的磷含量,%;Pt为样品中总磷含量,%;Pi为样品中无机磷含量,%。
1.2.3 溶解性测定
样品的溶解性采用Lowry等方法[19]测定。将N-DEWP、DH-DEWP和PP-DEWP样品分别溶解在Tris-HC(l50 mmol/L,pH=7.0)的缓冲溶液中,调节浓度为1 mg/mL。3 000 r/min离心30 min得上清。配制0、0.05‰、0.15‰、0.20‰、0.25‰、0.30‰的牛血清蛋白标准溶液。配制混合液,混合液中各成分为(1)含10%Na2CO3的 0.5 mol/L氢氧化钠(NaOH)溶液,(2)1%的五水硫酸铜(CuSO4·5H2O)溶液,(3)2%的酒石酸钾钠溶液,体积比为(1)∶(2)∶(3)=20 ∶1 ∶1。取 0.5 mL 不同浓度的牛血清蛋白标准液和0.5 mL待测样品液,各加入混合液1 mL,25℃放置10 min,分别加入2 mL 1 mol/LFolin-酚试剂,50℃水浴加热15 min,冷却后,在500 nm处测定容液的吸光度。
1.2.4 表面巯基含量测定
表面巯基含量测定采用Ellman等[20]的方法。将N-DEWP、DH-DEWP、PP-DEWP 样品分别溶解在0.1 mol/L Tris-甘氨酸(pH=8.0)缓冲液中,使其浓度为1 mg/mL。在1.0 mL蛋白溶液中加入1.0 mL 0.1 mol/L Tris-甘氨酸(pH=8.0)的缓冲液(含0.01 mol/L的乙二胺四乙酸二钠盐溶液),在40℃加热30 min,再加入50 μL 5,5′-二硫代双(二硝基苯甲酸)[5,5′-二硫代双(二硝基苯甲酸)溶液(浓度为1 mol/L)用0.1 mol/L pH 8.0的Tris-甘氨酸的缓冲液溶解],在25℃水浴中加热10 min,在412 nm处测定其吸光度。计算公式:SH=A×1.953 9。
1.2.5 浊度和吸光度测定
浊度测定采用Li等[11]的方法。配制2 mg/mL的N-DEWP、DH-DEWP和PP-DEWP溶液,在595 nm处测定吸光度值即为浊度。配制1 mg/mL的N-DEWP、DH-DEWP和PP-DEWP蛋白溶液,在280 nm处测定吸光度值。
1.2.6 热稳定性测定
蛋白质热稳定性测定参考Li等[12]的方法,配制50 mmol/L Tris-HCl(pH7.0)的缓冲溶液,称取一定量的N-DEWP、DH-DEWP和PP-DEWP样品溶解于上述缓冲液中配成1 mg/mL的样品溶液,分别在60、70、80、90、100℃水浴加热 10 min,3 000 r/min 离心30 min,取上清液用Lowry法测定蛋白质浓度。离心前先用相机拍摄图片作为定性对比。
1.2.7 ABTS+自由基清除能力
ABTS+自由基清除能力根据Zhang等[21]的方法测定。7 mmol/L ABTS溶液:称取38.41 mg ABTS溶解在5 mL去离子水中;2.45 mmol/L重硫酸钾:称取6.61 mg重硫酸钾溶解在5 mL去离子水中;两溶液混合均匀,避光条件下放置16 h~24 h(让其充分氧化)。使用时用100 mmol/L pH 7.4磷酸盐缓冲溶液按照体积比1∶70稀释使用,现配现用。取稀释好的ABTS溶液4 mL,加入用磷酸盐缓冲液(phosphate buffer saline,PBS)配制好的 0.5、1.0、2.0、3.0、5.0、10.0 mg/mL 样品溶液各80 μL混匀,37℃水浴放置10 min,测定734 nm处的吸光度。平行3次,空白不加样品,以等量的磷酸盐缓冲液代替,样品抗氧化率计算如下。
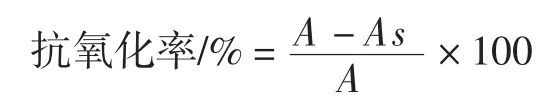
式中:As为样品的吸光度;A为空白的吸光度。
1.2.8 超氧阴离子自由基清除能力
超氧阴离子自由基清除能力根据Zhang等[22]的方法测定。称取一定量蛋白,用50 mmol/L pH 8.2 Tris-HCl缓冲液溶解蛋白质使其浓度为1 mg/mL。移取3 mL样品溶液,加入在25℃水浴中恒温的0.14上mL 5mmol/L邻苯三酚溶液(用10 mmol/L HCl溶液配制),混匀,快速倒入比色皿中,每30 s测定325 nm处的吸光度,测定4 min。空白组以等量的10 mmol/L HCl代替邻苯三酚溶液;对照组以等量去离子水代替样品。做吸光度随时间变化的曲线回归方程,求出其斜率即为邻苯三酚的自氧化速率和样品组对邻苯三酚的自氧化速率,计算如下。

式中:V样品为样品组对邻苯三酚的自氧化速度;V对照为邻苯三酚的自氧化速率。
1.2.9 二价铁离子的螯合能力
二价铁离子螯合能力采用Wu等[23]的方法测定。配制 0.1、1.0、5.0、10.0 mg/mL 的样品溶液,各取 1 mL加入3.7 mL水,再加入2.0 mmol/L的FeSO4·7H2O溶液0.2 mL,混匀,25℃下水浴60 min。加入5 mmol/L的亚铁嗪溶液0.2 mL,混匀,25℃下水浴10 min,在562 nm处测定吸光度。平行3次,空白不加样品,以等量的去离子水代替,蛋白对二价铁离子的螯合能力计算如下。
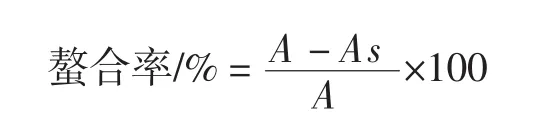
式中:As为样品的吸光度;A为空白的吸光度。
1.2.10 色氨酸的荧光强度
色氨酸荧光强度采用Li等[24]的方法测定。用磷酸盐缓冲液(50 mmol/L,pH7.0)配置浓度为1.5 mg/mL的样品溶液。离心后取上清,用Lowry法准确测定上层液中样品的浓度,然后用磷酸盐缓冲液(50 mmol/L,pH 7.0)稀释为0.1 g/L。在激发波长为280 nm,测定波长为300 nm~450 nm的条件下,用荧光光度计(F4500型)测定色氨酸的荧光强度。
1.2.11 红外光谱
红外光谱测定参照Wu等[25]的方法。取适量样品粉末和一定量的KBr晶体在研钵中研碎,压片,用傅立叶红外光谱仪(Nicolet AVATAR 360 FT-IR)测定红外光谱。
1.2.12 圆二色谱测定
圆二色谱测定参照Wu等[25]的方法,用50 mmol/L pH 7.0的磷酸盐缓冲液配制1 mg/mL的样品溶液,用0.45 μm的滤头过滤,用Lowry法测定样品的准确浓度,调节为0.1 mg/mL。20℃下扫描,扫描的相关参数为波长范围:190 nm~250 nm;谱带宽度:1 nm。
2 结果与分析
2.1 干燥加热磷酸化鸭蛋清蛋白的特性
2.1.1 磷酸化鸭蛋清蛋白中的磷含量
磷含量是干燥加热磷酸化后接在蛋白质上的有机磷含量,即有机磷含量=总磷含量-无机磷含量。磷含量与pH值、干燥加热时间和温度等因素有关,本试验采用Li等[10]的方法成功制备磷酸化鸭蛋清蛋白样品并优化了影响样品磷酸化的条件[16],pH值对磷含量的影响结果见图1。

图1 pH值对磷酸化鸭蛋清蛋白中磷含量的影响Fig.1 Effect of pH on the phosphorus content in duck egg white protein phosphorylated by dry-heating in the presence of pyrophosphate(PP-DEWP)
从图1中可以看出,pH值不同,即使加热时间都是1 d,磷含量也不同,pH值为5.0、85℃干燥加热1 d获得的样品有机磷含量达到1.18%。同时研究了加热天数1 d和3 d,发现随着加热天数增加,磷含量增加,pH值为5.0、85℃干燥加热3 d获得的样品有机磷含量为1.22%。因此磷酸化样品条件确定为:pH值为5.0、85℃干燥加热3 d。Li等[11]采用干燥加热磷酸化法修饰鸡蛋卵白蛋白样品,在pH值为4、85℃干燥加热5d条件下测定有机磷含量为1.01%。研究表明蛋白质中磷的含量能够提高其功能特性,如热稳定性,Kitabatake等[26]报道了当卵白蛋白含有两个磷酸基团,测定磷含量为0.14%,热稳定性比去磷酸化的卵白蛋白更好。
2.1.2 磷酸化鸭蛋清蛋白溶解度测定
本试验采用Lowry等[19]方法测定样品溶解度,结果见表1。

表1 磷酸化鸭蛋清蛋白的特性Table 1 Some characteristics of PP-DEWP
如表1所示,与未经过任何处理的鸭蛋清蛋白(N-DEWP)相比,未加入焦磷酸盐干燥加热的鸭蛋清蛋白(DH-DEWP)溶解度有所下降。但在焦磷酸盐存在条件下干燥加热的鸭蛋清蛋白(PP-DEWP)溶解度达到99.2%,与N-DEWP溶解度相当。表明干燥加热磷酸化改善了鸭蛋清蛋白的溶解性。这些结果与前期报道一致[10-11,17]。研究表明平均疏水性越低,静电荷越多,蛋白质溶解性越高[27]。干燥加热磷酸化使鸭蛋清蛋白溶解度增高可能是由于引入的磷酸基团亲水作用的结果。
2.1.3 磷酸化鸭蛋清蛋白巯基含量测定
表面巯基含量的测定采用Ellman等[20]的方法。如表1所示,N-DEWP、DH-DEWP和PP-DEWP的表面巯基含量分别为0.144、0.156mol/mol和0.164mol/mol。这是因为干燥加热使N-DEWP的结构展开,表面巯基含量增加[28],干燥加热磷酸化后结构展开的更多,表面巯基进一步增加[13]。有研究表明蛋白质的表面巯基增加会使抗氧化性提高[29]。
2.1.4 浑浊度和吸光度值
由表 1可知,N-DEWP(浓度2 mg/mL)在 595 nm处的吸光度值为0.046,此时溶液为澄清透明。DHDEWP的浑浊度略微升高,但PP-DEWP的浑浊度低于N-DEWP和DH-DEWP,表明干燥加热磷酸化能够抑制干燥加热引起的浑浊增加。这很可能是由于PPDEWP中磷酸基团的静电排斥力引起的[13]。从表1可以看出,N-DEWP、DH-DEWP 和 PP-DEWP(浓度1mg/mL)在280 nm处的吸光度值为0.759、0.831和0.820。干燥加热和干燥加热磷酸化后吸光度值略微增加。
2.1.5 热稳定性检测
通过定性和定量分析来检测磷酸化作用对鸭蛋清蛋白热稳定性的影响。将N-DEWP、DH-DEWP和PP-DEWP样品分别置于不同的温度(60℃~100℃,间隔为10℃)下水浴加热10 min,离心后用lowry法测定上清液中可溶性蛋白的含量,结果见图2。
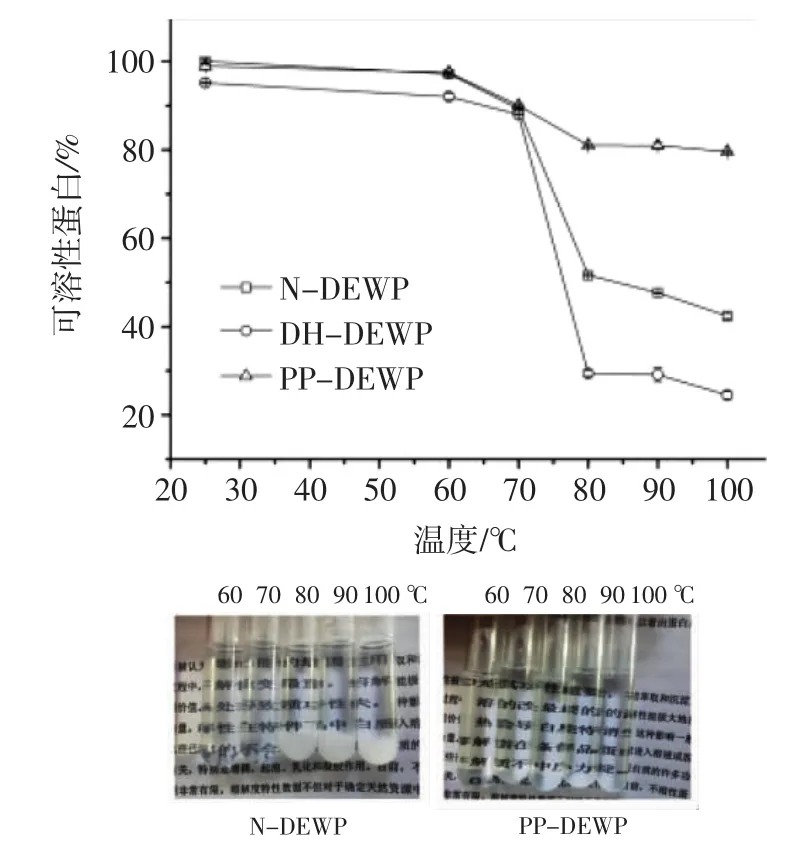
图2 N-DEWP、DH-DEWP和PP-DEWP样品在不同温度下的热稳定性Fig.2 Heat stability of N-DEWP,DH-DEWP andPP-DEWP at various temperatures
如图2所示,当水浴温度达到70℃以后,随着温度升高,N-DEWP、DH-DEWP样品溶解度显著降低。而经过干燥加热磷酸化的样品(PP-DEWP)在70℃的溶解度仍大于90%。如图2的照片所示,当温度达到80℃,N-DEWP、DH-DEWP溶液开始浑浊并沉淀,而PP-DEWP溶液在所有温度下(60℃~100℃)均保持透明(图片文字清晰可见)。表明干燥加热磷酸化作用显著增强了鸭蛋清蛋白的热稳定性,这可能是由于磷酸基团的引入导致蛋白质分子间排斥力增强的结果。这一结果与Li等用鸡蛋清蛋白[11]和卵白蛋白[12]研究的结果一致。
2.2 磷酸化对鸭蛋清蛋白结构的影响
2.2.1 色氨酸的荧光强度
为检测干燥加热磷酸化对鸭蛋清蛋白三级结构的影响,测定N-DEWP、DH-DEWP和PP-DEWP的色氨酸荧光强度,结果见图3。
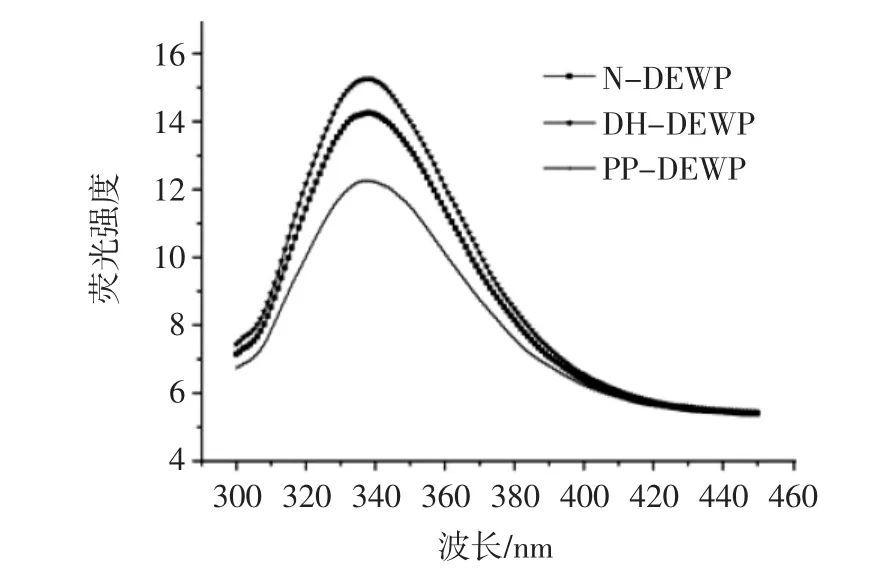
图3 N-DEWP、DH-DEWP和PP-DEWP的色氨酸荧光光谱Fig.3 Tryptophan(Trp)flfluorescence spectra of N-DEWP,DH-DEWP and PP-DEWP
如图3所示,经过干燥加热磷酸化之后,鸭蛋清蛋白的色氨酸荧光强度有所降低。这些结果暗示了干燥加热磷酸化导致鸭蛋清蛋白构象发生变化,使更多的色氨酸残基暴露到溶剂中。与Enomoto等[30]报道的干燥加热对蛋白质三级结构影响不太明显这一结果一致。
2.2.2 圆二色谱(circular dichroism,CD)测定
蛋白质α-螺旋结构在192 nm附近有一正峰,在208 nm和222 nm处有两个特征性的肩峰,因此可以利用CD图谱判断蛋白质的二级结构,结果见图4。
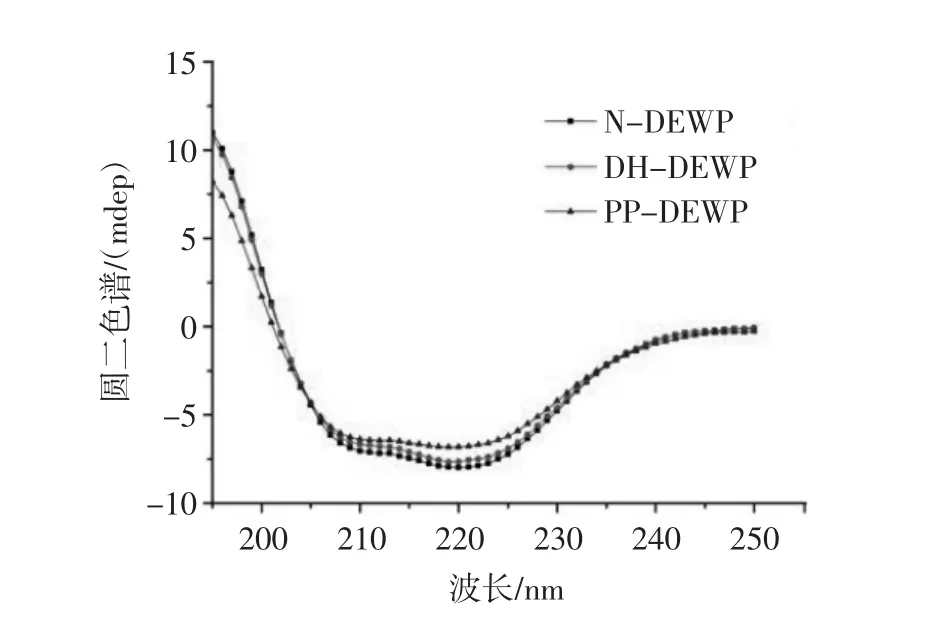
图4 干燥加热磷酸化修饰对N-DEWP、DH-DEWP和PP-DEWP二级结构的影响Fig.4 Effect of phosphorylation on the secondary structure of N-DEWP,DH-DEWP and PP-DEWP
如图4所示,与N-DEWP相比,经过干燥加热和磷酸化后,DH-DEWP和PP-DEWP在222 nm处的特征值略微升高,但蛋白总体结构并未发生较大变化。表明干燥加热磷酸化修饰对鸭蛋清蛋白二级结构影响不大[13]。
2.2.3 红外光谱
通过红外光谱测定了N-DEWP、DH-DEWP和PPDEWP,结果见图5。

图5 N-DEWP、DH-DEWP和PP-DEWP的红外光谱Fig.5 FTIR spectra of N-DEWP,DH-DEWP and PP-DEWP
蛋白质的酰胺Ⅰ带和酰胺Ⅱ带都对蛋白质的二级结构有影响,酰胺Ⅰ带在1 600 cm-1~1 700 cm-1处有吸收(主要是C=O),酰胺Ⅱ带在1 540 cm-1处有吸收(主要是C-N键和N-H键)[31]。如图5所示,当干燥加热磷酸化后,鸭蛋清蛋白的酰胺Ⅰ带的峰值从1 647 cm-1迁移到1 641 cm-1,酰胺Ⅱ带峰值从1 531 cm-1迁移到1 535 cm-1,表明干燥加热磷酸化修饰使鸭蛋清蛋白的二级结构受到一定影响。
2.3 磷酸化对鸭蛋清蛋白抗氧化活性的影响
2.3.1 ABTS+自由基清除能力
样品中含有的抗氧化成分会与ABTS反应使反应体系褪色,通过测定ABTS+自由基在最大吸收波长(734 nm)处的吸光度来进行定量分析[32],结果见图6。

图6 N-DEWP、DH-DEWP和PP-DEWP对ABTS+自由基的清除能力Fig.6 ABTS+free radical scavenging effects of N-DEWP,DH-DEWP,and PP-DEWP
如图6所示,随着蛋白浓度(0.5 mg/mL~10 mg/mL)的增加,N-DEWP、DH-DEWP和PP-DEWP对ABTS+自由基的清除能力逐渐增大。在相同浓度下,N-DEWP和DH-DEWP对ABTS+自由基的清除能力均低于PP-DEWP。在10 mg/mL蛋白浓度时,PP-DEWP对ABTS+自由基的清除能力提高到了77.78%。表明干燥加热磷酸化显著提高了鸭蛋清蛋白对ABTS+自由基的清除能力。结果与之前的报道一致[17]。
2.3.2 超氧阴离子自由基的清除能力
N-DEWP、DH-DEWP和PP-DEWP的超氧阴离子自由基清除能力如图7所示。
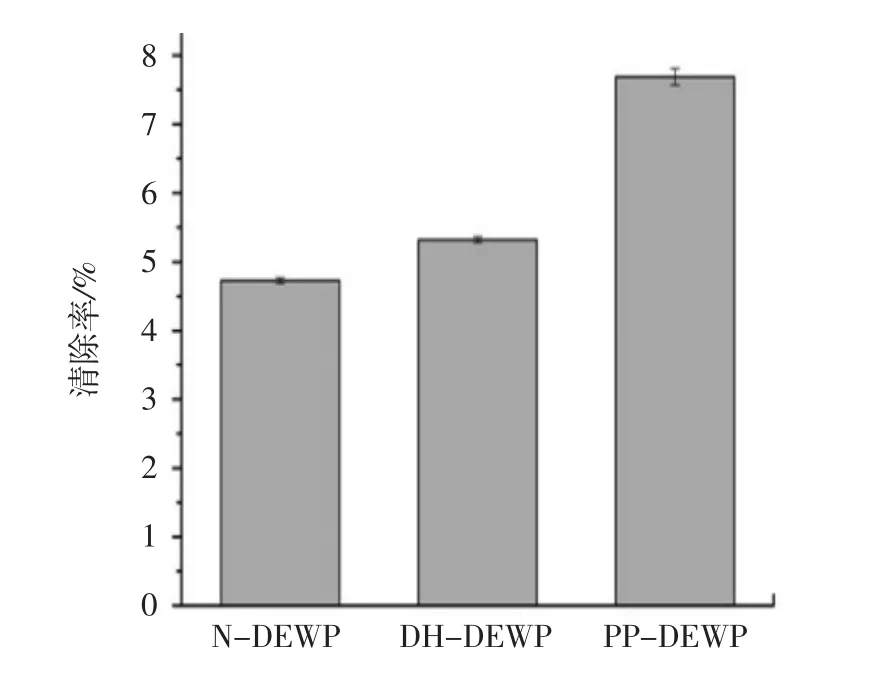
图7 N-DEWP、DH-DEWP和PP-DEWP对超氧阴离子的清除能力Fig.7 Superoxide anion scavenging activity of N-DEWP,DHDEWP,and PP-DEWP
PP-DEWP的超氧阴离子自由基清除能力(7.69%)高于N-DEWP(4.73%)和DH-DEWP(5.32%)。表明干燥加热能够提高鸭蛋清蛋白的超氧阴离子清除能力,干燥加热磷酸化能够进一步提高鸭蛋清蛋白的超氧阴离子清除能力。
2.3.3 二价铁离子的螯合能力
某些蛋白质螯合剂可以通过改变过渡金属的物理位置形成不溶性金属配合物,降低过渡金属的化学反应活性[33]。对N-DEWP、DH-DEWP和PP-DEWP的二价铁离子螯合能力测定结果如图8所示。
随着蛋白浓度(0.1 mg/mL~10 mg/mL)的增加,N-DEWP、DH-DEWP和PP-DEWP对二价铁离子的螯合能力逐渐增大。PP-DEWP的二价铁离子螯合能力比DH-DEWP显著提高,表明磷酸基团的引入能增加鸭蛋清蛋白对二价铁离子的螯合能力。众所周知,EDTA是很好的螯合剂,被广泛用于食品中。在本试验中,当PP-DEWP的浓度大于1 mg/mL时,螯合能力与EDTA基本相等。PP-DEWP的螯合能力表明它是一种很好的抗氧化剂,有望在食品中应用。
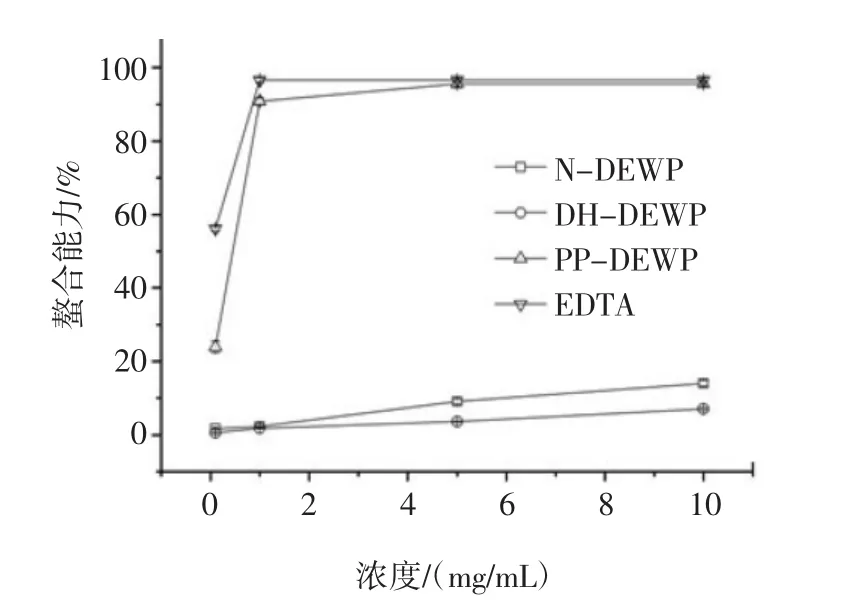
图8 N-DEWP、DH-DEWP和PP-DEWP对二价铁离子的螯合能力Fig.8 Chelating capacity of N-DEWP,DH-DEWP,and PP-DEWP
3 讨论与结论
鸭蛋清蛋白经过干燥加热磷酸化修饰后抗氧化性显著提高的原因可能包括如下两个方面。第一,干燥加热磷酸化修饰作用引入带负电荷的磷酸基团使鸭蛋清蛋白的静电相互作用增强。第二,干燥加热磷酸化修饰作用增加了鸭蛋清蛋白的表面巯基含量。研究表明表面巯基含量的增加能够提高蛋白质的总体抗氧化性[29,34],Žilic′等[35]也以玉米蛋白为样品确定了表面巯基的含量和抗氧化性存在正相关。因此,可以肯定本研究中鸭蛋清蛋白抗氧化性的增强是因为干燥加热磷酸化增加了鸭蛋清蛋白的表面巯基含量。
本文采用干燥加热磷酸化法修饰鸭蛋清蛋白,得到干燥加热磷酸化鸭蛋清蛋白(PP-DEWP)样品,通过综合评价干燥加热磷酸化前后鸭蛋清蛋白的抗氧化性,得出结论干燥加热使鸭蛋清蛋白的抗氧化性有所提高,干燥加热磷酸化修饰后其抗氧化性显著提高,尤其是螯合能力与EDTA基本相等。通过磷酸化修饰,鸭蛋清蛋白二级结构轻度改变,但表面巯基含量增加且蛋白质的溶解性、浑浊度和吸光度基本未受影响。可以肯定磷酸化修饰之后抗氧化性提高是由于磷酸亲水基团的引入和表面巯基含量的增加。以上结论表明PP-DEWP是很好的抗氧化剂,有望用于食品加工行业中的添加剂。
