CGRP、AchE在功能性排便障碍大鼠模型中的表达
2020-12-18李雪耿学斯程一乘刘薇刘立阳刘仍海
李雪,耿学斯,程一乘,刘薇,刘立阳,刘仍海△
功能性排便障碍(FDD)是慢性便秘中最常见的类型,表现为直肠推进力不足和(或)排出阻力增加,在慢性便秘中占25%~74%[1]。由于FDD 常反复发作,严重影响患者的生活质量,目前FDD 的病因和发病机制尚不明确。研究显示,FDD 患者具有较高的焦虑抑郁倾向,而发生负性生活事件、精神刺激及应对障碍时,脑-肠轴可异常分泌脑肠肽,参与FDD的形成[2-3]。脑肠肽是脑-肠轴各通路作用的物质基础及重要作用靶点,在外周及中枢广泛地参与胃肠道生理活动和各种功能的调节。其中降钙素基因相关肽(CGRP)及乙酰胆碱酯酶(AchE)作为脑肠肽能释放神经传递介质或调节介质,调节胃肠功能,也可以直接作用于胃肠道感觉神经末梢或平滑肌细胞的相应受体而调节肠道的感觉和运动,同时亦参与中枢神经系统调节胃肠道功能[4-5]。然而,CGRP、AchE在FDD 中的作用尚不明确。本课题组前期研究发现,采用低纤维饮食联合亚甲蓝肛周注射法能够改变大鼠的粪便性状及排便功能,模拟FDD的病理状态。本研究采用此造模方法,观察FDD模型大鼠结、直肠中CGRP、AchE的表达,探讨两者在FDD中的作用及FDD发生的可能机制。
1 材料与方法
1.1 实验动物 SD 雄性大鼠24 只,SPF 级,8 周龄,体质量180~200 g,购自北京维通利华实验动物技术有限公司,动物许可证编号:SCXK(京)2016-0006,饲养于SPF级动物房,温度22~25 ℃,湿度50%~70%,昼夜光照恒定12 h/12 h。动物实验处理均严格遵循动物保护原则及北京中医药大学实验动物伦理委员会的要求。
1.2 实验试剂与仪器 亚甲蓝注射液(济川药业集团),2%利多卡因注射液(哈药集团三精制药公司)。大鼠AchE酶联免疫吸附试验(ELISA)试剂盒购自Solarbio 公司,Trizol 总RNA提取试剂盒(天根生化科技有限公司),PrimeScriptTMRT reagent Kit with gDNA Eraser、SYBR Premix Ex TaqTMⅡ(Tli RNaseH Plus)ROX plus、DL2000 DNA Marker 均购自MDL 公司,CGRP 兔多克隆抗体(北京博奥森生物技术有限公司),DAB 试剂盒(北京中杉金桥生物技术有限公司),UltraPure Agarose、SuperScript ⅢRT 逆转录试剂盒均购自ABIinvitrogen公司。
EG1150型石蜡包埋仪、RM2235型石蜡切片机、DM3000型正置荧光显微镜、G1150H 型均为德国Leica 公司产品;ABI7500 型实时荧光定量PCR 仪(美国Applied Biosystems 公司);Tanon1600型凝胶成像系统V.1.100(上海天能科技有限公司);loveq-va5型直肠压力测试计(韩国OMOMED公司)。
1.3 动物模型的制备、分组及给药 24只SD大鼠适应性饲养3 d 后,采用随机数字表法分为空白对照组、低纤维饮食组、利多卡因组、模型组,每组6只。各组均自由饮水,空白对照组采用普通饲料饲养;低纤维饮食组、利多卡因组、模型组采用低纤维饲料饲养,并于饲养第63天,分别予以利多卡因组2 mL 2%利多卡因注射液、模型组2 mL 0.1%亚甲蓝注射液(由2%利多卡因溶液配制)肛周及直肠周围间隙注射1次。低纤维饮食配方为:41.5%玉米淀粉,24.5%牛奶酪蛋白,10.0%蔗糖,10.0%糊精,7.0%矿物混合物,6.0%玉米油和1%纤维素混合物[科澳协力饲料有限公司,许可证号SCXK(京)2014-0010]。实验第77天取材,各组大鼠取结肠、直肠组织,一部分固定于10%福尔马林溶液中用于制备石蜡切片,另一部分置于-80 ℃冰箱中待用。
1.4 检测指标及方法
1.4.1 一般行为表现及排便情况 每日观察各组大鼠精神状态、活动情况、进食量、饮水量、毛发光泽程度等情况。观察大鼠粪便性状,记录大鼠24 h粪便总质量。
1.4.2 排便功能检测 采用模拟球囊排出法和肛管直肠压力测定法检测。分别于实验第0、62、76天时进行测定,需辅助大鼠排尽直肠内粪便,并将大鼠固定。选取直径4~5 mm干黄豆,经石蜡油润滑后将干黄豆置入直肠内2 cm 处,记录黄豆排出时间。肛管内置入无菌导尿管(规格:8Fr)并与直肠压力测试仪连接,测量大鼠肛管直肠静息压。
1.4.3 大鼠结、直肠组织中AchE 的含量 采用ELISA 法检测。各组取6只大鼠,取组织匀浆,严格按照试剂盒说明书步骤进行测定。
1.4.4 大鼠结、直肠组织中CGRPmRNA 的表达情况 采用实时荧光定量PCR(qPCR)法检测。从-80 ℃冰箱中取出大鼠结、直肠组织样本,每组6 只,加入液氮后研磨粉碎,加入Triozol 提取组织中的总RNA。cDNA 反转录,实验操作按产品说明书进行。于qPCR 仪上进行PCR 反应,反应条件:95 ℃预变性5 min;95 ℃变性10 s,58 ℃退火20 s,72 ℃延伸20 s,40个循环。引物由北京Invitrogen公司合成,引物序列见表1。每个样本设3个复孔。采用2-ΔΔCt法进行相对定量分析。

Tab.1 Primer sequence of qPCR表1 qPCR引物序列
1.4.5 免疫组化法检测大鼠结、直肠组织中CGRP 蛋白的表达 石蜡切片经脱蜡、水化后,水浴加热抗原修复15 min,CGRP 兔抗鼠多克隆抗体(1∶1 000)4 ℃孵育过夜,羊多克隆二抗(1∶500)37 ℃孵育30 min,辣根酶标记链霉卵白素工作液室温孵育30 min,DAB 显色剂显色,苏木素复染,脱水,透明,中性树胶封片。采用IPP 6.0图像分析软件,以积分光密度(IOD)对CGRP蛋白表达进行半定量分析[6]。
1.4.6 Western blot 法检测大鼠结、直肠组织中CGRP蛋白的表达 各组选取3只大鼠,取大鼠结、直肠组织,加入裂解液冰上研磨制备匀浆,取上清液BCA法进行蛋白定量。各组取20 μg/孔样品蛋白,进行SDS-聚丙烯酰胺凝胶电泳(80 V,100 min)分离后,湿转法转移到PVDF膜上,封闭液室温摇床摇2 h。加入特异性识别抗体(1∶1 000),4 ℃封闭过夜。TBS震荡洗膜后,加入二抗(1∶10 000),室温避光孵育1 h,洗膜后加ECL发光液反应3~5 min,调整胶片曝光时间(5 min),加入显影液、定影液,清水浸泡后晾干。采用凝胶成像仪采集图像并进行分析。以β-actin蛋白作为内参。实验重复3次。
1.5 统计学方法 采用SPSS 21.0 软件进行统计描述与分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验;不同时间点比较采用重复测量设计的方差分析;2组间比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般行为表现及排便情况 空白对照组大鼠饮水、进食情况良好,毛发光泽,精神状态佳,未见精神萎靡或躁动,排便及排尿情况可,无死亡,活动无异常;与空白对照组比较,其余各组大鼠进食量减少,毛发光泽度差,脱毛情况严重,精神状态较差,活动量减少;其中,利多卡因组和模型组较低纤维饮食组大鼠毛发更为稀疏,且偶有躁动。
实验开始前,各组大鼠粪便成型,呈褐色,各组大鼠粪便质量差异无统计学意义;实验第62 天,空白对照组大鼠粪便质量升高,低纤维饮食组、利多卡因组及模型组降低(均P<0.05)。肛周注射后(实验第76 天),与空白对照组比较,低纤维饮食组、利多卡因组及模型组大鼠粪便出现不同程度的变干变硬,其中低纤维饮食组和利多卡因组粪便呈深褐色,模型组粪便呈黑褐色,粪便质量均明显降低(P<0.05);与低纤维饮食组比较,利多卡因组粪便性状变化不大,模型组大鼠粪便更为干硬,体积小,但粪便质量差异均无统计学意义,见表2。
2.2 各组大鼠排便功能变化情况
2.2.1 各组大鼠模拟球囊排出情况 肛周注射前(实验第0天、第62天),各组大鼠模拟球囊排出时间差异均无统计学意义;肛周注射后(实验第76 天),空白对照组和低纤维饮食组大鼠模拟球囊排出时间仍无明显变化(P>0.05);利多卡因组和模型组大鼠模拟球囊排出时间增长(P<0.05),且模型组大鼠模拟球囊排出时间均长于其他3组(P<0.05),见表3。
Tab.2 Comparison of stool weight of rats between four groups表2 4组大鼠粪便质量的比较(n=6,g,±s)
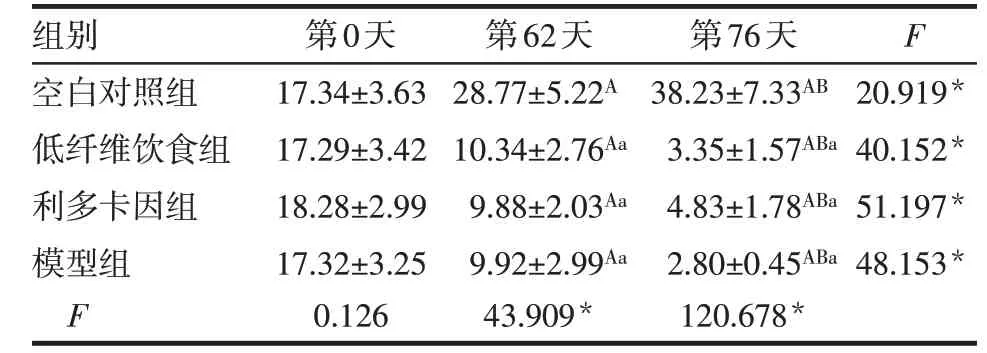
Tab.2 Comparison of stool weight of rats between four groups表2 4组大鼠粪便质量的比较(n=6,g,±s)
*P<0.05;F组间=52.332*,F时间=153.139*,F交互=9.362*;组内比较:A与第0天比较,B与第62天比较,P<0.05;组间比较:a与空白对照组比较,P<0.05
组别空白对照组低纤维饮食组利多卡因组模型组F第0天17.34±3.63 17.29±3.42 18.28±2.99 17.32±3.25 0.126第62天28.77±5.22A 10.34±2.76Aa 9.88±2.03Aa 9.92±2.99Aa 43.909*第76天38.23±7.33AB 3.35±1.57ABa 4.83±1.78ABa 2.80±0.45ABa 120.678*F 20.919*40.152*51.197*48.153*
Tab.3 Comparison of simulated balloon expulsion times between four groups of rats表3 4组大鼠模拟球囊排出时间的比较(n=6,s,±s)

Tab.3 Comparison of simulated balloon expulsion times between four groups of rats表3 4组大鼠模拟球囊排出时间的比较(n=6,s,±s)
*P<0.05;F组间=34.916*,F时间=13.327*,F交互=9.743*;组内比较:A与第0天比较,B与第62天比较,P<0.05;组间比较:a与空白对照组比较,b与低纤维饮食组比较,c与利多卡因组比较,P<0.05
组别空白对照组低纤维饮食组利多卡因组模型组F第0天298.13±28.77 301.34±31.48 297.38±26.69 301.99±29.56 0.037第62天327.00±42.01 321.17±44.30 323.36±39.56 325.67±41.29 0.023第76天331.17±55.77 329.00±54.88 426.36±76.20AB 579.39±85.12ABabc 17.343*F 1.022 0.613 10.361*43.328*
2.2.2 各组大鼠肛管直肠静息压情况 肛周注射前(实验第0天、第62天),各组大鼠肛管静息压差异无统计学意义;肛周注射后(实验第76 天),空白对照组和低纤维饮食组大鼠肛管静息压仍无明显变化(P>0.05);利多卡因组和模型组大鼠肛管静息压降低(P<0.05)。肛周注射后利多卡因组和模型组大鼠肛管静息压均低于空白对照组和低纤维饮食组,模型组大鼠肛管静息压低于利多卡因组(P<0.05),见表4。
Tab.4 Comparison of the resting pressure of anorectal canal between four groups of rats表4 4组大鼠肛管直肠静息压情况的比较(cmH2O,±s)

Tab.4 Comparison of the resting pressure of anorectal canal between four groups of rats表4 4组大鼠肛管直肠静息压情况的比较(cmH2O,±s)
*P<0.05;F组间=32.364*,F时间=17.413*,F交互=11.899*;组内比较:A与第0天比较,B与第62天比较,P<0.05;组间比较:a与空白对照组比较,b与低纤维饮食组比较,c与利多卡因组比较,P<0.05;1 cmH2O=0.098 kPa
组别空白对照组低纤维饮食组利多卡因组模型组F n 6 6 6 6第0天5.49±0.35 5.57±0.37 5.36±0.28 5.57±0.33 0.528第62天5.36±0.42 5.42±0.20 5.42±0.23 5.45±0.38 0.083第76天5.37±0.25 5.44±0.30 4.48±0.18ABab 3.14±0.22ABabc 118.106*F 0.261 0.447 30.451*111.920*
2.3 各组大鼠结、直肠组织中AchE 含量情况 结肠组织中,模型组AchE含量低于空白对照组和低纤维饮食组(P<0.05),与利多卡因组差异无统计学意义。直肠组织中,利多卡因组AchE含量低于空白对照组(P<0.05),与低纤维饮食组差异无统计学意义;模型组AchE 含量低于空白对照组、低纤维饮食组和利多卡因组(P<0.05);各组大鼠直肠组织中AchE含量均明显低于结肠组织(P<0.05)。见表5。
Tab.5 Comparison of AchE contents in the colon and rectum tissues of rats between four groups表5 4组大鼠结、直肠组织中AchE含量的比较(ng/L,±s)

Tab.5 Comparison of AchE contents in the colon and rectum tissues of rats between four groups表5 4组大鼠结、直肠组织中AchE含量的比较(ng/L,±s)
*P<0.05;a与空白对照组比较,b与低纤维饮食组比较,c与利多卡因组比较,P<0.05;表6、7同
组别空白对照组低纤维饮食组利多卡因组模型组F n 6 6 6 6结肠7.04±0.39 7.19±1.62 5.91±0.76 4.04±0.58ab 13.742*直肠5.64±0.37 4.96±0.39 4.57±0.27a 2.73±0.52abc 58.789*t 6.379*3.278*4.070*4.119*
2.4 各组大鼠结、直肠组织中CGRPmRNA 的表达情况 结肠组织中,低纤维饮食组、利多卡因组及模型组CGRPmRNA 表达量均高于空白对照组(P<0.05),3组间差异无统计学意义;直肠组织中,空白对照组、低纤维饮食组、利多卡因组及模型组CGRPmRNA表达量依次升高,组间多重比较差异均有统计学意义。除利多卡因组直肠组织CGRPmRNA 表达量低于结肠组织外,其余各组结、直肠组织中CGRPmRNA表达量差异均无统计学意义,见图1、2,表6。

图1 4组大鼠结肠组织中CGRP电泳图

图2 4组大鼠直肠组织中CGRP电泳图
2.5 CGRP 在各组大鼠结、直肠组织中的表达情况 CGRP 免疫阳性神经纤维呈棕黄色,聚集或分散于结肠及直肠黏膜腺体之间。结肠组织中,模型组CGRP 表达水平高于空白对照组、低纤维饮食组和利多卡因组(P<0.05),空白对照组、低纤维饮食组和利多卡因组间差异无统计学意义;直肠组织中,利多卡因组和模型组CGRP表达水平均高于空白对照组和低纤维饮食组,模型组高于利多卡因组(P<0.05);低纤维饮食组与空白对照组间差异无统计学意义。空白对照组、低纤维饮食组、利多卡因组直肠组织中CGRP表达水平均高于结肠组织,模型组结、直肠组织中CGRP 表达水平差异无统计学意义,见图3、表7。
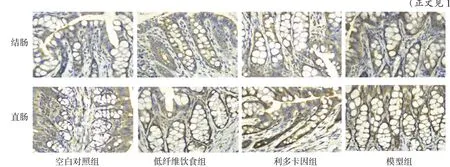
Fig.3 CGRP expression levels in the colorectal and rectal tissues of rats in each group(IHC,×400)图3 CGRP在各组大鼠结、直肠组织中表达情况(IHC,×400)
Tab.6 Comparison of CGRP mRNA expression levels in the colorectal and rectal tissues between four groups of rats表6 4组大鼠结、直肠组织中CGRP mRNA表达量的比较(±s)

Tab.6 Comparison of CGRP mRNA expression levels in the colorectal and rectal tissues between four groups of rats表6 4组大鼠结、直肠组织中CGRP mRNA表达量的比较(±s)
组别空白对照组低纤维饮食组利多卡因组模型组F n3 3 3 3结肠1.02±0.04 7.28±3.43a 7.19±0.06a 8.45±0.05a 11.564*直肠1.05±0.05 2.32±0.27a 5.17±0.13ab 8.30±0.08abc 1 264.738*t 0.812 2.497 24.436*2.754
Tab.7 Comparison of CGRP integrated optical density values in the colorectal and rectal tissues between four groups of rats表7 4组大鼠结、直肠组织中CGRP表达水平的比较(IOD,±s)
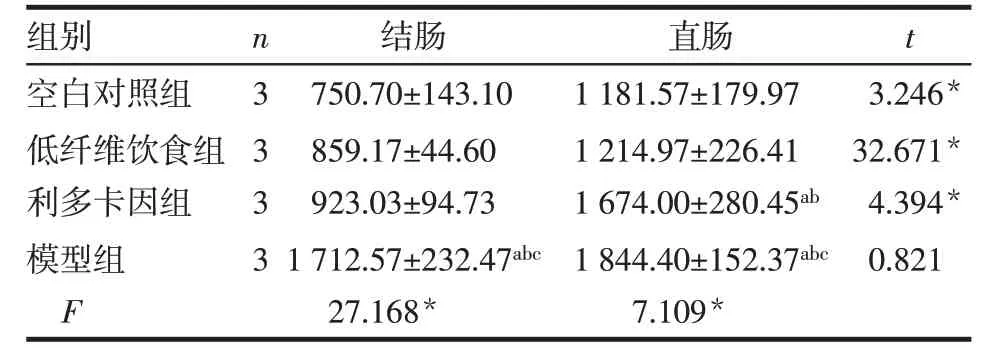
Tab.7 Comparison of CGRP integrated optical density values in the colorectal and rectal tissues between four groups of rats表7 4组大鼠结、直肠组织中CGRP表达水平的比较(IOD,±s)
组别空白对照组低纤维饮食组利多卡因组模型组F n 3 3 3 3结肠750.70±143.10 859.17±44.60 923.03±94.73 1 712.57±232.47abc 27.168*直肠1 181.57±179.97 1 214.97±226.41 1 674.00±280.45ab 1 844.40±152.37abc 7.109*t 3.246*32.671*4.394*0.821
2.6 CGRP 蛋白在各组大鼠结、直肠组织中的表达情况 各组结、直肠组织中CGRP 蛋白表达差异均无统计学意义,见图4、5,表8。

Fig.4 The expression of CGRP protein in the colon tissue of rats in four group图4 4组大鼠结肠组织中CGRP蛋白的表达情况

Fig.5 The expression of CGRP protein in rectal tissue ofrats in four group图5 4组大鼠直肠组织中CGRP蛋白的表达情况
Tab.8 Relative expression levels of CGRP protein in colon and rectum tissues of rats in four group表8 4组大鼠结、直肠中CGRP蛋白的相对表达量(±s)

Tab.8 Relative expression levels of CGRP protein in colon and rectum tissues of rats in four group表8 4组大鼠结、直肠中CGRP蛋白的相对表达量(±s)
均P>0.05
组别空白对照组低纤维饮食组利多卡因组模型组F n3 3 3 3结肠0.28±0.12 0.31±0.21 0.30±0.23 0.47±0.14 0.702直肠0.16±0.05 0.16±0.12 0.23±0.11 0.46±0.30 2.039 t 1.599 1.074 0.476 0.052
3 讨论
FDD是一类以长期的排便困难、排便不畅、排便次数减少、粪便干结及量少等功能型便秘为主要临床表现,伴盆底肌不松弛甚至反常收缩、直肠推力不足的功能性疾病。目前,国际上没有公认的FDD 模型,关于动物模型的研究大多着眼于功能性便秘的模型,包括慢传输型、出口梗阻型、泻剂型等。国内有研究通过使用直肠缩窄法构建出口梗阻型便秘模型,但是出口梗阻型便秘并不能完全解释FDD[7-8]。本课题组采用低纤维饮食联合肛门局部注射亚甲蓝法建立FDD 大鼠模型,结果显示,低纤维饮食组和利多卡因组大鼠尽管排便功能与空白对照组均无明显差异,但是粪便干结、变细,颜色变深,粪便质量明显低于空白对照组,符合功能性便秘的临床特点,而模型组除出现了粪便质量降低,颜色变深,粪便变硬等功能性便秘的特点外,同时还出现了排便功能的异常,更符合FDD 中排便推动力不足的临床特点[9-10]。FDD 的发病机制尚不清楚,目前普遍认为脑-肠轴调节机制是其主要的神经机制。脑-肠轴的紊乱是产生复杂胃肠道状态的关键因素,研究提示FDD 以肠道动力异常和内脏感觉异常为主要表现,而这些表现与脑-肠轴中脑肠肽的异常表达有关[11]。
CGRP 作为一种内源性神经肽,广泛分布于中枢和外周神经系统,在肠神经系统内,其主要分布于黏膜下丛的初级传入神经细胞内,传递肠腔或肠壁的各种物理性和化学性刺激信号,参与调节胃肠道的功能活动。一方面,CGRP 对肌肉的松弛作用较收缩作用强10 倍,CGRP 能抑制结肠纵行肌、环行肌、直肠纵行肌和肛门内括约肌的收缩,同时外周应用CGRP可以抑制结肠运动,使结肠转运时间延长,排便次数减少[12]。在本研究中,FDD 大鼠结肠中CGRPmRNA表达量较空白对照组升高;免疫组化结果显示CGRP 蛋白表达水平较其余组升高,但蛋白免疫印迹结果显示各组CGRP蛋白表达水平无明显差异,2 种检测方法的结果差异可能与样本量较小有关,本研究免疫组化结果与以往研究中慢性便秘患者结肠组织CGRP的表达基本一致[12];同时,本研究在大鼠直肠组织中亦发现了类似结果,提示CGRP 表达上调对结肠及直肠的运动具有一定的抑制作用,导致大鼠产生了一系列功能性便秘的症状[13]。另一方面,CGRP 也是促炎症性感觉性神经肽,在肠道感觉神经的逆向性释放下可引起神经源性炎症。本研究结果显示,FDD 大鼠结肠及直肠组织中CGRP mRNA 及蛋白(免疫组化法)表达水平较空白对照组升高,提示FDD 大鼠结肠及直肠中可能存在低炎症表现。由于CGRP通过伤害性信息的传导来传递肠腔或肠壁的各种物理性和化学性刺激信号,同时在痛觉的产生与传递过程中使炎性介质的释放增加或加强致疼痛效应,以增加内脏的痛觉,笔者认为这种低炎症表现也可能是导致FDD 肠道动力异常和腹痛的原因[14-15]。此外,与低纤维饮食组比较,模型组大鼠结肠组织中CGRPmRNA 无明显变化,而直肠组织中其表达水平明显升高,提示FDD大鼠直肠中的CGRP对肠道功能的调节作用及促炎症作用,可能与正常大鼠及低纤维饮食诱导的功能性便秘大鼠均存在差异。
CGRP 作为调控胃肠道功能的重要神经递质,其对胃肠道运动的抑制作用可能与减少肠神经系统中胆碱能神经传递有关[5]。乙酰胆碱(acetylcholine,Ach)是肠壁内最经典的胃肠动力兴奋性神经递质,目前普遍认为其对肠道运动起着主要调节作用[16]。AchE是Ach的水解酶,既可以作为胆碱能神经元的标志物,也能够用于研究生理或病理状态下胃肠运动的变化[17]。AchE作用于平滑肌M受体,可开放质膜上L型Ca2+通道使Ca2+内流而加强肠肌收缩,在胃肠蠕动中发挥启动性作用,也可以通过调节释放其他兴奋性递质,进而调节肠神经系统的紊乱[18]。有研究表明,慢性便秘结肠Ach的释放明显降低,通过对胆碱能的调节可明显改善便秘的症状[19]。本研究结果显示,FDD大鼠结肠组织中AchE含量低于空白对照组和低纤维饮食组,直肠组织中AchE含量低于空白对照组、低纤维饮食组和利多卡因组;各组大鼠直肠组织中AchE 含量均明显低于结肠组织,提示FDD 大鼠结、直肠组织中CGRP 的表达异常可导致AchE 活性降低,且其对直肠组织中AchE 活性的抑制作用更为显著。
综上所述,在FDD 大鼠模型中,大鼠粪便干结、排便功能下降,结、直肠CGRP mRNA 及蛋白表达水平均升高,AchE 含量降低,CGRP 与AchE 的异常分泌可能与FDD发病的神经机制有关。
