益肾通络方调控PI3K/Akt通路对环磷酰胺诱导无精/少精症大鼠模型的保护作用研究
2020-12-18李勋陈建设门波李晖陈翔张辉郝高利樊立鹏张幸华董亚洲
李勋,陈建设△,门波,李晖,陈翔,张辉,郝高利,樊立鹏,张幸华,董亚洲
无精/少精症又叫男性生精功能障碍症,指男性睾丸发育不良,生精细胞萎缩、退化,不能生成精子,或由于输精管阻塞或附睾体炎症等多种原因引起生精细胞分裂停滞、成熟精子不能产生和排出,从而导致男性生殖功能障碍和不育性疾病[1-2]。据流行病学分析,近年来男性生殖功能障碍和不育症发生率逐渐升高,严重影响患者生活质量和家庭和谐[3-4]。中医药在治疗男性不育及生精障碍方面具有独特优势和较好疗效[5-6]。益肾通络方(YTF)为名医验方,功效为健脾益肾、化瘀通络,主治膜性肾病、肾络瘀阻症。近期研究发现,YTF 可治疗精索静脉曲张性不育,对大鼠睾丸生精功能有保护作用[7]。YTF 对无精/少精症是否具有治疗作用尚少见相关研究。磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(Akt)信号通路参与睾丸生长发育和精子生成过程[8]。本研究通过环磷酰胺(CP)诱导建立大鼠无精/少精症模型,并用PI3K/Akt 通路抑制剂(LY294002)阻断PI3K/Akt 蛋白表达,探讨YTF 对无精/少精症模型大鼠的治疗作用及对PI3K/Akt 通路的调控作用,为探索YTF新的药理作用提供实验基础。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级健康雄性SD 大鼠62 只,体质量200~220 g,购自河南省实验动物中心,生产许可号为SCXK(豫)2017-0001。所有大鼠于本院动物房中饲养,使用许可证号为SCXK(豫)2017-0001。饲养条件:自然光照,自由饮食、饮水,温度25 ℃,相对湿度50%,噪音低于80 dB,保持动物房环境及鼠笼清洁、透气。本研究经本院动物伦理委员会批准同意,实验符合3R(减少、替代、优化)原则。
1.1.2 主要试剂及仪器 CP(货号:6055-19-2;规格:1 g/瓶)购自北京百奥莱博科技有限公司;BCA蛋白定量试剂盒和胰蛋白酶(货号分别为P0768、P0231)均购自美国Pierce 公司;LY294002(规格:5 mg;批号039K4625)购自美国Sigma公司;苏木精-伊红(HE)染色试剂盒(货号:LMO105)购自上海联迈生物工程有限公司;性激素睾酮(sex hormone testosterone,T)酶联免疫吸附试验(ELISA)试剂盒(货号:YE02503)购自上海远慕生物科技有限公司;卵泡刺激素(FSH)ELISA 试剂盒(货号:ER0960)购自武汉菲恩生物科技有限公司;PI3K抗体(货号:ab39307)、Akt 抗体(货号:ab8805)、磷酸化Akt(p-Akt)抗体(货号:ab38449)、雷帕霉素靶分子(mTOR)抗体(货号:ab2732)、成纤维细胞生长因子(bFGF)抗体(ab208687)、早幼粒细胞白血病锌指(PLZF)抗体(货号:ab39354)、跨膜酪氨酸激酶受体(C-kit)抗体(货号:ab256345)等均购自美国Abcam 公司;蛋白电泳仪、半干转膜仪(型号1659001、Trans-Blot SD)购自美国Bio-Rad公司。
1.2 方法
1.2.1 大鼠无精/少精症模型建立及分组 参照文献[9]构建无精/少精症模型,具体操作方法为:取52只大鼠禁食禁水12 h 后,3%戊巴比妥钠麻醉,用生理盐水配置3.5 g/L 的CP溶液,并按35 mg/(kg·d)的剂量经腹腔注射给药,连续5 d后,随机取2只大鼠,取睾丸组织固定、常规透明、浸蜡、包埋、切片(5 μm),行HE染色,置显微镜下观察可见睾丸生精细胞紊乱、数量减少、未见精子细胞,且管腔中无絮状精子形成,表明造模成功。
将建模成功的50只大鼠采用随机数字表法分为模型组(Model 组)、PI3K/Akt 通路抑制剂[10](LY294002)组(LY 组,0.3 mg/kg)、YTF[7]低剂量组(3 g/kg)、高剂量组(12 g/kg)以及YTF(12 g/kg)+LY(0.3 mg/kg)组,每组10只;另外10只大鼠,麻醉后经腹腔注射等量生理盐水,作为空白对照(Control)组。各组均于造模成功后第2天开始给药,LY294002用DMSO溶液配制为0.03 g/L的混悬液,YTF用生理盐水配置为0.30、1.20 g/mL 的混悬液,LY 组灌胃给予生理盐水和注射给予LY294002 混悬液,YTF 低、高剂量组灌胃给予相应剂量YTF溶液并腹腔注射给予DMSO 溶液,YTF+LY 组灌胃给予1.20 g/mL YTF溶液和注射给予0.03 g/L的LY294002溶液;Control组及Model组分别灌胃给予生理盐水和注射给予DMSO溶液,各组均以10 mL/kg的剂量给药,1次/d,连续给药4周。
1.2.2 标本采集与制备 各组大鼠于末次给药12 h后,麻醉后称取大鼠体质量,取腹主动脉血2 mL,3 000 r/min 离心10 min 后,取上清液,按照ELISA 试剂盒说明书方法检测血清T及FSH水平;断头处死大鼠,取双侧睾丸组织,并称取睾丸质量,按公式睾丸指数=大鼠双侧睾丸质量(mg)/大鼠体质量(g)计算睾丸指数;迅速取睾丸0.5 g置于-80 ℃冰箱保存,剩余组织置于波恩(Bouin’s)固定液中固定24 h。
1.2.3 各组大鼠睾丸组织HE染色、生精小管直径(MSTD)检测及Johnsen 评分检测 取1.2.2 中Bouin’s 固定液中固定24 h 的睾丸组织,进行常规透明、浸蜡、包埋、切片(5 μm)。将切片脱蜡、水化后,按HE 试剂盒说明书行常规染色、中性光学树脂封片后,置于显微镜下观察组织形态变化。采用Image-proplus 6.0 图像处理系统测量MSTD。在光镜下选取10 个生精小管,按照Johnsen 10 级评分法[9]评价大鼠生精上皮细胞发育情况。评分标准为:1分,无细胞;2分,仅支持细胞;3 分,仅精原细胞,无生精细胞;4 分,精母细胞为5 个;5分,精母细胞>5个;6分,精子细胞有1~5个;7分,精子细胞>5个,但无分化;8分,存在晚期精子细胞;9分,精子有1~5个;10分,精子>5个。
1.2.4 Western blot 检 测PI3K、p-Akt/Akt、mTOR、bFGF、PLZF、C-kit 蛋白表达 取1.2.2 中-80 ℃保存的睾丸组织,4 ℃条件下解冻后,用组织匀浆器匀浆,3 000 r/min 离心15 min 后,取上清液,用蛋白提取试剂盒提取蛋白并按BCA试剂盒说明书测定蛋白浓度后,取50 μg蛋白进行电泳、转膜反应后,置于5%的脱脂奶粉溶液中室温封闭2 h,TBST清洗后,加入抗体(PI3K、p-Akt、Akt、mTOR、bFGF、PLZF、C-kit,稀释比例为1∶500)、β-actin(内参,稀释比例为1∶2 000),于4 ℃冰箱中孵育过夜、TBST 漂洗3次后,加入1∶1 000的羊抗兔二抗,室温孵育2 h、TBST 再次漂洗3 次后,采用增强化学发光法显色,以凝胶成像仪观察条带并拍照,并以Image-J软件分析各组蛋白相对表达。
1.3 统计学方法 以SPSS 22.0软件对实验数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,组间多重比较行LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠睾丸指数及血清指标T 和FSH 水平 与Control 组比较,除YTF 高剂量组T 水平差异无统计学意义外,其余各组睾丸指数和T水平均降低,FSH水平均升高(P<0.05)。与Model组比较,LY组睾丸指数和T 水平降低,FSH 水平升高;YTF 低、高剂量组睾丸指数和T水平升高,FSH水平降低(P<0.05);YTF+LY 组与Model 组差异无统计学意义。与YTF低剂量组比较,YTF 高剂量组睾丸指数和T 水平升高,FSH 水平降低;YTF+LY 组睾丸指数和T 水平降低,FSH水平升高(P<0.05),见表1。
Tab.1 Comparison of testis index,serum levels of T and FSH between six groups of rats表1 6组大鼠睾丸指数及血清T和FSH比较(n=10,±s)
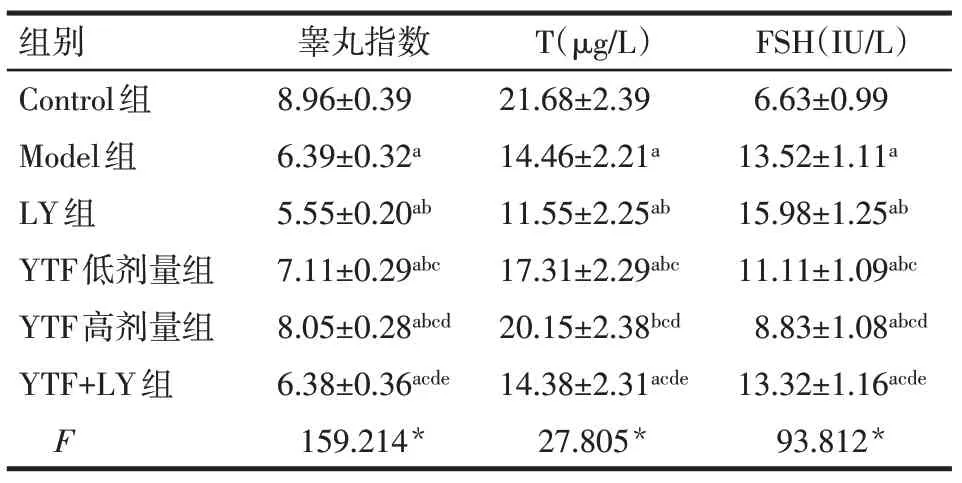
Tab.1 Comparison of testis index,serum levels of T and FSH between six groups of rats表1 6组大鼠睾丸指数及血清T和FSH比较(n=10,±s)
*P<0.05;a与Control 组比较,b与Model 组比较,c与LY 组比较,d与YTF低剂量组比较,e与YTF高剂量组比较,P<0.05;表2~4同
组别Control组Model组LY组YTF低剂量组YTF高剂量组YTF+LY组F睾丸指数8.96±0.39 6.39±0.32a 5.55±0.20ab 7.11±0.29abc 8.05±0.28abcd 6.38±0.36acde 159.214*T(μg/L)21.68±2.39 14.46±2.21a 11.55±2.25ab 17.31±2.29abc 20.15±2.38bcd 14.38±2.31acde 27.805*FSH(IU/L)6.63±0.99 13.52±1.11a 15.98±1.25ab 11.11±1.09abc 8.83±1.08abcd 13.32±1.16acde 93.812*
2.2 大鼠睾丸组织HE染色病理结果 Control组大鼠睾丸组织生精细胞排列整齐,生精小管管腔结构正常;Model组及YTF+LY组大鼠睾丸组织生精小管管腔缩窄,生精细胞紊乱、数量减少或消失;LY组生精小管管腔缩窄、生精细胞排列紊乱及减少等病理现象最为严重;YTF低、高剂量组大鼠睾丸组织生精细胞排列较为整齐,且YTF高剂量组优于低剂量组,见图1。与Control组比较,除YTF高剂量组MSTD差异无统计学意义外,其余各组MSTD 及生精细胞发育评分均降低(P<0.05);与Model 组比较,LY 组MSTD 及生精细胞发育评分降低,YTF 低、高剂量组MSTD及生精细胞发育评分升高(P<0.05),YTF+LY组与Model 组差异无统计学意义;与YTF 低剂量组比较,YTF 高剂量组MSTD 及生精细胞发育评分升高,YTF+LY组MSTD及生精细胞发育评分降低(P<0.05),见表2。
2.3 大鼠睾丸组织bFGF、PLZF、C-kit 蛋白的表达水平 与Control 组比较,其余各组睾丸组织bFGF、PLZF、C-kit 蛋白表达水平均降低(P<0.05);与Model 组比较,LY 组bFGF、PLZF、C-kit 蛋白表达水平降低,YTF低、高剂量组bFGF、PLZF、C-kit蛋白表达水平升高(P<0.05),YTF+LY 组与Model 组差异无统计学意义;与YTF低剂量组比较,YTF高剂量组bFGF、PLZF、C-kit 蛋白表达水平升高,YTF+LY 组bFGF、PLZF、C-kit 蛋白表达水平降低(P<0.05),见图2、表3。
2.4 大鼠睾丸组织PI3K/Akt/mTOR 蛋白相对表达水平 与Control 组比较,其余各组睾丸组织PI3K、p-Akt/Akt、mTOR 蛋白表达水平均降低(P<0.05);与Model 组比较,LY 组PI3K、p-Akt/Akt、mTOR 蛋白表达水平降低,YTF 低、高剂量组PI3K、p-Akt/Akt、mTOR 蛋白表达水平升高(P<0.05),YTF+LY 组与Model 组差异无统计学意义;与YTF 低剂量组比较,YTF高剂量组PI3K、p-Akt/Akt、mTOR蛋白表达水平升高,YTF+LY 组PI3K、p-Akt/Akt、mTOR 蛋白表达水平降低(P<0.05),见图3、表4。
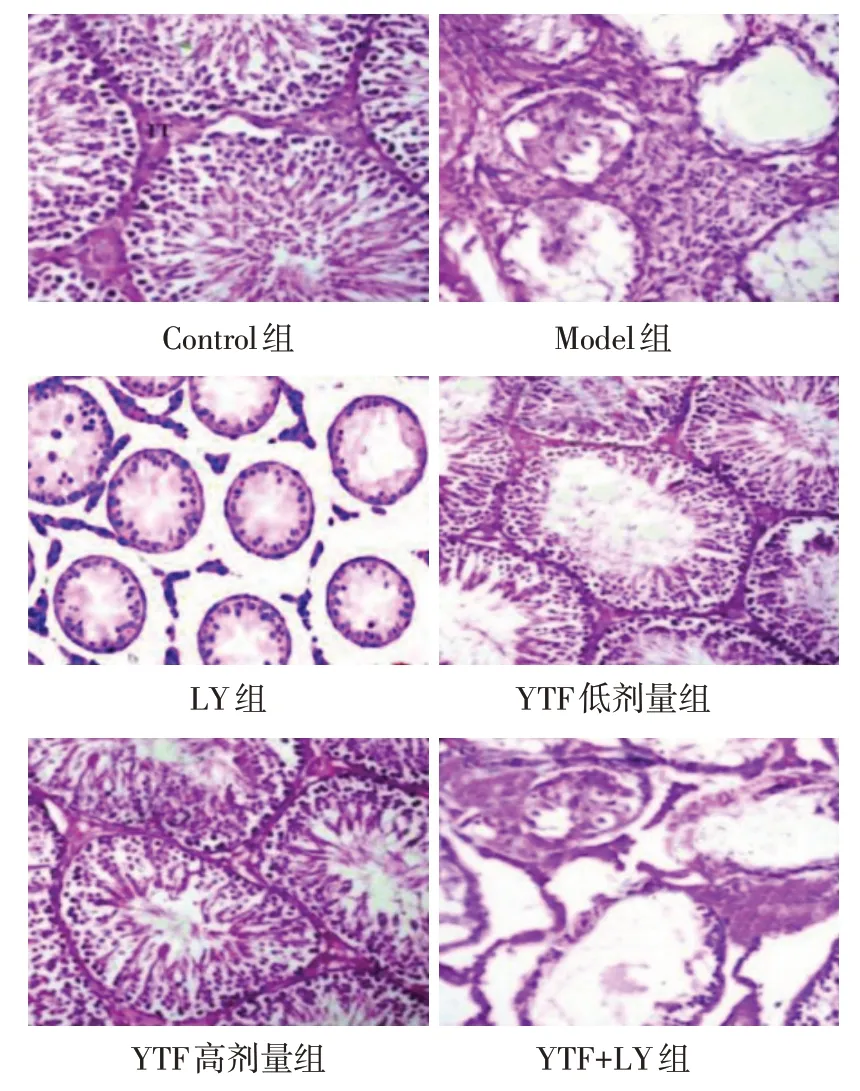
Fig.1 Pathological damages of rat testis(HE,×200)图1 大鼠睾丸组织病理损伤情况(HE,×200)
Tab.2 Comparison of testicular MSTD and spermatogenic cell development scores between six groups of rats表2 6组大鼠睾丸MSTD及生精细胞发育评分比较(n=10,±s)
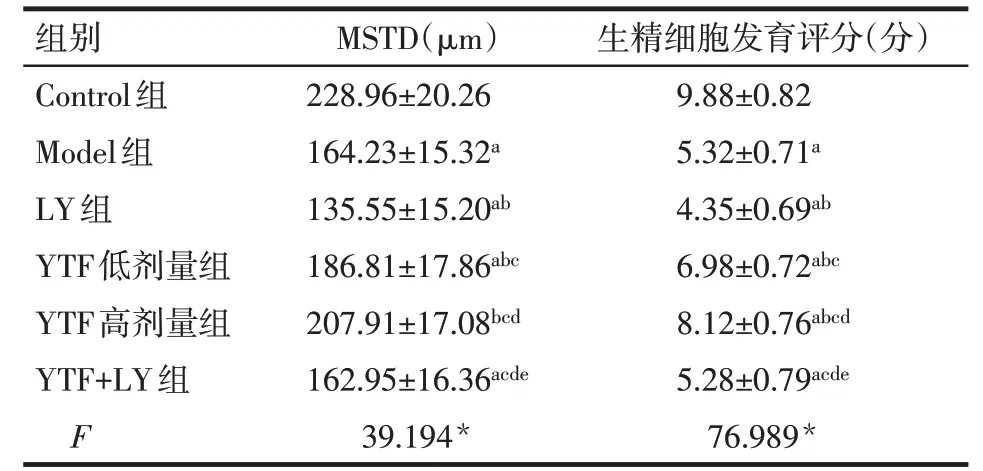
Tab.2 Comparison of testicular MSTD and spermatogenic cell development scores between six groups of rats表2 6组大鼠睾丸MSTD及生精细胞发育评分比较(n=10,±s)
组别Control组Model组LY组YTF低剂量组YTF高剂量组YTF+LY组F MSTD(μm)228.96±20.26 164.23±15.32a 135.55±15.20ab 186.81±17.86abc 207.91±17.08bcd 162.95±16.36acde 39.194*生精细胞发育评分(分)9.88±0.82 5.32±0.71a 4.35±0.69ab 6.98±0.72abc 8.12±0.76abcd 5.28±0.79acde 76.989*
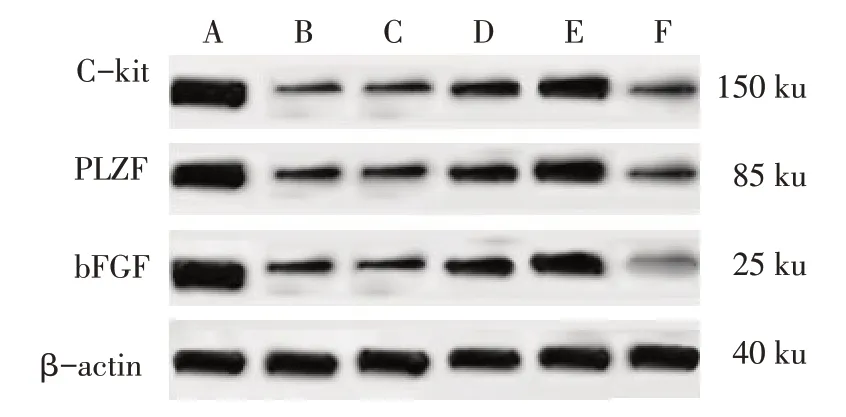
Fig.2 Western blot results of bFGF,PLZF and C-kit protein expression in rat testis图2 Western blot检测大鼠睾丸组织bFGF、PLZF、C-kit蛋白的表达
Tab.3 Comparison of bFGF,PLZF and C-kit in testis between six groups of rats表3 6组大鼠睾丸组织bFGF、PLZF、C-kit蛋白表达的比较(n=10,±s)

Tab.3 Comparison of bFGF,PLZF and C-kit in testis between six groups of rats表3 6组大鼠睾丸组织bFGF、PLZF、C-kit蛋白表达的比较(n=10,±s)
组别Control组Model组LY组YTF低剂量组YTF高剂量组YTF+LY组F bFGF/β-actin 1.39±0.13 0.62±0.12a 0.23±0.14ab 0.92±0.16abc 1.11±0.14abcd 0.60±0.13acde 90.805*PLZF/β-actin 1.36±0.12 0.55±0.15a 0.26±0.16ab 0.82±0.15abc 1.09±0.13abcd 0.53±0.13acde 82.736*C-kit/β-actin 1.37±0.16 0.59±0.15a 0.29±0.14ab 0.83±0.13abc 1.06±0.12abcd 0.56±0.12acde 79.739*

Fig.3 Western blot results of PI3K,p-Akt/Akt and mTOR protein expression in rat testis图3 Western blot检测大鼠睾丸组织PI3K、p-Akt/Akt、mTOR蛋白的表达
3 讨论
男性不育已成为当今研究的热点问题,睾丸组织基因表达及信号传导异常引起的精子减少或消失等生精功能障碍是导致男性生育力降低的主要原因[11]。血清T及FSH是影响睾丸生精功能的重要因素。邓智标[12]研究发现男性患者少精程度越严重,血清T越低,而FSH越高,提示血清T及FSH水平变化可能作为评价睾丸生精作用的重要指标。睾丸是男性的重要生殖器官,其组织病理改变和质量减轻,不仅会造成精子减少和精子畸形,还会影响男性的生精功能和生育能力[13]。而CP 可导致大鼠睾丸质量减轻、精子生成减少及生精小管管腔变窄等病理损伤,是少精/无精症动物造模的常用药物[14]。本研究给予大鼠腹腔注射CP 后发现,与Control 组比较,大鼠睾丸组织出现生精细胞数量减少或消失、生精小管管腔变窄、絮状精子减少等病理损伤,睾丸指数、MSTD 及生精上皮细胞发育情况评分、血清T 水平降低,FSH 水平升高,表明无精少精症模型制备成功。
中医认为肾瘀血虚、精血阻络、瘀阻精室是造成男性精液不化、精子减少、消失、畸形及不育的主要原因,而用活血化瘀通络药进行补肾、助精血、化瘀血可改善男性不育症状[6]。YTF方中熟地补肾益精血、菟丝子补肾填精;淫羊藿、巴戟天补肾助阳,丹参活血、牛膝引血下行并化瘀通络;水蛭入血并搜剔瘀血、散结通络;方中诸药配以黄芪,可益气活血通络、补肾助精。王祖龙等[7]研究发现YTF可通过抑制大鼠生精细胞凋亡来提高睾丸生精能力。基于YTF补肾助精及抑制生精细胞凋亡的作用,笔者推测YTF对无精/少精症性不育也可能有较好的治疗效果。本研究在给予无精/少精症大鼠YTF治疗后发现,与Model 组比较,YTF 低、高剂量组大鼠睾丸组织生精小管管腔内有少量絮状精子形成,睾丸指数、MSTD、生精上皮细胞发育情况评分及血清T 水平升高,血清FSH水平降低,提示经YTF治疗后,大鼠血清T及FSH水平趋于正常,睾丸质量增加,睾丸病理损伤减轻,精子生成增多,表明YTF 可提高无精/少精症大鼠精子生成能力,改善睾丸生精功能异常。
精子生成过程包括精原细胞增殖、分化,精母细胞减数分裂和精子形成,任一过程异常均可降低睾丸生精作用[15]。bFGF可促进生精上皮细胞增殖[16],PLZF 可调控精原干细胞增殖和自我修复[17],C-kit水平可反映精原细胞分化强弱,是精原细胞分化的标志物[18]。本研究结果显示,Model 组大鼠睾丸组织bFGF、PLZF、C-kit蛋白表水平均明显低于Control组,提示无精/少精症大鼠精子生成异常可能与精原细胞增殖分化减弱有关。Akt 为PI3K 的直接靶基因,PI3K 活化可促进Akt 磷酸化,磷酸化的Akt 可直接磷酸化mTOR,而活化的mTOR 不仅可调控血-睾屏障的形成、开放和闭合,还可调控下游靶分子核糖体蛋白S6 激酶(ribosomal protein S6 kinase,p70S6K)及真核翻译起始因子4E 结合蛋白(recombinant eukaryotic translation initiation factor 4E binding protein 1,4EBP1)的表达来调控精原细胞的增殖、分化与精子形成[8,19]。Busada 等[20]研究发现,抑制mTOR 通路表达后,睾丸组织中调节细胞分化因子C-kit基因翻译受阻,精原母细胞分化减弱而使未分化精原细胞在生精小管内累积,提示抑制mTOR 通路可能会抑制睾丸生精功能而不利于精子的形成。本研究结果显示,无精/少精症大鼠睾丸组织中PI3K、p-Akt/Akt 及mTOR 蛋白表达均低于Control组,提示Model 组大鼠睾丸生精功能异常可能与PI3K/Akt/mTOR通路表达受抑制有关。给予无精/少精症大鼠PI3K/Akt 通路抑制剂LY294002 后,LY 组大鼠PI3K/Akt/mTOR 通路蛋白、精原细胞增殖分化相关指标bFGF、PLZF、C-kit 均低于Model 组,而大鼠睾丸质量降低、睾丸病理损伤程度及睾丸生精作用评价指标异常程度均加重,提示阻断PI3K/Akt/mTOR 通路蛋白表达后,大鼠睾丸生精功能减弱。而YTF 低、高剂量组大鼠PI3K、p-Akt/Akt、mTOR 通路蛋白、精原细胞增殖分化相关指标bFGF、PLZF及C-kit表达则高于Model组,提示YTF改善无精/少精症大鼠生精作用可能是通过激活PI3K/Akt/mTOR通路来实现的。而YTF与LY294002联用后,大鼠睾丸组织PI3K/Akt/mTOR通路及上述睾丸生精作用指标变化均与YTF 低、高剂量组相反,提示LY294002 可逆转YTF对无精/少精症大鼠生精功能的改善作用。
Tab.4 Expression levels of PI3K,p-Akt/Akt and mTOR protein in testis of rats表4 6组大鼠睾丸组织PI3K、p-Akt/Akt、mTOR蛋白表达水平(n=10,±s)
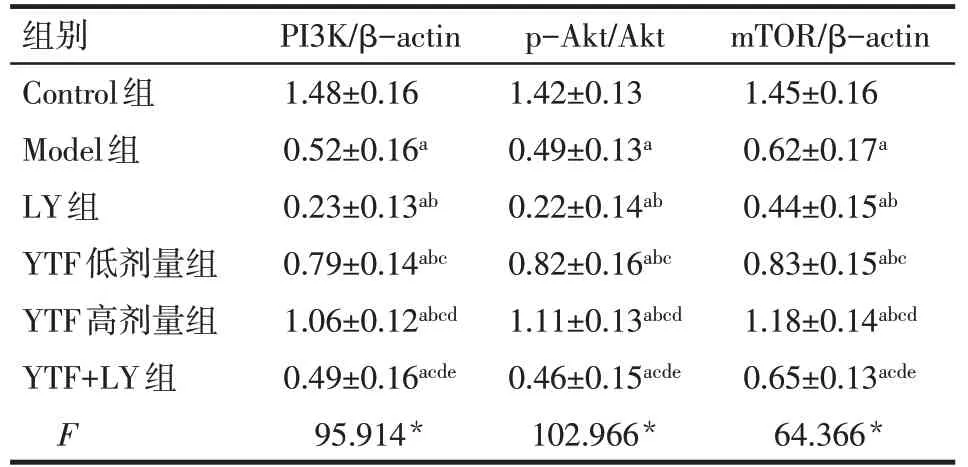
Tab.4 Expression levels of PI3K,p-Akt/Akt and mTOR protein in testis of rats表4 6组大鼠睾丸组织PI3K、p-Akt/Akt、mTOR蛋白表达水平(n=10,±s)
组别Control组Model组LY组YTF低剂量组YTF高剂量组YTF+LY组F PI3K/β-actin 1.48±0.16 0.52±0.16a 0.23±0.13ab 0.79±0.14abc 1.06±0.12abcd 0.49±0.16acde 95.914*p-Akt/Akt 1.42±0.13 0.49±0.13a 0.22±0.14ab 0.82±0.16abc 1.11±0.13abcd 0.46±0.15acde 102.966*mTOR/β-actin 1.45±0.16 0.62±0.17a 0.44±0.15ab 0.83±0.15abc 1.18±0.14abcd 0.65±0.13acde 64.366*
综上所述,YTF 可能通过激活PI3K/Akt/mTOR通路蛋白表达,改善无精/少精症大鼠生精功能,促进精子的形成;但PI3K/Akt/mTOR 通路调控精原细胞增殖、分化影响生精功能的靶向分子多而复杂,YTF 为复方药成分复杂,其发挥疗效作用的具体成分尚未明确,仍有待进一步研究验证。
