山姜素对脂多糖诱导的软骨细胞损伤的保护作用研究
2020-12-18代万武黄祖权张波杜勇军李兴艳
代万武,黄祖权,张波,杜勇军,李兴艳
山姜素(alpinetin)是从传统中药中提取的小分子药物,来源广泛,具有较高的药用价值和开发价值。研究发现山姜素具有抗菌、抗氧化、抗癌、降血压、降血脂、降血糖、止吐、镇痛等作用[1]。山姜素可以抑制炎症相关性疾病的发生发展,如在脂多糖(LPS)诱导子宫内膜炎的小鼠模型中,山姜素可以通过减轻子宫的组织学病变和降低髓过氧化物酶(MPO)的活性来保护小鼠免受子宫内膜炎侵害[2]。在LPS 诱导的小鼠急性肾损伤模型中,山姜素可以抑制肾组织中炎性因子如肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β 和IL-6 的产生,同时还可以通过抑制Toll 样受体(TLR)4 的表达和核转录因子(NF)-κB 的活化来减轻肾脏损伤[3]。但是,有关山姜素对骨性关节炎(osteoarthritis,OA)中软骨细胞作用的研究较少。本研究通过LPS 构建OA 中的软骨细胞损伤模型,旨在观察山姜素在OA 治疗中的作用,为小分子中药治疗OA提供参考。
1 材料与方法
1.1 实验动物 SPF级SD乳鼠5只,3~5 d,体质量(4±2)g,购自广西医科大学实验动物中心,合格证号SCXK(桂)2014-0002。
1.2 主要试剂与仪器 山姜素购自Sigma-Aldrich 公司,Eagle培养基、二甲基亚砜(DMSO)、CCK-8试剂盒、荧光素二乙酸酯/碘化丙啶(FDA/PI)购自Solarbio 公司,实时荧光定量聚合酶链反应(qPCR)试剂盒、RNA提取试剂盒、RNA分离试剂盒购自Megentec 公司,逆转录试剂盒购自Fermentas 公司,免疫荧光抗体、免疫荧光染料FITC购自博士德公司,Ⅱ型胶原酶(Col2a1)、胰蛋白酶、活死细胞染色试剂盒、DMEM 培养基、胎牛血清、青链霉素混合液购自Gibco 公司,酶标仪购自Thermo Scientific MultiskanGO 公司,荧光显微镜购自日本Olympus公司,Light Cycle 96仪器购自瑞士Roche公司。
1.3 软骨细胞的提取、分离和培养 于SD 乳鼠的膝关节处分离提取原代软骨细胞后纯化培养。具体步骤:将乳鼠过量麻醉致死,在超净台用无菌器械获取乳鼠四肢关节处的软骨组织,并剪成小颗粒后用胰蛋白酶在37 ℃下消化30 min,生理盐水清洗3 遍后采用2 g/L 的Col2a1 置于37 ℃、5%CO2培养箱中消化4 h后,重悬,取上清离心(1 000 r/min,5 min),收集细胞,在含10%(V/V)胎牛血清和1%(V/V)青霉素/链霉素的改良Eagle培养基中培养、传代。根据细胞生长形态,每1~2 d传代1次,取对数生长期细胞完成后续实验。
1.4 CCK-8 法检测软骨细胞活性 取对数生长期细胞,按5×103/孔的密度将软骨细胞接种在96孔板中,将提取的软骨细胞分为对照组、LPS 诱导组(模型组)和LPS 诱导后加山姜素处理组(山姜素组)。所有组别均设3 个复孔,置于37 ℃、5%CO2培养箱中培养24 h待细胞贴壁。模型组和山姜素组中加入10 mg/L的LPS诱导1 h,构建软骨细胞损伤模型[4],随后山姜素组中分别加入0.312 5、0.625、1.25、2.5、5、10、20、30、40、50 mg/L 山姜素,置于培养箱中培养24 h 后每孔各加入10 μL CCK-8溶液,继续孵育2~4 h。酶联免疫法检测450 nm波长处每个孔的吸光度。
1.5 FDA/PI染色观察软骨细胞的存活 取对数生长期的软骨细胞,消化离心计数后按1.5×104种植在含爬片的24 孔板中,培养24 h待细胞贴壁,加入LPS诱导软骨细胞损伤,再加5 mg/L 山姜素处理培养24 h 后,用现配的FDA/PI 染液(在1 mL PBS中分别加入0.5 μL FDA和2 μL的PI,混匀)室温孵育5 min,PBS 冲洗3 次,每次3 min,在荧光显微镜下观察拍照、记录分析。
1.6 qPCR 检测 根据试剂盒步骤提取各组细胞总RNA,测定提取RNA浓度,逆转录反应合成cDNA再进行qPCR反应,检测IL-1β、IL-6、TNF-α、诱导型一氧化氮合酶(iNOS)、基质金属蛋白酶-13(MMP-13)、Col2a1的mRNA 表达水平,引物序列见表1。每个组别设置3个复孔。反应体系为20 μL,反应条件为:95 ℃10 min,40 ℃10 s,60 ℃60 s,40个循环。按照2-ΔΔCt方法计算不同组别的mRNA相对表达量,重复3次。

Tab.1 Primer sequence for qPCR表1 qPCR所用引物系列
1.7 免疫荧光分析软骨细胞中IL-6的表达 将软骨细胞按2.0×104接种在含爬片的24孔板中,培养24 h等待细胞贴壁。LPS 诱导炎症环境,按照对照组、模型组和山姜素组处理24 h,PBS冲洗3次后用无水乙醇固定15~30 min,PBS洗3次,每次5 min,待用。将准备好的细胞爬片在室温环境下用3%的H2O2孵育10~15 min,PBS 冲洗3 次,每次3 min;室温条件下山羊血清孵育10~15 min,弃掉山羊血清,注意勿洗;再用IL-6一抗稀释液(1∶200)4 ℃冰箱孵育过夜,PBS冲洗3次,每次3 min;然后,滴加Cy3-羊抗兔IgG二抗稀释液(1∶200),室温避光孵育1 h,PBS冲洗3次,每次3 min;加入DAPI染液,避光孵育15 min,PBS 冲洗3 次,每次3 min。细胞爬片防淬灭剂封片后荧光显微镜下观察拍片、记录分析。
1.8 统计学方法 采用SPSS 23.0和Graph pad 8.0软件对各实验的结果数据进行分析,计量资料以±s表示,多组间数据用单因素方差分析,组间两两比较采用LSD-t法。2 组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 山姜素处理对LPS 诱导的软骨细胞活性的影响 模型组的吸光度(0.55±0.04)较对照组(0.65±0.03)降低(n=3,t=3.896,P<0.05)。当采用剂量为5 mg/L的山姜素处理时,吸光度最高(n=3,F=5.321,P<0.05);当剂量>5 mg/L时,软骨细胞的吸光度并未随之增加。因此选择5 mg/L的山姜素剂量进行后续实验研究,见图1。

Fig.1 CCK-8 assay was used to detect the effect of alpinetin on the activity of LPS-induced chondrocytes.图1 CCK-8法检测山姜素组山姜素对LPS诱导软骨细胞的活性的影响
2.2 FDA/PI 染色检测山姜素对软骨细胞的保护作用 与对照组比较,模型组的死细胞数量增加,活细胞数量减少;与模型组比较,山姜素组死细胞数量减少,活细胞数量增加,见图2。
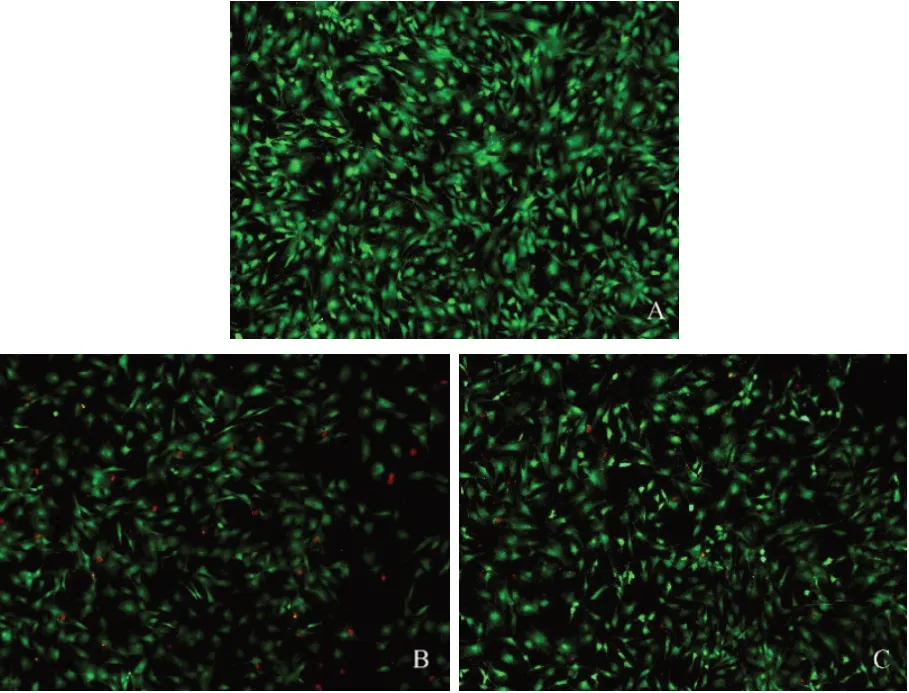
Fig.2 FDA/PI staining was used to detect the effect of alpinetin on chondrocytes cells(×200)图2 FDA/PI染色检测山姜素对软骨细胞的作用(×200)
2.3 山姜素对Col2a1、IL-1β、IL-6、iNOS、TNF-α、MMP-13mRNA 的调控 与对照组相比,模型组Col2a1mRNA 表达降低,IL-1β、IL-6、iNOS、TNF-α、MMP-13mRNA 表达均显著增高(P<0.01);山姜素组Col2a1mRNA 较模型组增高,IL-1β、IL-6、iNOS、TNF-α和MMP-13mRNA的表达水平较模型组降低(P<0.01),见表2。
Tab.2 Comparison of the mRNA expression levels of inflammatory factors between 3 groups表2 3组炎性因子mRNA表达水平的比较(n=3,±s)
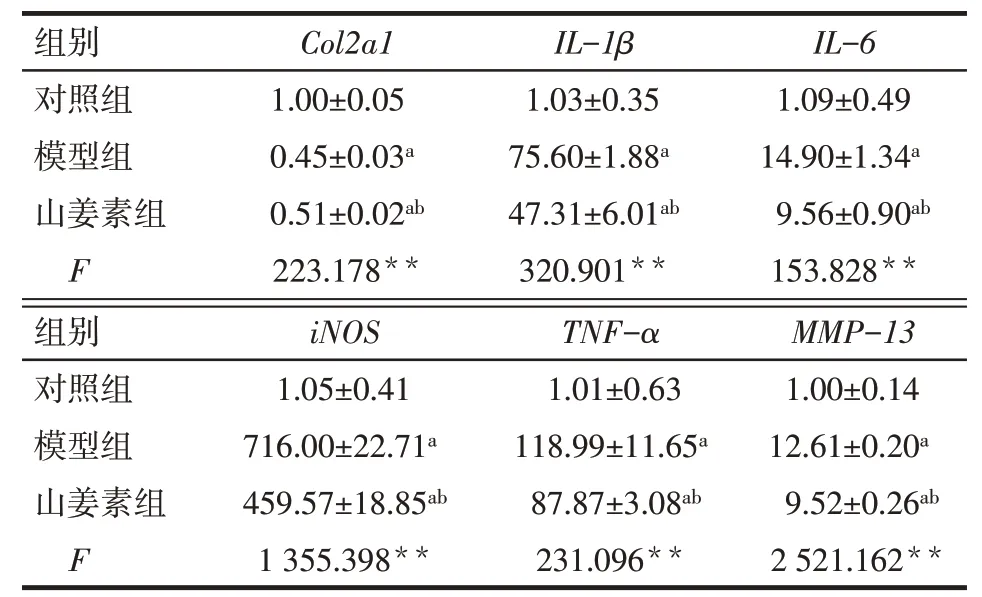
Tab.2 Comparison of the mRNA expression levels of inflammatory factors between 3 groups表2 3组炎性因子mRNA表达水平的比较(n=3,±s)
**P<0.01;a与对照组比较,b与模型组比较,P<0.05
组别对照组模型组山姜素组F Col2a1 1.00±0.05 0.45±0.03a 0.51±0.02ab 223.178**IL-1β 1.03±0.35 75.60±1.88a 47.31±6.01ab 320.901**IL-6 1.09±0.49 14.90±1.34a 9.56±0.90ab 153.828**组别iNOS TNF-α MMP-13对照组模型组山姜素组F 1.05±0.41 716.00±22.71a 459.57±18.85ab 1 355.398**1.01±0.63 118.99±11.65a 87.87±3.08ab 231.096**1.00±0.14 12.61±0.20a 9.52±0.26ab 2 521.162**
2.4 免疫荧光检测各组软骨细胞中IL-6 的表达 与对照组比较,模型组中IL-6 表达水平增高;与模型组比较,山姜素组中IL-6 表达水平降低,见图3。
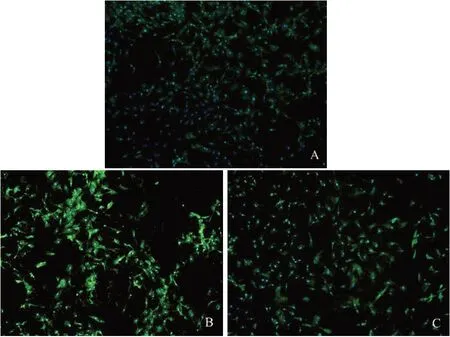
Fig.3 Immunofluorescence analysis of the regulation of alpinetin on IL-6 expression in chondrocytes cells(×200)图3 免疫荧光分析山姜素对软骨细胞IL-6表达的调控(×200)
3 讨论
OA是由多种因素引起的慢性骨关节疾病,涉及关节软骨、滑膜、软骨下骨等组织,在中老年人中最常见并严重影响其健康和生活质量[5-6]。疾病早期大量炎性因子(如IL-1β、MMP-13和TNF-α)的过量表达和关节软骨基质的降解[7]导致关节软骨局部代谢紊乱,破坏软骨细胞DNA 的合成以及细胞膜结构,从而导致软骨细胞损伤以及软骨下骨重塑,最终形成OA。
OA的主要临床表现为关节疼痛、关节摩擦感或摩擦音、僵硬、运动受限等。目前OA 的治疗目标是减轻疼痛症状,矫正关节畸形和改善关节活动功能。治疗方法主要包括阿片类镇痛剂和非甾体类抗炎药物治疗,关节腔内注射玻璃酸钠物理治疗以及全(半)关节置换手术治疗[8]。然而,这些药物和治疗手段只能减轻疼痛,并不能阻止OA 的进展。因此,在早期进行关节软骨保护,减缓关节软骨的退化是延缓OA进一步发生发展的理想策略。
山姜素是一种从天然植物中提取的类黄酮单分子药物,具有良好的抗菌、抗氧化作用。研究表明,山姜素可通过过氧化物酶体增殖物激活受体γ(PPARγ)/NF-κB 信号通路抑制角叉菜胶诱导的小鼠急性肾损伤中炎性介质的产生[9]。He 等[10]证实山姜素可通过TLR4 信号通路降低葡聚糖硫酸钠(DSS)诱导的小鼠急性结肠炎相关炎性指标的表达。本研究旨在探讨山姜素对LPS 诱导的OA 模型的软骨细胞的保护作用,结果表明山姜素能够有效地抑制LPS 诱导的软骨细胞损伤。关节软骨的主要成分是软骨细胞和细胞外基质,其中胶原是细胞外基质中的主要成分,Col2a1 在其中起着软骨支架结构的重要作用[11]。在山姜素组中Col2a1的基因表达较模型组增高,说明山姜素还可以通过促进Ⅱ型胶原的表达来保护软骨细胞。研究发现,IL-1 可以通过蛋白激酶/调节激酶/特异性蛋白1(MEK/ERK/Sp1)信号通路来促进关节软骨的降解,并增强关节软骨结构重塑[12]。此外,在OA 关节滑液和关节软骨中能够检测到IL-6的表达,这表明IL-6参与OA的发生发展过程[13]。IL-1β和TNF-α是OA的关键促炎介质,同时TNF-α 对MMP-3 有较强的刺激作用[14]。此外,在OA 中,MMP-13 的高表达会导致软骨细胞外基质的降解[15]。另有研究报道,抑制MMPs 的表达可以延缓关节软骨的进展。在本研究中,山姜素组中的MMP-13的表达较模型组显著降低,并较好地维持了细胞的形态并促进了软骨细胞的增殖,进而保护软骨细胞。一氧化氮(NO)已被确定为OA中的主要炎性介质之一,在OA的发展和进程中驱动多种病理变化。软骨细胞中NO 的过量产生会导致软骨破坏和细胞损伤,iNOS催化软骨细胞中NO 的合成[16],因此iNOS 的表达水平在一定程度上反映了软骨细胞的损伤情况。在本研究中,模型组中的炎性因子(IL-1β、IL-6、TNF-α和iNOS)的表达水平显著增加,山姜素组中的各项炎性因子明显减少。
综上所述,山姜素能够通过抑制炎症软骨细胞中炎性因子IL-1β、iNOS、IL-6、TNF-α 及MMP-13的表达来维持软骨细胞外基质的稳态,并促进Col2a1 的表达,表明山姜素可能是治疗骨性关节炎的一种可选择的药物,但有关山姜素保护软骨细胞的具体细胞信号转导机制还需进一步探讨。
