亚硒酸钠对蛋白核小球藻生长及抗氧化酶活性的影响
2020-12-17覃宝利王宣朋单金峰丁辰龙
覃宝利,王宣朋,单金峰,丁辰龙
(江苏省农业科学院宿迁农科所,江苏 宿迁 223800)
硒是一种微量元素,以剂量依赖的方式影响生物体,具有抗癌作用,在哺乳动物发育、免疫和延缓衰老中起着重要作用[1]。人体如果缺硒,将会导致多种疾病的发生。在自然界中硒多以无机硒形式存在,生物利用度低且易引起硒中毒,而有机硒毒性低、生物活性高且易被人类或其他生物吸收利用,所以有机硒常被视为高效且安全的补硒制剂[2]。在微藻培养基中添加适量亚硒酸钠[3-4]以实现微藻对硒的生物富集和转化,是获取有机硒化合物简便而有效的途径之一[5]。在水生生态系统中,微型藻类是硒的主要吸收者,它们积累无机硒,然后转化成有机硒,再通过食物链将硒转移到高等生物体内(如轮虫、桡足类、枝角类和鱼类等)[6]。因此,微藻硒积累和硒的有机化过程已成为当前微藻富硒研究的重要方向。
微藻对硒的生物转化主要是合成硒蛋白、硒多糖等生物大分子[7-9],其中含硒的酶类如谷胱甘肽过氧化物酶(GSH-Px)等对哺乳动物具有重要的生理意义,是阻断人体内自由基反应、清除有毒产物过氧化脂质的重要物质[5]。在高等植物代谢和环境胁迫的过程中也产生大量的游离自由基,这些自由基可被超氧化物歧化酶(SOD)等相应酶系统清除,亦可被GSH-Px清除。目前研究报道的富硒微藻有钝顶螺旋藻Spirulinaplatensis[10-11]、盐藻Dunaliellasalina[12]、紫球藻Porphyridiumsp.[13]、栅藻Scenedesmusquadricauda[14]和小球藻Chlorellasp.[15-19]等,这些研究表明,硒对微藻的生长和抗氧化系统的发生均具有促进和抑制的双重效应,需要合理地控制硒添加浓度。
蛋白核小球藻Chlorellapyrenoidosa是绿藻门绿藻纲绿球藻目小球藻科小球藻属的单细胞藻类,其藻体富含蛋白质、不饱和脂肪酸、活性代谢物、生物多糖、维生素和微量元素等多种营养成分[20]。因其繁殖速度快、分布广泛、易于培养,蛋白核小球藻已成为当前常用的试验材料和水产饵料微藻。已有学者证明,硒强化小球藻对养殖动物的生长及免疫活性有很好的促进作用[21-22]。低浓度硒有助于正常细胞的生长和谷胱甘肽过氧化物酶功能的发挥,高浓度硒是有毒的,会导致活性氧ROS的产生,从而导致DNA氧化、DNA双链断裂和细胞死亡[2]。目前,有关亚硒酸钠对蛋白核小球藻生长及抗氧化酶活性的研究较少,且适宜硒浓度及富硒量的研究结果差异较大。为此,本试验中通过研究不同质量浓度亚硒酸钠对蛋白小球藻生长及抗氧化酶活性的影响,来确定蛋白核小球藻富集亚硒酸钠的最佳浓度和培养时间,旨在阐明蛋白核小球藻对硒有机化过程的机制,也为富硒小球藻的开发提供试验依据。
1 材料与方法
1.1 材料
试验用蛋白核小球藻藻种购自中国科学院武汉水生生物研究所,藻种编号为 FACHB-5。
1.2 方法
1.2.1 小球藻的培养 称取40 mg Na2SeO3溶于40 mL超纯水,配制l g/L的亚硒酸钠贮备液,通过贮备液稀释的方法设置不同质量浓度(0、2、4、6、8、10、20、40、60、80、100 mg/L)的含亚硒酸钠的BG11(pH 7.0)培养基。在250 mL锥形瓶中加入100 mL培养基,于灭菌锅中进行121 ℃高压灭菌30 min。在超净操作台中提取处于指数增长期的蛋白核小球藻接种到不同硒浓度的培养基中,接种后藻细胞初始浓度均为1×106cells/mL,置于人工光照培养箱内。培养条件温度为25 ℃,光照强度为25 μmol/(m2·s),光周期中光暗比(L∶D)为12 h∶12 h,每天早、中、晚各摇动1次。每组设置3个平行,培养周期为13 d。每隔1天取样1次。采样结束后继续观察30 d,查看各组试验藻是否出现红硒化现象。
1.2.2 藻密度及生长速率的测定 使用血球计数器,在显微镜下计算藻密度。使用紫外可见分光光度计在波长为 685 nm下测定藻OD值,其相对生长速率(RGR)计算公式[17]为
RGR=ln(Nt/N0)/t。
其中:N0为藻初始 OD 值;Nt为培养第t天后的藻 OD值。
1.2.3 富硒普通小球藻硒含量的测定 分别在第7天和第13天取样10 mL,将所有处理组藻液移至 14 mL离心管内,以6 000 r/min离心12 min,去上清,再用超纯水洗涤离心收集藻浓缩液,经真空冷冻干燥,获得藻粉。用电感耦合等离子发射光谱仪(ICP) 测定藻体的含硒量[23]。
1.2.4 抗氧化酶活性的测定 将试验培养的蛋白小球藻以5 000 r/min离心10 min,弃上清。用去离子水反复冲洗藻沉淀,直到藻体外附着的培养基完全冲洗干净。将微藻沉淀置于预冷的PBS 缓冲液(pH 7.0)中,在冰上超声破碎(9 min),混合匀浆以10 000 r/min离心 30 min,取上清测定酶活性。使用 BCA法测定上清中总蛋白浓度。小球藻中SOD和GSH-Px活性测定均严格按照生物试剂盒(南京建成生物工程研究所)说明书测定。
1.3 数据处理
试验数据均以平均值±标准差 (mean±S.D.) 表示,采用 SPSS 20.0 软件对试验结果进行单因素方差分析 (ANOVA),显著性水平设为 0.05。
2 结果与分析
2.1 亚硒酸钠对蛋白核小球藻生长的影响
从图1可见:不同质量浓度的亚硒酸钠对小球藻生长影响不同;第9天后,2、4 mg/L亚硒酸钠对小球藻的生长有显著促进作用(P<0.05),6 mg/L及以上亚硒酸钠对小球藻生长具有显著抑制作用(P<0.05),尤其8~100 mg/L质量浓度组在试验前9 d内几乎停止生长,但第9天后藻细胞数明显增加。
从图2可见,第30天时100 mg/L处理组藻液开始变红,第33天时80 mg/L处理组藻液开始变红,第37天时60 mg/L处理组藻液开始变红,而10、20、40 mg/L处理组在43 d的观察期内为未变红。可见,在高硒环境中,大量红色元素硒从藻体中析出,导致培养基变为红色。
从表1可见:试验前7 d,2、4 mg/L处理组藻细胞相对生长速率与对照组相比无显著性差异(P>0.05),其他质量浓度组显著高于对照组(P<0.05);试验第9天时,6~10 mg/L处理组小球藻生长速率显著低于对照组(P<0.05),第13天时生长速率与对照无显著性差异(P>0.05);20~100 mg/L处理组在试验前9 d内为负生长,第9天后恢复生长,且生长速率显著低于对照组(P<0.05)。

表1 不同亚硒酸钠质量浓度对蛋白核小球藻细胞相对生长速率的影响Tab.1 Effects of different concentrations of sodium selenite on relative growth rate of green alga Chlorella pyrenoidosa
2.2 蛋白核小球藻中硒的生物转化
从图3可见:亚硒酸钠质量浓度在2~100 mg/L范围内,蛋白核小球藻细胞含硒量随亚硒酸钠质量浓度的增加而增加;第7天时,2、4 mg/L处理组藻细胞含硒量显著高于对照组(P<0.05);第13天时,80、100 mg/L处理组藻细胞含硒量显著高于其他质量浓度组及对照组(P<0.05),6~60 mg/L处理组藻细胞含硒量又显著高于2~4 mg/L处理组(P<0.05)。
2.3 亚硒酸钠对蛋白核小球藻抗氧化酶活性影响
从图4可见:试验第7天时,2、4 mg/L亚硒酸钠处理组小球藻细胞SOD酶活性显著高于对照组(P<0.05);第13天时,小球藻细胞SOD酶活性总体上随亚硒酸钠质量浓度的增加呈先升高后降低的趋势,2~20 mg/L处理组酶活性显著高于对照组(P<0.05),其中10~20 mg/L组酶活性最高,显著高于其他处理组(P<0.05),100 mg/L处理组酶活性最低(P<0.05)。
从图5可见:第7天时,2、4 mg/L亚硒酸钠处理组小球藻细胞GSH-Px酶活性显著高于对照组(P<0.05),其中,4 mg/L处理组酶活性最高(P<0.05);第13天时,小球藻细胞GSH-Px酶活性总体上随亚硒酸钠质量浓度的增加呈先降低后升高的变化趋势,20~100 mg/L亚硒酸钠处理组小球藻细胞GSH-Px酶活性显著高于其他处理组(P<0.05),2、4 mg/L处理组GSH-Px酶活性与对照组无显著性差异(P>0.05),但显著高于8~10 mg/L处理组(P<0.05)。
2.4 亚硒酸钠对小球藻细胞形态和分裂方式的影响
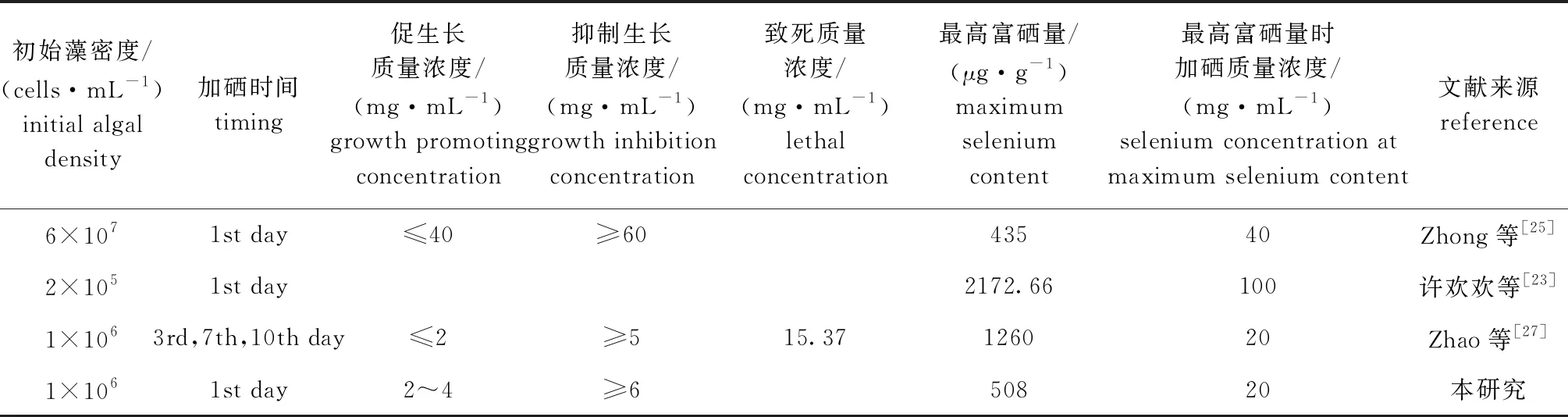
因蛋白核小球藻呈圆球状,参照Park等[24]的方法,用细胞直径表示细胞体积大小,按细胞直径(D)将藻细胞体积大小分为3个规格:2 μm 硒对微藻具有生长促进与毒性抑制双重性,微藻的富硒量与添加的硒质量浓度不成正比。添加硒质量浓度较低时,微藻富集硒的能力随硒质量浓度升高而增大;添加硒质量浓度较高时,微藻富集硒的能力随硒质量浓度升高而降低。本研究中在低硒质量浓度范围内,小球藻富硒能力逐渐增加,与吕蓉等[15]、Zhong等[25]及肖俊超等[26]研究结果一致,硒质量浓度≥6 mg/L时,小球藻几乎不生长甚至死亡,对硒没有富集能力,但恢复生长后藻细胞含硒量随硒质量浓度的升高而增加,这可能是小球藻适应高硒环境后富硒能力增强的结果,此现象在其他富硒藻类研究中均未出现,其原因有待进一步探究。因此,实际生产中对初始密度为1×106cells/mL的小球藻进行富硒培养时,添加亚硒酸钠的质量浓度最好控制在4 mg/L以内。 目前有关硒对小球藻生长影响的研究结果差异较大。不同研究者采用的藻种不同,培养条件、藻种初始密度、硒添加时间不同时,所报道的小球藻生长适宜硒浓度和抑制硒浓度值也不同,而对于相同藻种,培养条件不同时结果也不尽相同(表2)。本研究中亚硒酸钠质量浓度为2~4 mg/L时对小球藻生长具有促进作用,硒质量浓度为6 mg/L及以上时则具有抑制作用,说明6 mg/L亚硒酸钠已达到胁迫浓度。Zhao等[27]发现,小球藻初始密度为1×106cells/mL,添加硒质量浓度为2 mg/L时藻细胞数量最多,比对照组高出13%,硒质量浓度为5 mg/L及以上时对蛋白核小球藻生长具有抑制作用,这与本研究结果相似。Zhong等[25]研究发现,小球藻初始密度为6×107cells/mL,添加40 mg/L亚硒酸钠对蛋白核小球藻生长具有促进作用,硒质量浓度为60 mg/L及以上时则抑制藻类生长。许欢欢等[23]研究发现,0~100 mg/L硒质量浓度变化未引起小球藻生长的显著差异。Zhong等[25]研究结果与本研究不同,可能是其试验中初始藻细胞密度较高的原因,而许欢欢等[23]的研究可能是其培养光照时间较长(光暗周期L∶D=16 h∶8 h)促进了小球藻细胞分裂的原因。 表2 亚硒酸钠对蛋白核小球藻生长与富硒量的影响(均为一次加硒) 本研究中,亚硒酸钠质量浓度为20~100 mg/L时,试验前期小球藻细胞生长速率为负值,这说明产生了严重毒性作用,引起大量藻细胞死亡。Zhao等[27]研究得出,亚硒酸钠对蛋白核小球藻细胞的致死质量浓度为15.37 mg/L。这可能是本研究中在硒质量浓度为20 mg/L及以上的环境下小球藻出现死亡的原因。但这些藻细胞并未全部死亡,而是有一小部分存活下来,且在第9天时开始生长速率为正值。Umysová等[1]研究硒化合物对栅藻的毒性作用时也发现类似现象,不同的是其试验中存活下来的栅藻藻细胞未分裂,而本研究中存活下来的小球藻恢复细胞分裂,其中,较低质量浓度组生长速率接近对照组,这也印证了小球藻对硒耐受性较高的特点[28]。 杨芳[29]研究发现,硒浓度概念不能很好地反映硒的生物效应,引入“硒剂量”的概念(即单位藻细胞上所承受的硒量)能更准确地表达硒对螺旋藻细胞生长的影响。小球藻细胞密度较低条件下富硒培养时,加入一定浓度的硒,每个藻细胞可能承受较大剂量的硒,此时硒对小球藻的生长不利;而小球藻细胞密度较高时,加入相同浓度的硒,每个藻细胞所承受的硒剂量则较小,硒对小球藻的生长可能无害。因此,不同初始密度的小球藻培养液中添加相同浓度的硒,每个藻细胞所承受的硒剂量不相同,对小球藻的影响可能就大相径庭。如在本研究小球藻初始密度提高10倍的藻培养液中添加相同浓度的亚硒酸钠,结果显示,该处理对小球藻生长并无显著性影响(数据未列出)。藻密度的不同是引起硒胁迫强度变化的主要因素[11],因此,研究硒对小球藻生长及生理生化指标的影响时,应以单位藻细胞上所承受的硒量来探讨。 当处理条件为低硒胁迫浓度和短时间时,SOD酶活性受诱导而升高,这是植物本身的一种防御反应,可认为是植物在轻度胁迫下的锻炼效应。但这种保护反应是有限的,随着处理时间的延长和硒胁迫浓度的增加,保护酶的活性受到抑制而下降。培养后期氮、磷等主要无机盐消耗殆尽,可能会抑制新的抗氧化酶的合成,已合成的抗氧化酶不断分解,最终导致抗氧化酶活性下降[5],这可能是本试验中第13天时SOD活性比第7天时降低的原因。李亚男等[12]在研究硒对盐藻生长及抗氧化酶活性的影响时发现,SOD活性对低硒浓度无响应,但当亚硒酸钠质量浓度超过10 mg/L时,其活性明显提高。肖俊超等[26]研究也发现,当硒胁迫质量浓度达到一定量(20 mg/L)时,才能诱导普通小球藻SOD酶活性显著增大。而本研究结果表明,低质量浓度(2~4 mg/L)亚硒酸钠就能够诱导蛋白核小球藻SOD活性显著增加。Zhao等[27]也发现类似结果,这说明不同藻类SOD活性对硒处理的响应不同。 本试验中,在试验第13天时,高硒质量浓度处理组 GSH-Px酶活性显著高于低硒质量浓度组和对照组,可能是高硒质量浓度组中硒参与合成的硒蛋白协助小球藻细胞对抗氧化逆境,如GSH-Px通过催化过氧化物被降解过程,保持细胞持续健康。另外,GSH-Px活性的变化与藻体中的硒含量并无较大联系[30],而是与硒胁迫强度密切相关,硒胁迫强度越大,GSH-Px活性越高。陈思嘉等[11]指出,在较高的硒胁迫强度下,藻体主要是靠强化GSH-Px的活性来抵抗由硒引起的氧化胁迫,细胞中的H2O2主要由GSH清除。说明第13天时亚硒酸钠浓度≥20 mg/L的处理对小球藻的胁迫强度大于10 mg/L以内的处理。 本研究中未添加亚硒酸钠的小球藻细胞分裂方式为典型的二分裂[32],大部分直径小于4 μm。而20 mg/L及以上亚硒酸钠处理组小球藻细胞有不同于二分裂的分裂方式,细胞体积明显增加,出现的细胞团体积随亚硒酸钠质量浓度的增加而增大。有研究表明,亚硒酸盐细胞毒性对叶绿体、基质、类囊体和淀粉核均有影响,且在较高质量浓度下,淀粉颗粒和含硒电子致密颗粒的数量和体积均有所增加[33]。这可能是本研究中较高质量浓度硒处理下藻细胞体积变大的原因。四尾栅藻暴露于100 mg/L亚硒酸盐处理下,其细胞畸形、叶绿体漂白、刺数目和位置异常[1]。因此,本试验中出现的细胞团,也可能是小球藻在高硒环境中的一种异常表现。硒对植物的毒性一般归因于硒可以不加区别地替代硫元素,并将硒氨基酸合并到蛋白质中[34]。本研究中小球藻细胞异常的分裂方式,可能跟硒诱导的核酸变化与酶活性的相互关系有关,尤其是硫氧还蛋白还原酶,这种广泛分布的黄素酶提供还原性硫氧还蛋白,一种二硫醇氢供体,用于还原二硫蛋白,并将核糖核酸还原为脱氧核糖核酸,这是DNA合成的第一个独特步骤[34]。 郑建仙[35]研究酵母对硒的生物富集与转化时发现红硒化现象,表现为培养液中出现红色沉淀,即酵母细胞将毒性较大的亚硒酸钠还原成无毒的元素硒。孙显[31]也发现,普通小球藻在高硒环境中也会有大量红色元素硒从藻体析出。本试验中小球藻在硒处理1个月之后,高质量浓度硒处理组最先有大量红色元素硒从藻体中析出。因此,在生产实践中应合理控制硒添加质量浓度及富硒培养时间,尽可能减少红硒现象的发生。 1)低质量浓度(2~4 mg/L)的亚硒酸钠对蛋白核小球藻生长呈显著促进作用,高质量浓度(6~100 mg/L)的亚硒酸钠呈现显著抑制作用。 2)添加不同质量浓度的亚硒酸钠处理时蛋白核小球藻的SOD 酶活性与GSH-Px酶活性的表现不同。 3)高硒质量浓度处理组蛋白核小球藻在试验中期恢复生长,到试验末期生长速率明显增加。 总之,蛋白核小球藻富硒培养时不可添加过多亚硒酸钠,应控制硒添加质量浓度及富硒培养时间,以免出现藻体中毒死亡现象。3 讨论
3.1 蛋白核小球藻对硒的富集
3.2 亚硒酸钠对蛋白核小球藻生长的影响
3.3 亚硒酸钠对蛋白核小球藻抗氧化酶活性的影响
3.4 亚硒酸钠对蛋白核小球藻的毒性
4 结论
