棉子糖对锦鲤肠道健康、非特异性免疫、生长性能及观赏品质的影响
2020-12-17李铁梁邢薇徐冠玲马志宏姜娜郁欢欢罗琳
李铁梁,邢薇,徐冠玲,马志宏,姜娜,郁欢欢,罗琳
(北京市水产科学研究所,北京 100068)
锦鲤Cyprinuscarpiovar.koi是深受人们喜爱的一种名贵观赏鱼。2000年以来,中国锦鲤养殖逐渐形成产业化和规模化,与此同时,疾病频发成为限制其产业发展的瓶颈。以锦鲤养殖中最常见的肠道疾病为例,肠炎会引起锦鲤脱离群体游动、体色发暗、食欲下降,进而影响锦鲤观赏价值,严重时还会引发其他并发症进而导致鱼体死亡[1]。传统上,在水产动物疾病防治中主要使用抗生素[2],但抗生素滥用可引起环境问题,同时也会引起水产动物肠道菌群紊乱失调进而导致免疫力下降,故抗生素在水产养殖中正逐渐被禁止使用[3],或通过在饲料中添加具有免疫促进功能的添加剂进行替代[4-5]。
棉子糖是一种具有较强增殖双歧杆菌作用的功能性低聚糖,能促进肠道双歧杆菌、乳酸菌的增殖,降低致病性链球菌的数量。研究证实,在鱼用饲料中添加棉子糖具有促进免疫、降低肠道疾病发生的作用[2, 6-8]。目前,尚未见棉子糖应用于观赏鱼饲料的研究报道。观赏鱼与食用鱼饲养目的不同,影响其市场价值的主要是体色、形体和健康等观赏品质[9],因此,其配合饲料的配制中除了需要关注营养价值之外,还需关注饲料对观赏品质的影响。中国鱼用饲料侧重食用鱼饲料开发,其质量和价格均具有较强的国际竞争力,而观赏鱼饲料的研发主要借鉴食用鱼饲料的研究结果,导致饲料的增色、增体、塑形等功能与效果缺少国际竞争优势。笔者在研究比较国内外观赏鱼饲料养殖锦鲤时发现,与日本产锦鲤饲料相比,国产观赏鱼饲料在营养配方精准度、功能性研究等方面亟待提高。
本试验中以锦鲤为研究对象,在实验室前期预试验的基础上,设计合理水平的棉子糖进行饲料添加,并评价其对锦鲤肠道健康、非特异免疫、生长性能及观赏品质的影响,以期为棉子糖在锦鲤饲料中的合理应用提供科学依据。
1 材料与方法
1.1 材料
试验用锦鲤由北京贤雅聚悦生态农业园提供,镜检无寄生虫、摄食正常、游动活泼。在实验室循环水族系统中饲养,以商品饲料驯化2周后用于养殖试验。
1.2 方法
1.2.1 试验饲料的制备 以鱼粉、豆粕、菜粕、谷朊粉为主要蛋白源,以大豆油为脂肪源,添加不同比例的棉子糖配制试验饲料。基础饲料原料组分为:豆粕30%、面粉20%、菜粕15%、鱼粉15%、谷朊粉5.4%、大豆油3%、预混料1.3%、氧化胆碱0.3%和玉米粉10%。其中,每千克预混料(mg/kg饲料)含VA 20、VB110、VB215、VB615、VB128、烟酸胺100、泛酸钙40、生物素2、肌醇200、叶酸10、VE 400、VK320、VD 310、硫酸亚铁FeSO4·7H2O 981.2、硫酸锌ZnSO4·7H2O 320.7、硫酸锰MnSO4·H2O 80、碘化钾KI 80、亚硒酸钠Na2SeO3(10%) 67、氯化钴CoCl2· 6H2O 0.5、氯化钠NaCl 100、硫酸镁MgSO42 000、磷酸二氢钙 Ca(H2PO4)25 000、糊精 3 520.6。试验用原料鱼粉、豆粕、谷朊粉等均由北京三友创美饲料科技有限公司提供。
在基础饲料中分别添加质量分数为0%(CK组)、0.06%(T1组)、0.10%(T2组) 的棉子糖,用玉米粉调平,配制成等氮(5.2%)、等脂肪(6.0%)的3组试验饲料。试验用棉子糖由北京中唐瑞德生物技术有限公司提供,其对一般大宗养殖淡水鱼类的棉子糖推荐添加量为0.06%,而对鲟、鲑鳟类等冷水鱼类的推荐添加量为0.10%。目前,由于针对食用鱼的推荐剂量未考虑到观赏鱼对观赏品质的特殊要求,且本试验为棉子糖在观赏鱼上的首次应用,故设计0.06%、0.10%两个添加量进行试验。
将所有饲料原料粉碎后过0.246 mm筛,各原料充分混合均匀后,用饲料膨化机(MY56X2A, 牧羊集团,江苏)制成粒径为2.0 mm的膨化饲料,阴干后用双层塑料袋包装后贮存于4 ℃冰箱中保存备用。试验饲料的组成及营养水平见表1。
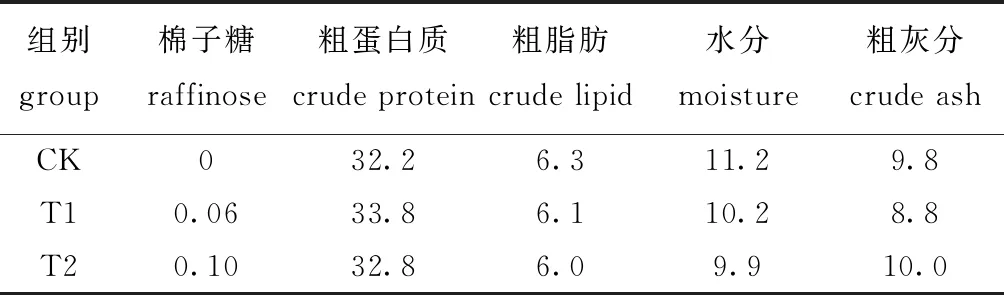
表1 试验饲料成分及营养组成
1.2.2 试验设计及饲养管理 将暂养的试验鱼停食饥饿24 h后,选取初始体质量为(42.34±0.52)g的锦鲤270尾,随机分成CK(对照组)、T1、T2共3组,每组设3个重复,每个重复30尾鱼。
试验地点为北京贤雅聚悦生态农业园。试验开始时,随机分配试验鱼至9个串联的循环过滤养殖池(2.0 m×1.2 m×1.5 m水泥池)中,每个池中放入30尾试验鱼,每个过滤的养殖池平均贮水3 m3,养殖池设有上、下2个出水口和1个进水口,并设有曝气装置,24 h充氧曝气。养殖池采用自然光照射,光照充足。
试验鱼每天投喂4次(8:00、11:00、14:00和17:00),每种配合饲料投喂3个养殖池。每次投喂量以15 min内摄食完毕、饱食无剩料为原则,并统计投喂饲料量。投喂试验持续70 d。试验期间,每2周调换养殖池,并称取试验鱼体质量,同时进行水体溶氧、氨氮、pH、亚硝酸盐等水质指标测定。试验期间,养殖池水温为(22.33±1.35)℃,溶氧为(8.83±0.58)mg/L,pH为8.26±0.08,氨氮为(0.05±0.01)mg/L,亚硝酸盐为(0.004±0.001)mg/L。
1.2.3 样品采集及指标测定
1) 生长性能指标的测定与计算。饲喂试验结束后停食24 h,对每组试验鱼计数并用500 mg/L三氯叔丁醇进行麻醉,逐尾称重、测量体长,并计算存活率(SR)、增重率(WGR)、特定生长率(SGR)、饲料系数(FCR)、摄食率(FR)等指标,各生长指标计算公式为
SR=nt/n0×100%,
WGR=(Wt-W0)/W0×100%,
SGR=(lnWt-lnW0)/t×100%,
FCR=F/(Wt+Wd-W0)×100%,
FR=2F/[(W0+Wt+Wd)/t]×100%。
其中:nt、n0分别为试验终末和试验初始鱼的数量(ind.);Wt、W0分别为试验终末和试验初始鱼体总质量(g);Wd为死亡鱼体总质量(g);t为试验时间(d);F为摄食量(g)。
2)非特异免疫指标的测定。饲喂试验结束后停食24 h,从每个处理组随机取9尾鱼,在冰盘中用2 mL无菌注射器从试验鱼尾静脉采集血液并置于真空采血管中,获得的静脉血于4 ℃下以4 000 r/min离心10 min,获得的血清保存于-80 ℃超低温冰箱中,用于超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)、补体C3、髓过氧化物酶(MPO)、溶菌酶(LZM)、 谷胱甘肽(GSH)和谷胱甘肽过氧化物酶(GSH-Px)等指标的检测。
3) 观赏性指标的测定。饲喂试验结束后停食24 h,对每尾试验鱼进行麻醉,逐条测量并计算鱼体表亮度和肥满度(CF)。体表亮度的测定参考冷向军等[11]的方法,先用吸水纸将鱼体表面的水分吸干,再将分光测色仪(CM-600D,美能达)探头紧贴鱼体侧最宽处侧线以上,测量鱼体表亮度(L*)。
饲喂试验结束后停食24 h,从每个处理组随机取9尾鱼,用于全鱼脂肪和蛋白质含量的测定。
解剖采集血液后的样品鱼,剪开每尾样品鱼的腹腔,取出肝脏组织称重并计算脏体指数(VSI)。计算公式为
CF=W/L3×100,
VSI=WI/W×100%。
其中:WI为内脏质量(g);W为鱼体质量(g);L为鱼体长(cm)。
1.2.4 肠道形态及结构观察 解剖采集血液后的样品鱼,取出肠组织,在其固定位置切取0.5 cm×0.5 cm肠道2块,用生理盐水冲洗黏膜表面,经0.1 mol/L磷酸缓冲液(pH 7.4)清洗3~4次,立即置于2.5%戊二醛溶液中固定12 h,用梯度酒精脱水,乙酸异戊酯置换,二氧化碳临界点干燥,喷金后于扫描电子显微镜(HITACHI S-4800型)下观察并拍照。
另制作透射电镜切片,对皱褶高度和宽度,以及微绒毛高度和密度进行测量。
1.2.5 肠道微生物菌群 解剖采集血液后的样品鱼,取全肠及内容物置于自封袋内,保存于-80 ℃下用于肠道微生物菌群的检测。之后将保存的肠道样本混匀后取0.2 mg,用Bacterial DNA Kit 试剂盒(Omega, 美国)提取肠道细菌总DNA。以提取的肠道微生物基因组DNA为模板,16S rRNA V3-V4区特异性引物(B341F:5′CCTACGGGNGGCWGCAG 3′; B785R:5′GACTACHVGGGTATCTAATCC 3′)扩增序列[11]。PCR反应体系(共25 μL):DNA模板2.5 μL,2×KAPA HiFi HotStart Ready Mix 12.5 μL,上、下游引物(25 μmol/L)各0.25 μL,用ddH2O补足至25 μL。PCR反应条件:95 ℃下预变性3 min;95 ℃下循环变性30 s,50 ℃下退火复性30 s,72 ℃下延伸60 s,共进行30个循环;最后在72 ℃下再延伸7 min。
扩增产物用15 g/L琼脂糖凝胶电泳检测,取电泳图谱条带为400~450 bp的样品进行胶回收。委托北京源宜基因科技股份有限公司进行基于Illumina MiSeq技术测序平台构建文库,进行高通量双末端测序。
Illumina MiSeq测序所得原始序列用FLASH软件拼接,之后用QIIME软件过滤拼接后的序列,并将过滤后的片段与NCBI数据库进行比对,并使用USEARCH 软件对数据进行去嵌合体和聚类的操作,将有效序列按序列相似度97%聚类成分类单元(Operational taxonomic units,OUT)。使用RDP 分类器注释分类信息,分类基于Bergey’s taxonomy,共分为6 级,依次为界(kingdom)、门(phylum)、纲(class)、目(order)、科(family)、属(genus),默认阈值为80%,低于此值则为unclassified。
最后使用QIIME软件, 做Alpha 多样性指数的稀释曲线, 分别利用Shannon指数和Simpson指数公式计算细菌生态多样性指数。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 22.0软件进行单因素(One-way ANOVA)方差分析,采用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 棉子糖对锦鲤肠道形态结构的影响
本试验中对3种试验饲料投喂的锦鲤肠道进行了扫描电镜观察。从图1可见:对照组的肠壁皱褶较为平整,凹凸丰富度小于T1、T2组,T1组肠壁皱褶凹凸丰富、内部非常光滑,T2组肠壁皱褶凹凸丰富,内部较为光滑,其光滑程度介于对照组与T1组之间;对照组的肠壁皱褶间食糜颗粒较多,微绒毛上黏附着大量的食糜颗粒直至皱褶内部,且有明显的条状黏滞性物质,几乎覆盖了皱褶内部,而试验组皱襞间食糜颗粒较对照组小,数量少,无条带状黏滞性物质;T1组肠壁皱褶间食糜颗粒较少,食糜颗粒以微小残留为主,内部皱褶凹陷处无大的异物残留,肠黏膜上皮细胞微绒毛上黏附的食糜颗粒较少;T2组皱褶间食糜颗粒较少,且较小,内部皱褶凹陷处有少量较大的食糜颗粒,肠黏膜上皮细胞微绒毛上黏附食糜颗粒较少、较小。
2.2 棉子糖对锦鲤肠道显微结构指标的影响
由表2可知,试验鱼肠道的皱褶高度、宽度和微绒毛高度在3个处理组间无显著性差异(P>0.05),但3组间的肠道微绒毛密度存在显著性差异(P<0.05),T1、T2组的微绒毛密度均显著高于对照组(P<0.05),但此两组间无显著性差异(P>0.05)。

表2 饲料棉子糖水平对锦鲤肠道皱褶和微绒毛的影响
2.3 棉子糖对锦鲤肠道细菌菌群多样性的影响
根据OTUs代表序列与数据库注释文件对比,在97%(种)水平上进行OTUs划分,覆盖率(good’s coverage)指数反映了测序的深度,指数均在0.999 以上(表3), 说明测序深度已经基本覆盖到样品中所有的物种。对3组试验鱼的肠道微生物多样性进行评价,结果发现,T1、T2组的Shannon指数显著高于对照组(P=0.042),但T1、T2组的Simpson指数则显著低于对照组(P=0.017)(表3)。这说明饲料中棉子糖的添加有效提高了锦鲤肠道微生物多样性。

表3 饲料棉子糖水平对锦鲤肠道细菌多样性的影响Tab.3 Intestinal bacterial diversity of koi carp Cyprinus carpio var.koi fed the diets containing different contents of raffinose
2.4 棉子糖对锦鲤免疫性能和抗氧化能力的影响
从表4可见,饲料中添加棉子糖对锦鲤血清补体C3、LZM、MPO、MDA、GSH、GSH-Px和CAT水平均无显著性影响(P>0.05),但T1、T2组的SOD水平则显著高于对照组(P<0.05),而此两组间无显著性差异(P>0.05)。
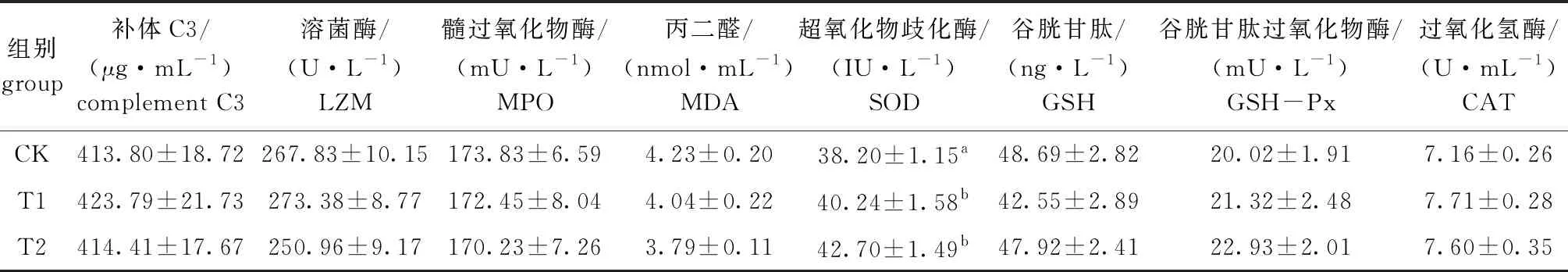
表4 饲料棉子糖水平对锦鲤免疫及抗氧化指标的影响
2.5 棉子糖对锦鲤鱼生长性能与观赏品质的影响
从表5可见:经3种饲料饲喂70 d后,3组锦鲤的存活率均在93%以上,且组间无显著性差异(P>0.05);T1、T2组锦鲤的增重率、特定生长率均显著高于对照组(P<0.05),T1组的饲料系数显著低于对照组(P<0.05),T2组则与对照组无显著性差异(P>0.05);3种试验饲料对锦鲤的摄食率、全鱼蛋白质含量无显著性影响(P>0.05);T1、T2组的全鱼脂肪含量显著低于对照组(P<0.05)。进一步比较试验组的生长性能发现, T1组的锦鲤增重率、特定生长率显著高于T2组(P<0.05),饲料系数显著低于T2组(P<0.05)。
锦鲤的体表色泽与体型是其重要的观赏品质。本研究中以体表亮度L*值表征体表光泽,以肥满度、脏体指数、全鱼脂肪含量分别表征其体型。从表5可见:3组试验饲料对锦鲤的体表亮度L*值和全鱼脂肪含量有显著性影响(P<0.05),对脏体指数和肥满度无显著性影响(P>0.05);L*值在T1组最高,T2组最低,且T1组的L*值显著高于T2组(P<0.05),但与对照组无显著性差异(P>0.05);各组全鱼脂肪含量为CK>T1>T2,其中,T1、T2组的全鱼脂肪含量显著低于对照组(P<0.05),T1、T2组间无显著性差异(P>0.05)。
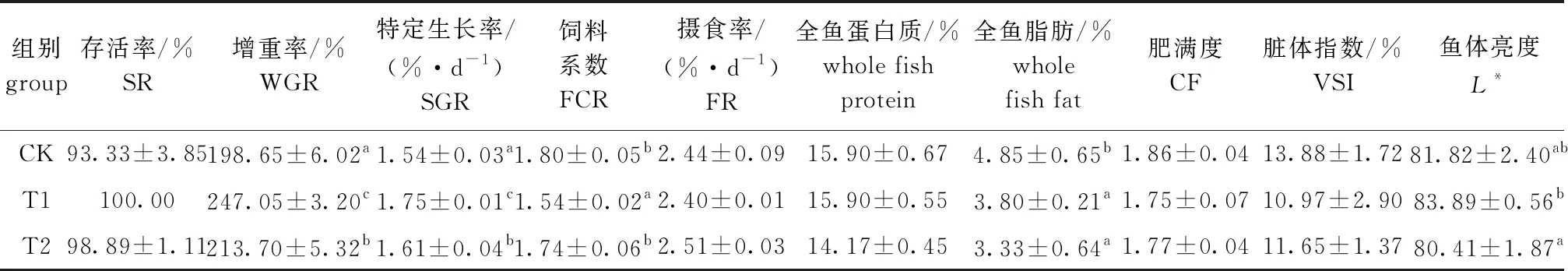
表5 饲料棉子糖水平对锦鲤生长性能与观赏品质的影响(70 d)
3 讨论
3.1 棉子糖的肠道屏障保护作用与锦鲤健康
肠道是动物机体与外界环境密切接触的部分,同时又是部分肠免疫细胞发育分化的微环境。因此,肠道除了作为消化吸收的重要场所外,也发挥着机体免疫防御与免疫耐受的重要作用。正常的肠黏膜是通过机械屏障、免疫屏障及微生态屏障共同维持肠道微生态平衡,抵御病原菌的入侵[12]。因此,医学上认为,肠道屏障功能的改变与代谢类、消化类、免疫类等多种疾病的发生密切相关。棉子糖作为一种益生元,在进入动物消化道后不被消化道前段酶消化,而选择性地刺激消化道后端的有益菌生长及其活性,比如被寄生于该区域的双歧杆菌、乳酸杆菌等选择性作为营养基质,进而促使有益菌群大量繁殖、菌群多样性增加,有利于维护肠道微生态环境的平衡[13]。
本试验中,锦鲤血清的补体C3、LZM、MPO、MDA等非特异免疫指标与对照组无显著性差异,这与以往研究中棉子糖具有免疫促进功能的结论不同。葛红云等[2]发现,虽然棉子糖对花鲈非特异免疫指标无显著性影响,但以嗜水气单胞菌攻击花鲈时,棉子糖能显著提高花鲈存活率。这可能是因为在基础饲料和饲养条件均满足供试鱼生长需求的条件下,鱼类机体处于免疫稳态,只有在受病原菌攻击时,棉子糖对机体的免疫促进作用才能体现出来。这意味着棉子糖对动物机体的免疫促进作用可能是通过提高抗应激能力实现的。
另外,在本试验饲料中添加棉子糖后,锦鲤血清SOD水平显著高于对照组,同时,肠道细菌多样性显著增加,证实了棉子糖对锦鲤肠道免疫屏障与微生态屏障的保护作用。这将进一步增加棉子糖保护水生动物肠道免疫屏障的科学依据,也为鱼类疾病防控提供新的思路。
3.2 棉子糖的肠道营养作用与锦鲤的消化吸收、生长性能
锦鲤属于无胃鱼,肠道是其消化吸收的主要场所,因而其肠道发育及肠内环境状况决定着对营养物质的消化与吸收利用程度。棉子糖等非消化寡糖对肠道具有多种作用与功能,其发酵时可以产生短链脂肪酸[14],短链脂肪酸是肠道黏膜代谢的主要能源,对促进肠黏膜细胞增殖具有重要作用[15],易中华等[16]证实,棉子糖等非消化寡糖能直接影响动物肠道黏膜的结构和功能。在对草鱼[17]和尼罗罗非鱼[18]的研究中也有寡糖可以促进鱼类肠道微绒毛增长的报道。肠道微绒毛表面分泌有双糖酶和多肽酶,能催化碳水化合物和蛋白质的代谢[19],是动物营养代谢的重要场所。因此,肠道微绒毛的增加意味着鱼类肠道吸收面积增加,有利于其对营养物质的吸收。本试验中电镜观察显示,在饲料中添加棉子糖后,锦鲤的肠微绒毛密度显著增加,且肠壁皱褶间食糜颗粒比对照组少,内部皱褶凹陷处无大的异物残留,食糜颗粒以微小残留为主,这说明棉子糖促进了锦鲤对饲料物质的消化吸收。
本试验中选择的棉子糖属于功能性低聚糖,除具有改善动物肠道和消化功能外,以往报道还认为其具有促生长作用。邱燕等[17]报道,在鱼用的基础饲料中添加质量分数为0.001 2%的棉子糖,草鱼特定生长率提高27.40%。本试验中,棉子糖的添加显著提高了锦鲤的增重率和特定生长率,再次证实了棉子糖对水生动物的促生长作用。但该作用是促进摄食还是促进对有限营养物质的最大化利用,至今尚无报道。本研究中将基础饲料对照组及分别添加0.06%和0.10%棉子糖的饲料组进行比较后,未发现在锦鲤摄食率上的显著性差异。这说明棉子糖可能并无促进摄食的作用,而是通过促进对有限营养物质的最大化利用促进锦鲤生长。
棉子糖具有抗营养作用,在肠道中经菌群发酵会产生大量气体,能引发消化不良、腹泻等,故棉子糖的促生长作用是有限的,其添加比例在适宜范围内会促进鱼类生长,添加过量则影响鱼类摄食和生长[7, 20]。葛红云等[2]研究报道,花鲈饲料中添加棉子糖的适宜比例是0.000 8%~0.002%(质量分数)。本研究中棉子糖的添加量为0.10%时仍能显著提高锦鲤生长性能,远高于葛红云等[2]报道的添加量限值0.002%。这可能是饲料中添加棉子糖的适宜范围值因鱼的食性不同而有所差异。
3.3 棉子糖的代谢调节作用与锦鲤观赏品质
本课题组前期研究国内外观赏鱼饲料品质时发现,与日本产观赏鱼相比,国产观赏鱼饲料养殖的锦鲤具有体表色泽不够鲜艳、色泽持久性差、鱼体肌肉不够紧实、鱼腹脂肪堆积等特点,这降低了锦鲤观赏价值。因此,若提升国产观赏鱼饲料的国际竞争力,就必须重视其塑形、增色等功能性效果。
腹部脂肪堆积在医学上被称为腹型肥胖或向心性肥胖,通常被认为与肠道微生物菌群的紊乱有关[21]。已有报道显示,某些特定来源或结构的低聚糖及多糖通过调控菌群相关机制能控制肥胖的发生和发展[22-23]。本研究中,饲料中添加0.06%和0.10%的棉子糖后,肠道菌群的Shannon指数从对照组的0.39分别提高至0.85和1.01,而全鱼脂肪含量分别下降了21.65%和31.34%,脂肪沉积得以改善。说明棉子糖对锦鲤的脂肪沉积、肠道微生物菌群多样性等均有较明显的改善作用,故推测棉子糖可能通过调节部分肠道菌群、保护肠道屏障来发挥干预脂肪代谢的功效。通常认为,鱼类体内脂肪代谢与其体表色泽相关[24]。本试验结果显示,在基础饲料中添加0.06%棉子糖时,锦鲤体表皮肤亮度L*值与对照组无显著性差异,并未引起色泽下降的问题。
综合考虑脏体指数、肥满度及全鱼脂肪等体型相关指标和体色亮度指标及生产实践中饲料配制的性价比,饲料中添加0.06%的棉子糖后,锦鲤的观赏品质优于基础饲料组,这表明棉子糖具有作为增色、塑形功能性饲料添加剂研究和开发的潜力。
4 结论
1)饲料中添加棉子糖后锦鲤增重率、特定生长率显著提高,说明棉子糖能促进锦鲤生长。
2)饲料中添加棉子糖后全鱼脂肪显著降低,锦鲤体表L*值显著上升,说明棉子糖能提升锦鲤形体和体色亮度等指标,从而提升锦鲤观赏品质。
3)饲料中添加棉子糖后,锦鲤血清SOD水平显著提高;肠道微绒毛密度更高,微生物多样性增加,且肠道微绒毛表面及肠道皱褶内的食糜颗粒更少、更小,说明棉子糖能改善锦鲤非特异性免疫、促进锦鲤肠道健康。
