红紫芽茶花青素合成关键酶活性与重要酚类物质相关性研究
2020-12-15曹冰冰王秋霜秦丹丹傅冬和方开星姜晓辉李红建王青潘晨东李波吴华玲
曹冰冰,王秋霜,秦丹丹,傅冬和,方开星,姜晓辉,李红建,王青,潘晨东,李波,吴华玲
红紫芽茶花青素合成关键酶活性与重要酚类物质相关性研究
曹冰冰1,2,王秋霜1*,秦丹丹1,傅冬和2,方开星1,姜晓辉1,李红建1,王青1,潘晨东1,李波1,吴华玲1*
1. 广东省农业科学院茶叶研究所,广东省茶树资源创新利用重点实验室,广东 广州 510640;2. 湖南农业大学,湖南 长沙 410128
以广东的红叶1号、红叶2号、丹妃和云南紫娟4种红紫芽品种(系)为供试材料,以英红九号绿芽品种为对照,通过分析酶活性研究了红紫芽茶花青素合成关键酶活性变化规律,并揭示了其与花青素、茶多酚、儿茶素组分等重要酚类物质含量的相互关系。结果表明,红紫芽茶花青素合成过程中,同一季节不同品种(系)类黄酮-3--糖基转移酶(UFGT)活性与茶多酚总量和花青素含量均显著正相关,为花青素合成的关键酶;而苯丙氨酸解氨酶(PAL)、查尔酮合成酶(CHS)、类黄酮-3-羟化酶(F3H)、二氢黄酮醇-4-还原酶(DFR)、黄酮醇合成酶(FLS)、花青素合成酶(ANS)和花青素还原酶(ANR)等活性能力与花青素含量变化趋势不存在密切的相关性;春季各样品儿茶素(C)含量与PAL酶活性显著正相关,表儿茶素没食子酸酯(ECG)含量与DFR酶活性存在显著正相关;同一季节不同品种(系)CHS、F3H、ANS以及ANR酶活性与酚类物质含量无显著相关性。
红紫芽茶;花青素;酶;多酚
花青素作为自然界中植物色素的重要组成部分,不仅赋予了植物的观赏价值,良好的保健功效使其在医药和食品行业得到了广泛的应用[1-2]。茶树作为多年生常绿叶用植物,其鲜叶内的花青素含量较少,一般占干物重的0.01%左右,因其单体的不稳定性,常与葡萄糖、半乳糖、鼠李糖等缩合成苷类物质,形成花青苷,其中较为重要的组分包括飞燕草花青素及其苷、芙蓉花青素及其苷、翘摇紫苷元(又称三策啶)[3]。红紫芽茶树是从自然变异群体选育出的性状稳定、全年新梢呈紫色或紫红色的一种特异茶树资源,其花青素含量都在1%以上,很多研究证实茶树芽叶紫化程度与花青素含量呈极显著的正相关性[4]。由于味觉上花青素呈现出苦味,因此红紫芽茶树鲜叶制作的成品茶叶一般滋味苦涩、叶底发暗、品质不佳[5]。然而,由于近年来研究发现红紫芽茶具有良好的保健功效和应用前景,这种特异类型茶树资源受到了国内外学者的广泛关注。
花青素属于酚类物质中的一大类,其合成途径是类黄酮代谢途径的一个支路,所涉及的酶类在拟南芥、矮牵牛、玉米等多种物种上已有深入研究。在植物体内,苯丙氨酸经由苯丙氨酸解氨酶(PAL)、查尔酮合成酶(CHS)、类黄酮-3-羟化酶(F3H)、二氢黄酮醇-4-还原酶(DFR)、花青素合成酶(ANS)等一系列关键酶的酶促反应生成花青素,最后经花青素糖基转移酶(GT)和花青素酰基转移酶(AT)等关键酶的糖基化、酰基化等修饰作用形成稳定的花青苷[6-7]。茶树中花青素作为酚类物质的一个重要组成部分,其合成途径已被探明(图1),花青苷既是茶树类黄酮合成途径某一分支的最终产物,也有部分作为中间产物,合成儿茶素类物质以及黄酮苷等[8]。为了研究红紫芽茶树高花青素的形成机理,国内外学者目前进行了大量的研究,基因方面主要开展了合成关键酶和调控基因的克隆与表达[9-14]以及外界环境因素对其表达的影响等研究[15-16];生物学特性[17]和生化组分方面则在花青素组成及含量[18-20]、分离纯化工艺[21-25]、抗病活性[26]等方面做了探讨。但是,对于花青素合成过程中主要酶类活性和花青素、儿茶素等茶叶重要酚类物质的变化趋势,以及二者之间的相关性研究较为鲜见。因此,本文以自主选育出的红叶系列(红叶1号、红叶2号)、紫芽品种(丹妃)和云南的紫娟4个不同品种(系)为供试材料,研究不同阶段红紫芽茶花青素合成中主要酶类活性和酚类物质的变化规律,并对二者的相互关系进行了初步探讨,为进一步解析红紫芽茶树花青素形成机理提供科学依据和理论基础。
1 材料与方法
1.1 材料与试剂
以红紫芽品种(系)红叶1号、红叶2号、丹妃、紫娟为供试材料,以绿芽品种英红九号为对照,上述样品均来源于广东省茶树资源库(广东省农业科学院茶叶研究所坑口咀茶叶基地)。分别于2016年的9月(秋茶)、2017年4月(春茶)、7月(夏茶)3个季节采摘嫩梢一芽二叶。样品采集放入液氮速冻后转入–80℃冰箱冷冻保存,用于酶活性和鲜叶理化分析。

注:Phenylalanine:苯丙氨酸;Naringenin chalcone:柚皮素查尔酮;Leucocyanidin:无色花青素;Catechin or epicatechin:儿茶素或没食子儿茶素;Eriodictyol:圣草酚;Dihydrokaempferol:二氢山柰素;Kaempferol:山奈素;Flavonol glycosides:黄酮醇糖苷;Proanthocyanins:原花青素;Flavonoid glycosides:黄酮苷;Leuco deiphinidin:无色飞燕草色素;Gallocatechin or gallo epicatechin:儿茶素或没食子儿茶素;Gallic acid:没食子酸;β-Glucogallin:β-没食子酸葡萄糖;Epigallocatechin-3-gallate:没食子儿茶素-3-葡萄糖;Naringenin:柑橘素;Pentahydroxy flavanone:五羟基黄烷酮;Dihydro quercetin:二氢槲皮素;Dihydro myricetia:二氢杨梅素;Cyanidin:矢车菊素;Quercetin:槲皮素;Myricetia:杨梅素;Deiphinidin:飞燕草色素;Anthocyanins:花青苷;PAL:苯丙氨酸解氨酶;C4H:肉桂酸羟化酶;4CL:对香豆酰CoA连接酶;CHI:查尔酮异构酶;CHS:查尔酮合成酶;F3H:黄烷酮-3-羟化酶;F3'H:黄烷酮-3'-羟化酶;ANR:花青素还原酶;F3'5'H:黄烷酮-3',5'-羟化酶;DFR:二羟基黄酮醇还原酶;FLS:黄酮醇合成酶;ANS:花色素合成酶;UFGT:黄酮-3-O-糖基转移酶

图2 试验样品
试验试剂主要包括:85%的磷酸、酒石酸亚铁、茚三酮、蒽酮、交联聚乙烯吡咯烷酮(PVPP)、苯甲基磺酰氟(PMSF)、考马斯亮蓝、-巯基乙醇、牛血清蛋白、抗坏血酸、Tris-base、亮抑蛋白酶肽(Leupeptin),均为分析纯;表儿茶素(Epicatechin,EC)、儿茶素(Catechin,C)、表没食子儿茶素(Epigallatecatechin,EGC)、表儿茶素没食子酸酯(Epicatechin gallate,ECG)、表没食子儿茶素没食子酸酯(Epigallatecatechin gallate,EGCG)、儿茶素没食子酸酯(Catechingallate,CG)、没食子儿茶素没食子酸酯(Gallate catechingallate,GCG)和没食子儿茶素(Gallate catechin,GC),均为标准品,购于Sigma公司;酶联免疫吸附试剂盒(ELISA KIT)购于上海酶联生物科技有限公司。
1.2 仪器与设备
722S型可见分光光度仪(上海精密科学仪器有限公司);5417型冷冻式离心机(德国艾本德有限公司);1500型全波长酶标仪(赛默飞世尔科技有限公司);1200型安捷伦液相色谱(美国安捷伦科技有限公司);55-4型冷冻干燥机(Scanlaf公司)。
1.3 试验方法
1.3.1 酶含量及酶活性测定[27]
粗酶液的制备:称取茶鲜叶1~3 g,加入少量石英砂和等量的PVPP,在液氮中研磨至粉状,分装到预冷的离心管中,取其中1管加入预冷的酶提取缓冲液,振荡涡旋混匀,4℃、12 000 r·min-1离心,取上清液移至新离心管中冰浴,用于酶的含量测定和酶活性分析。
酶提取缓冲液:50 mmol·L-1Tris-HCI(pH=8.9)、10 μmol·L-1亮抑蛋白酶肽、5 mmol·L-1EDTA、15 mmol·L-1-巯基乙醇、5 mmol·L-1Vc、1 mmol·L-1PMSF、0.15%(∶)的PVPP。
酶含量测定:采用Bardford法测定。在3组微量离心管中分别加入0.1 mg·mL-1的标准牛血清白蛋白(BSA溶液)0、30、60、90、120 μL和150 μL,用酶提取缓冲液将其稀释到1 000 μL,加入500 μL考马斯亮蓝蛋白试剂后振荡混匀,室温放置2 min,利用全波长酶标仪在波长595 nm测定吸光度值,以吸光度为纵坐标,以牛血清白蛋白含量(μg)为横坐标,绘制出标准曲线。取酶粗提液样品10 μL,按照上述方法测定595 nm吸光度,根据上述标准曲线,计算出酶粗提液样品中所含的蛋白质浓度。
酶活性分析:采用ELISA试剂盒测定酶活性。利用酶提取缓冲液将粗酶液浓度稀释为1 μg·μL-1,置于冰浴上,用于酶的活性分析,测定步骤如下:从室温平衡20 min后的铝箔袋中取出所需板条,剩余板条用自封袋密封放回4℃;设置标准品孔和样本孔,标准品孔加入不同浓度的标准品50 μL;待测样本孔先加入待测样本10 μL,再加入样本稀释液40 μL;随后标准品孔和样本孔中分别加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,用封板膜封住反应孔,37℃水浴锅或恒温箱温育60 min;弃去液体,于吸水纸上拍干,每孔加满洗涤液,静置1 min去除洗涤液,于吸水纸上拍干,如此重复洗板5次;每孔加入底物A、B各50 μL,37℃避光孵育15 min;每孔加入终止液50 μL,15 min内,在450 nm波长完成样品的吸光度测定和标准曲线绘制。根据所得标准曲线,计算出样品的酶活性(U·mL-1)。
1.3.2 花青素含量的测定[28]
准确称取1.0 g茶叶磨碎干样,沸水浸提,过滤,定容至50 mL作为供试液。吸取2 mL供试液加入8 mL酸性乙醇,显色30 min,离心后在535 nm下比色测定。
1.3.3 茶多酚及儿茶素含量测定[28]
茶多酚含量的测定采用比色法;儿茶素含量的测定采用HPLC分析法,色谱柱为安捷伦C18色谱柱(150 mm×4.6 mm);流动相A相:0.05%的磷酸水;B相:乙腈;梯度洗脱,检测时长为45 min,流速为1 mL·min-1,进样量为10 μL,检测波长为278 nm,柱温35℃。
1.3.4 茶树鲜叶中含水量的测定[28]
称取5.0 g茶树鲜叶样品,置于120℃烘箱内烘干2 h,测定烘干前后的质量差,计算含水量(%),用于换算花青素及其儿茶素等物质的含量。
1.4 数据处理
2 结果与分析
2.1 不同季节花青素含量和酚类物质含量分析
茶树鲜叶中花青素含量因季节和品种不同存在显著差异。由图3可知,春夏秋三季绿芽对照组花青素含量均极显著低于供试组样品。红叶1号、红叶2号的花青素含量春季最低,夏秋季显著高于春季;而丹妃花青素含量趋势为春季含量最高,夏秋显著减少,与前期研究结果一致[4]。紫娟鲜叶中花青素含量在夏季最高,秋季次之,春季最低。红紫芽品种(系)春夏秋三季花青素含量分别是对照的10.28~23.64倍、6.79~10.88倍和11.07~23.40倍。这与红紫芽品系芽叶外观呈红紫色,而绿芽品种芽叶呈绿色的表型一致[17]。
不同季节茶树鲜叶中茶多酚含量如图4所示。春夏秋三季对照组和供试组茶多酚含量存在显著性差异,其中红叶1号、红叶2号、丹妃中茶多酚含量显著高于对照。总体来说,茶树鲜叶中茶多酚含量相对较高,达到干重的30%以上,除紫娟外,同一品种不同季节茶多酚的变化规律与花青素的变化趋势基本一致。
儿茶素组分及含量测定结果如表1所示。所有样品中EC、C、GC、CG含量均较低,酯型儿茶素EGCG含量最高,EGC次之。研究表明,红紫芽茶鲜叶中酯型儿茶素含量高于普通绿芽茶树鲜叶[11],但本研究中的规律并不明显。红叶1号(4.27%)、红叶2号(4.75%)的ECG的含量大于对照(3.58%),且存在显著性差异;紫娟(2.47%)和丹妃(2.08%)低于对照。紫娟中EGC含量春夏两季显著高于对照;红叶1号、红叶2号及丹妃含量则显著低于对照组(红叶2号的春季样品除外)。丹妃和紫娟鲜叶中C和CG含量低于其他儿茶素组分,其中丹妃在春夏秋三季C的平均含量只有0.28%。不同品种中EGCG含量有所差别,在平均含量上对照组绿芽种鲜叶中C、EC、GC及GCG含量高于供试组样品;在儿茶素总量上,对照绿芽种显著高于供试组,与前期研究结论一致[13]。本研究中供试组样品的儿茶素总量低于对照,可能有两方面原因:一是儿茶素和花青素共用一条合成途径,有此消彼长的关系,相同条件下紫芽茶的花青素含量高则儿茶素含量较低[14];二是对照种英红九号为大叶种茶树,自身具有较高的儿茶素含量。

表1 不同品种茶树在不同季节鲜叶的儿茶素组分及含量
注:*表示供试组与对照同一季节样品存在显著差异(<0.05)
Note: * indicates that there is significant difference between test group and control in the same season (<0.05)
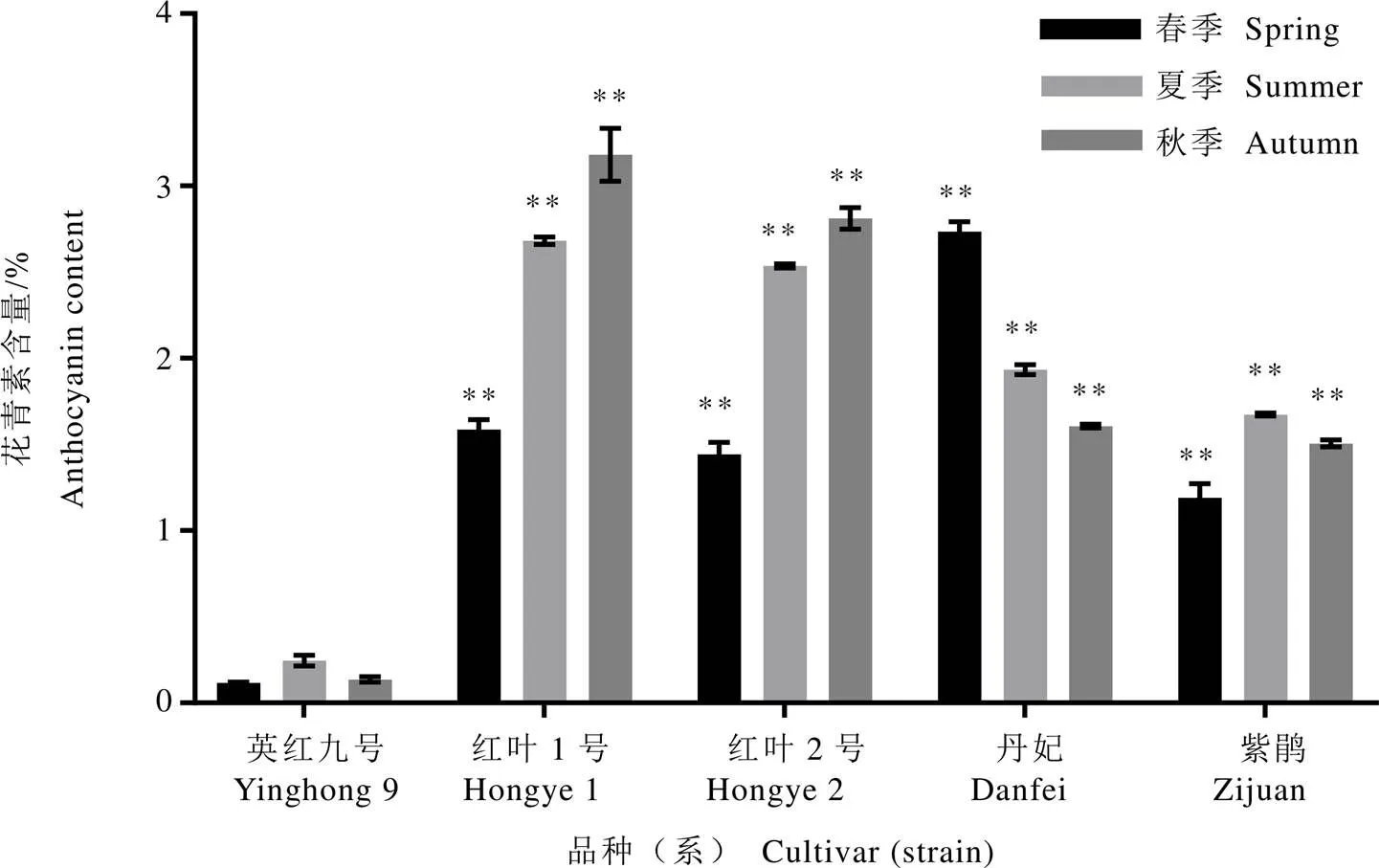
注:**表示供试组与对照同一季节样品存在极显著差异(P<0.01)

注:*表示供试组与对照同一季节样品存在显著差异(P<0.05)
2.2 花青素合成代谢关键酶的活性测定
PAL是苯丙烷代谢途径第一个催化酶,催化苯丙氨酸形成肉桂酸进入次级代谢(图1)。本研究分析了不同季节红紫芽茶树鲜叶中的PAL酶活性(图5)。结果表明,与其他花青素合成代谢的关键酶相比,PAL酶活性最低。整体来看,夏季PAL活性最低(平均酶活力10 mU·mL-1),除丹妃外,其他3个供试组红紫芽品种(系)显著高于对照;春季丹妃和紫娟样品PAL活性显著低于对照;大部分样品秋季PAL活性高于其他季节,平均酶活力约60 mU·mL-1。
CHS催化形成了茶树花青素合成途径中的第一个中间产物查儿酮(图1)。由图6-A可知,CHS在茶树体内的活性相对较高(167~363 mU·mL-1),供试组夏季活性最高(254~362 mU·mL-1),春季和秋季较低,尤其是紫娟,夏季的酶活性最高。红叶1号、丹妃及紫娟夏季CHS酶活力均显著高于对照。
F3H和DFR的酶活在3个季节的变化趋势相反(图6-B、图6-C),F3H一般在秋季的活性最高,春季最低;而DFR在春季活性最高,秋季最低;且前者的酶活性相对较大。春季红紫芽茶鲜叶F3H活性与对照差异不显著;夏季大部分红紫芽茶鲜叶F3H活性显著低于对照,而紫娟显著高于对照,可能与紫娟夏季鲜叶中高EGC含量有关;秋季F3H活性红叶1号显著高于对照,丹妃显著低于对照,其他样品与对照差异不显著。
与绿芽品种英红九号相比,不同季节不同红紫芽品种(系)的DFR酶活性差异较大(图6-C):春季红叶1号、红叶2号酶活显著高于对照,而紫娟DFR酶活显著低于对照,丹妃与对照无显著差异;夏季红叶1号、红叶2号、紫娟DFR酶活显著高于对照,丹妃与对照种无显著差异;秋季紫娟DFR酶活显著高于对照,而红叶2号显著低于对照,红叶1号和丹妃与对照无显著差异。
ANS是将无色花青素转化为有色花青素的关键酶,不同季节ANS酶活力变化如图6-D所示。由图6可知,ANS酶活力远远高于本试验中的其他酶活力,整体酶活力范围在300~400 mU·mL-1,且在不同季节较稳定,不同茶树品种每个季节变化趋势不同。春季,红叶1号、红叶2号、丹妃的ANS酶活力显著低于对照;夏季,红叶1号、紫娟ANS酶活力显著高于对照,而红叶2号显著低于对照;秋季,丹妃ANS酶活力显著高于对照。

注:*表示供试组与对照同一季节样品存在显著差异, P<0.05。下同

注:A:查尔酮合成酶;B:类黄酮-3-羟化酶;C:二氢黄酮醇-4-还原酶;D:花青素合成酶;E:花青素还原酶;F:类黄酮-3-O-糖基转移酶
由图6-E可知,ANR整体酶活力较低,平均酶活力处于54.04~75.81 mU·mL-1。春季样品中红叶1号ANR酶活显著低于对照,其他红紫芽样品与对照差异不显著;夏季样品中红叶2号和紫娟ANR酶活显著高于对照,红叶1号和丹妃与对照差异不显著;秋季样品ANR酶活力高于其他季节,其中紫娟酶活力最高,达到86.75 mU·mL-1,显著高于对照,而其他红紫芽品种(系)与对照无显著差异。
UFGT是花青素合成代谢末端的一类酶,最常见的是类黄酮3--葡萄糖基转移酶(UFGT),它能够催化糖苷转移,使不稳定的花青素转化为稳定的花青苷。不同季节UFGT酶活力变化情况如图6-G所示。春夏秋三季供试组样品酶活度均显著高于对照组(<0.05)。除对照组外,红紫芽品种(系)UFGT的活性变化趋势一致,均呈现秋季>夏季>春季(图6-G)。
2.3 花青素合成代谢关键酶活性与重要酚类物质的相关性
各品种(系)在春、夏、秋三季花青素合成关键酶活性与花青素、茶多酚、儿茶素的相关性分析如表2所示。PAL酶活性与包括花青素在内的大部分酚类物质含量无明显的相关性,较为特殊的是红叶1号和紫娟鲜叶中C含量与PAL酶活性存在显著的相关性,前者为正相关,后者为负相关。除丹妃外,其他品种(系)鲜叶中PAL酶活力都与鲜叶中EGCG含量有正向相关性,但未达到显著水平。
CHS酶活力与对照样品英红九号的花青素含量显著正相关,相关系数达到0.999,而与红紫芽品种(系)花青素含量不存在显著相关性。红紫芽品种(系)鲜叶的EGC、ECG、GC、CG含量与CHS酶活性均呈现负相关,其中紫娟的CG含量与CHS酶活性的相关性达显著水平。丹妃的EGCG含量与CHS酶活力有正相关的趋势,但不显著,其余样品均呈负相关,其中对照样品英红九号鲜叶中EGCG含量与CHS酶活力呈显著负相关。
F3H酶活力与红叶1号、红叶2号和紫娟3个红紫芽茶鲜叶的花青素含量存在一定的正相关性,而与丹妃花青素含量呈负相关,但均不显著。丹妃鲜叶F3H酶活性与茶多酚含量显著负相关。F3H酶活力与儿茶素各组分均没有显著的相关性。
DFR酶活性与丹妃花青素含量有一定的正相关性,与其他参试样品花青素含量呈负相关,但均未达到显著水平,而与丹妃的茶多酚含量呈显著正相关。各品种(系)中DFR酶活性与儿茶素组分无明显相关性。
除紫娟外,ANS酶活性与花青素含量整体呈现负相关趋势。丹妃鲜叶中花青素和CG的含量与ANS酶浓度活性有显著的负相关关系,相关系数均为–1.000。不同季节的ANR酶活力与其他酚类物质含量无明显的相关性。
红叶1号、红叶2号茶鲜叶在春夏秋三季的UFGT活性变化与花青素含量有显著的正相关,而丹妃的UFGT活性则与其存在显著的负相关,对照英红九号和紫娟UFGT活性与其无显著正相关性。此外,丹妃和红叶2号的UFGT活性分别与CG含量和GC含量呈显著负相关。
同时,通过对同一季节的两组样品花青素合成关键酶与重要酚类物质含量的相关性分析发现(表3),春季所有样品茶多酚含量与UFGT酶活性存在显著正相关,C的含量与PAL酶活性显著正相关,ECG的含量与DFR酶活性存在显著正相关;春、夏、秋三季UFGT酶活性与所有样品鲜叶中花青素的含量都有显著的正相关性,春季UFGT酶活性与茶多酚总量显著正相关。
3 讨论与结论
茶树体内酚类物质含量受品种遗传和外界环境的双重影响[16]。本研究中,常规绿芽品种对照组和红紫芽品种(系)供试组茶多酚含量存在显著差异,但并非紫芽品种(系)茶多酚含量均大于对照;而红紫芽茶鲜叶中花青素含量极显著高于对照组,是对照品种的6.79~23.64倍,这与紫芽品种(系)芽叶呈红紫色,绿芽品种芽叶呈绿色或黄绿色的表型是一致的。花青素合成代谢关键酶活性与各儿茶素组分的显著性差异分析表明,对照组和供试组样品无一致规律性。春季不同品种(系)C含量与PAL酶活性显著正相关,ECG含量与DFR酶活性显著正相关,茶多酚总量与UFGT酶活性正相关;春夏秋三季CHS、F3H、ANS以及ANR酶活性与儿茶素组分无显著相关性。总体来说,受遗传决定因素的限制,供试组和对照组因茶树品种的差异性,导致其体内多酚类物质的合成代谢存在一定差别,因此不适于在两组之间进行比较;而对于同一茶树品种(系)来说,其体内的多酚在合成时会受到季节环境因素影响,从而导致其合成量的改变,体内的花青素含量也随之变化。

表2 不同茶树品种的花青素合成关键酶活性与酚类物质含量相关系数
注:*表示该成分与花青素合成相关酶活性呈显著相关性,<0.05。下同
Note: * indicates that there is a significant correlation between this component and enzyme activity involving in anthocyanin synthesis,<0.05. The same below

续表2

表3 不同季节的茶树花青素合成关键酶活性与酚类物质含量的相关系数
花青素合成关键酶活性测定结果显示,PAL、ANR等酶活性相对较低,ANS、CHS的酶活性较高,其中ANS活性最高且比较稳定,在不同的品种(系)及季节波动性较小;不同季节茶树鲜叶PAL、CHS、F3H、FLS、ANS、ANR等酶活性变化趋势与花青素含量变化无显著的相关性,供试组和对照组的各个酚类组分的含量与F3H和DFR的相关性呈现大致相反的趋势,但相关性均不显著,可能与样本数量较少有关。本次试验所选的绿芽对照品种(英红九号)茶多酚及儿茶素含量都相对较高,而茶树体内花青苷的合成途径又是类黄酮合成途径的分支,所涉及酶类不仅参与花青素的合成,而且大部分会参与到包括儿茶素在内的其他类黄酮物质的合成,因而导致大部分的酶活性与花青苷或儿茶素等无明显的相关性。
本研究还发现,同一季节UFGT酶活性在供试组及对照组之间存在显著差异,UFGT酶活性与同一季节不同品种(系)中花青素含量呈正相关。UFGT是红紫芽茶花青素合成过程的关键酶,为茶叶中酚类物质的组成提供了一定生化动力,进而影响着红紫芽茶的主要理化成分。但由于茶树UFGT家族包含大量基因,它们的功能不同,具体哪些基因是花青素合成的关键基因仍需要深入研究。各品种(系)花青素含量的季节性变化趋势与UFGT酶活性相关性不一致,红叶品种(系)与其呈显著正相关,而紫叶的丹妃与其呈显著负相关,紫娟与其无显著相关性(表2)。UFGT酶活性在不同品种(系)中季节性的差异表现,可能是因为不同的品种(系)体内花青苷的组分不同,而由于本研究测定的UFGT是对类黄酮类的3位进行糖基化,如果酶体内主要的花青苷组分是甲基化、酰化花青素或5位糖基化等,那么该酶的活性变化趋势可能会与其体内花青苷的含量变化趋势有所偏差[29]。因此针对不同的茶树品种(系),其所含花青苷组分的差异可能导致UFGT酶活性的差异,后期还需对这些品种(系)中关键的UFGT进一步鉴定。此外,对花青素的修饰,除葡萄糖糖苷化作用外,对鼠李糖、阿拉伯糖等糖苷修饰酶的修饰作用,以及酰化和甲基化酶的修饰作用,也有待进一步研究分析,以获得对紫芽茶花青苷合成机理更加全面的了解。
[1] Fernandes I, Faria A, Calhau C, et al. Bioavailability of anthocyanins and derivatives [J]. Journal of Functional Foods, 2014, 7: 54-66.
[2] Santhakumar A B, Kundur A R, Sabapathy S, et al. The potential of anthocyanin-rich Queen Garnet plum juice supplementation in alleviating thrombotic risk under induced oxidative conditions [J]. Journal of Functional Foods, 2015, 14(15): 747-757.
[3] 宛晓春. 茶叶生物化学[M]. 3版. 北京: 中国农业出版社, 2003.Wan X C. Tea biochemistry [M]. 3rd ed. Beijing: China Agriculture Press, 2003
[4] 吴华玲, 何玉媚, 李家贤, 等. 11个红紫芽茶树新品系的芽叶特性和生化成分研究[J]. 植物遗传资源学报, 2012, 13(1): 42-47.Wu H L, He Y M, Li J X, et al. Shoot traits and biological compositions among eleven new tea germplasms with reddishviolet shoots [J]. Journal of Plant Genetic Resources, 2012, 13(1): 42-47.
[5] 萧力争, 胡祥文, 龚志华. 紫芽茶叶红茶适制性研究[J]. 湖南农业大学学报, 2002, 26(1): 89-193. Xiao L Z, Hu X W, Gong Z H. Research of suitability of purple bud tea black tea [J]. Journal of Hunan Agricultural University, 2002, 26(1): 89-193.
[6] Holton T A, Cornish E C. Genetics and biochemistry of anthocyanin biosynthesis [J]. Plant Cell, 1995, 7(7): 1071-1083.
[7] Araceli C, Madelourdes P H, Maelena P, et al. Chemical studies of anthocyanins: a review [J]. Food Chemistry, 2009, 113(4): 859-871.
[8] Wang Y S, Xu Y J, Gao L P, et al. Functional analysis of flavonoid 3',5'-hydroxylase from tea plant (): critical role in the accumulation of catechins [J]. BMC Plant Biology, 2014, 14(1): 347. doi: 10.1186/s12870-014-0347-7.
[9] 马春雷, 姚明哲, 王新超, 等. 利用基因芯片筛选茶树芽叶紫化相关基因[J]. 茶叶科学, 2011, 31(1): 59-65. Ma C L, Yao M Z, Wang X C, et al. Young shoot purple-related gene screening in tea plant () by using cDNA microarray [J]. Journal of Tea Science, 2011, 31(1): 59-65.
[10] 陈林波, 夏丽飞, 孙云南, 等. 特异茶树品种“紫娟”叶色转变的基因表达差异分析[J]. 茶叶科学, 2012, 32(1): 59-65.Chen L B, Xia L F, Sun Y N, et al. Analysis of differential gene expression on specific tea cultivar ‘Zijuan’ for leaf color changing [J]. Journal of Tea Science, 2012, 32(1): 59-65.
[11] 周琼琼, 孙威江. 茶树芽叶紫化的生理生化分析及其关键酶基因的表达[J]. 生物技术通报, 2015, 31(1): 86-91. Zhou Q Q, Sun W J. Physiological and biochemical analysis of young shoot purple-related and gene expression of key enzymes in tea plant () [J].Biotechnology Bulletin, 2015, 31(1): 86-91.
[12] 刘飞, 郭美丽. 花色苷生物代谢途径中相关酶的研究进展[J]. 药学服务与研究, 2011, 11(1): 34-38. Liu F, Guo M L. Advances in research on enzymes related to the biometabolism pathway of anthocyanins [J]. Pharmaceutical Care Research, 2011, 11(1): 34-38.
[13] 周天山, 王新超, 余有本, 等. 紫芽茶树类黄酮生物合成关键酶基因表达与总儿茶素、花青素含量相关性分析[J].作物学报, 2016, 42(4): 525-531.Zhou T S, Wang X C, Yu Y B, et al. Correlation analysis between total catechins (or anthocyanins) and expression levels of genes involved in flavonoids biosynthesis in tea plant with purple leaf [J]. Acta Agronomica Sinica, 2016, 42(4): 525-531.
[14] Wei K, Wang L, Zhang Y, et al. A coupled role forandin anthocyanin hyperaccumulation in purple tea [J]. The Plant Journal, 2019, 97(5): 825-840.
[15] 金琦芳, 孙威江, 陈志丹. 光照对紫色芽叶茶花青素合成的调控机理[J]. 生物技术通报, 2015, 31(6): 20-27. Jin Q F, Sun W J, Chen Z D. Regulation mechanism of anthocyanin synthesis in purple shoots of tea by lighting [J]. Biotechnology Bulletin, 2015, 31(6): 20-27
[16] 李智. 不同环境因子调控茶树紫色芽叶形成的分子机制研究[D]. 泰安: 山东农业大学, 2014. Li Z. Molecular mechanisms of different environmental factors regulating the formation of purple buds and leaves in tea plants [D]. Tai'an: Shandong Agricultural University, 2014.
[17] 吴华玲, 乔小燕, 李家贤, 等. “红紫芽”茶树新品系的生物学特性研究[J]. 热带作物学报, 2011, 32(6): 1009-1015. Wu H L, Qiao X Y, Li J X, et al. Biological characters of new tea germplasms with reddishviolet shoots [J].Chinese Journal of Tropical Crops, 2011, 32(6): 1009-1015.
[18] Lv H P, Dai W D, Tan J F, et al. Identification of the anthocyanins from the purple leaf coloured tea cultivar Zijuan (var.) and characterization of their antioxidant activities [J]. Journal of Functional Foods, 2015, 17: 449-458.
[19] 李智, 王日为, 张丽霞, 等. 茶树紫色芽叶花青苷组分分析及结构推测[J]. 茶叶科学, 2014, 34(3): 279-287. Li Z, Wang R W, Zhang L X, et al. Analysis and structural identification of anthocyanin components in purple buds and leaves of tea plant [J]. Journal of Tea Science, 2014, 34(3): 279-287.
[20] 萧力争, 苏晓倩, 李勤, 等. 紫芽品种茶树芽叶多酚类物质组成特征[J]. 湖南农业大学学报(自然科学版), 2008, 34(1): 77-79. Xiao L Z, Su X Q, Li Q, et al. The composition and characteristics of tea polyphenols in purple tea varieties [J]. Journal of Hunan University of Science & Technology (Natural Science Edition), 2008, 34(1): 77-79
[21] 王秋霜, 凌彩金, 刘淑媚, 等. 花青素分离纯化及其组分鉴定研究进展[J]. 食品工业科技, 2013, 34(3): 358-364. Wang Q S, Ling C J, Liu S M, et al. Research progress in separation purification and component identification of anthocyanins [J]. Science and Technology of Food Industry, 2013, 34(3): 358-364.
[22] 王秋霜, 凌彩金, 刘淑媚, 等. 红紫芽茶叶花青素提取分离及pH稳定性初探[J]. 中国农学通报, 2014, 30(9): 291-296. Wang Q S, Ling C J, Liu S M, et al. Anthocyanins in red and purple tea extraction & separation and pH stability exploration [J]. Chinese Agricultural Science Bulletin, 2014, 30(9): 291-296.
[23] 王燕, 杨晓萍, 陈波伟, 等. 紫娟茶花青素的研究进展[J]. 食品安全质量检测学报, 2017, 8(11): 173-178. Wang Y, Yang X P, Chen B W, et al. Research progress of anthocyanins from Zijuan tea [J]. Journal of Food Safety & Quality, 2017, 8(11): 173-178.
[24] 李璐, 倪婷婷, 关文玉, 等. 基于响应面法提取“紫娟”茶花青素最佳工艺的优化研究[J]. 西南农业学报, 2014, 27(4): 1704-1709.Li L, Ni T T, Guan W Y, et al. Study on process of anthocyanins extraction from ‘Zijuan’ tea by response surface methodology [J]. Southwest China Journal of Agricultural Sciences, 2014, 27(4): 1704-1709.
[25] 费旭元, 林智, 梁名志, 等. 响应面法优化“紫娟”茶中花青素提取工艺的研究[J]. 茶叶科学, 2012, 32(3): 197-202. Fei X Y, Lin Z, Liang M Z, et al. Study on process of anthocyanins extraction from ‘Zijuan’ tea by response surface analysis [J]. Journal of Tea Science, 2012, 32(3): 197-202.
[26] 田野, 殷中琼, 唐茜. 紫嫣茶中花青素水提工艺及其提取物抗癌活性[J]. 安徽农业大学学报, 2019, 46(1): 7-13. Tian Y, Yin Z Q, Tang Q. Water extraction process of anthocyanins from “Ziyan” tea and the antitumor activity of its extracts [J]. Journal of Anhui Agricultural University, 2019, 46(1): 7-13.
[27] Solecka D, Kacperska A. Phenylpropanoid deficiency affects the course of plant acclimation to cold [J]. Physiologia Plantarum, 2003, 119(2): 253-262.
[28] 黄意欢. 茶学实验技术[M]. 北京: 中国农业出版社, 1997.Huang Y H. Technology of tea science [M]. Beijing: China Agriculture Press, 1997.
[29] Ogata J, Itoh Y, Ishida M, et al. Cloning and heterologous expression of cDNAs encoding flavonoid glucosyltransferases from[J]. Plant Biotechnology, 2004, 21(5): 367-375.
Study on the Correlation between the Activities of Key Enzymes Involving in Anthocyanin Synthesis and the Contents of Important Polyphenols in Purple Tea
CAO Bingbing1,2, WANG Qiushuang1*, QIN Dandan1, FU Donghe2, FANG Kaixing1, JIANG Xiaohui1, LI Hongjian1, WANG Qing1, PAN Chendong1, LI Bo1, WU Hualing1*
1. Tea Research Institute, Guangdong Academy of Agricultural Sciences, Guangdong Key Laboratory of Tea Plant Resources Innovation & Utilization Resources Innovation and Utilization, Guangzhou 510640, China; 2. Hunan Agricultural University, Changsha 410128, China
In this study, four purple tea cultivars (strains) namely Hongye 1, Hongye 2, Danfei from Guangdong and Zijuan from Yunnan were used as the testing materials. Yinghong 9 with green buds was used as the control. The activity changing patterns of the key enzymes involved in anthocyanin synthesis were studied by the enzyme activities analysis, which revealed the relationship between the enzyme activities and biochemical components in tea. The results show that the activity of flavonoid-3--glycosyltransferase (UFGT), a key enzyme involved in anthocyanin synthesis, was positively correlated with the total amount of tea polyphenols and the anthocyanin contents in different samples in the same season. However, the activities of phenylalanine ammonia lyase (PAL), chalcone synthase (CHS), flavonoid-3-hydroxylase (F3H), dihydroflavonol-4-reductase (DFR), flavonol synthase (FLS), anthocyanin synthase (ANS) and anthocyanin reductase (ANR) were not significantly correlated with the anthocyanin contents. There was a significant and positive correlation between catechin (C) content and PAL enzyme activity in spring. Epicatechin gallate (ECG) content and DFR enzyme activity showed the same result. In addition, there was no significant correlation between the activities of CHS, F3H, ANS and ANR enzymes and polyphenols contents in different cultivars (strains) in the same season.
purple tea, anthocyanin, enzyme, polyphenols
S571.1
A
1000-369X(2020)06-724-15
2020-03-03
2020-04-07
广东省重点领域研发计划(2020B020220004)、国家现代农业产业技术体系建设专项(CARS-19)、国家自然科学基金(31600550)、科技创新战略专项资金(201619TD、R2016YJ-YB3002、R2017PY-QY009、R2018QD-100)
曹冰冰,女,硕士,主要从事茶树育种研究,bbc@163.com。*通信作者:wqsh1113@163.com;wuhualing@163.com
