清开灵注射液临床用药安全性的再评价
2020-12-13吉萌萌武红莉吴嘉瑞荆志伟
吉萌萌,王 忠,刘 骏,武红莉,吴嘉瑞,杨 伟,周 莎,荆志伟*
(1.中国中医科学院,北京 100700;2.中国中医科学院中医临床基础医学研究所,北京 100700;3.北京中医药大学中药学院,北京 100029)
清开灵注射液是根据古方安宫牛黄丸组方原则改制而成的一种中药制剂,收载于2005至2015年版《中国药典》,由胆酸、珍珠母(粉)等8种成分组成,具有清热解毒、化痰通络、醒神开窍的功效[1],临床广泛应用于治疗急性小儿上呼吸道感染、小儿高热惊厥、肺炎、肝炎、脑血管疾病等[2-5]。关于清开灵注射液的安全性问题,既往诸多研究人员基于个案报道、系统评价的安全性文献、医院信息管理系统(HIS)等[6-9]进行了分析,可发现其不良反应信号,但均有一定局限性,比如来源于多个文献的数据质量参差不齐,无法获得较为准确的不良反应数据;被动监测数据分析无法计算不良反应发生率,并存在少报、漏报的缺点。
由于多中心、前瞻性的医院集中监测可获取清开灵注射液患者全部用药及发生不良反应信息,并能计算不良反应发生率,得出其特征,因此,本研究采用该方法在全国48家医疗机构进行清开灵注射液监测研究,以期为该制剂安全合理用药提供依据,现报道如下。
1 资料与方法
1.1 研究设计 本研究采用多中心、前瞻性的医院集中监测设计方法。
1.2 监测机构 本研究在全国共设有48家监测机构,包括深圳仁爱医院、三门峡市中心医院、新郑市中医院、大连大学附属中山医院、灵宝市第一人民医院、石家庄市中医院、新乡市中医院、石家庄市中心医院、河南省中医学院第三附属医院等。
1.3 监测对象及样本量 2013年1月至2016年3月在监测机构所有使用清开灵注射液的患者,数据来源于河北神威药业有限公司。样本量根据药物流行病学病例观察研究的计算方法“三例原则”,即目前对若干主要生产厂家的品种进行汇总,得到不良反应(含严重不良反应)发生率均低于0.01%,属于偶见不良反应。因此,目标样本量至少30 000例。
1.4 监测形式及内容 按照中成药医院集中监测规范[10]制定统一监测方案、监查规范、成立研究组、督查组,深入临床观察、随访患者用药反应,由临床医师/护师/药师填写集中监测表。相关信息包括①一般信息,即性别、年龄、民族、所在的医院和科室、既往病史和过敏史;②诊断信息,即西医、中医诊断信息;③用药信息,即清开灵注射液使用方式、用药天数、药物剂量、溶剂种类及用量、注射持续时间、滴速、间隔用药时间;④联合用药信息,即合并用药类别、名称、剂量、厂家、批号;⑤不良反应/事件信息,即名称、发生时间、症状、体征、临床检验、结果、转归、预后。
1.5 质量控制 主要从7个方面实施,包括监测中心、监测人员、监测进度、原始文件、电子数据、档案管理、质量管理。其中,原始文件通过调取医院信息系统数据中研究时间范围内使用清开灵注射液的病例数,与实际登记例数对比,检查是否有漏报情况及监测表填写质量,再通过与原始病历对照溯源进行检查,要求具备规范性、及时性、准确性、真实性;电子数据要求与纸质监测表内容一致。
1.6 数据管理 本研究通过监测表进行数据采集。首先是现场核查,主要指核对源数据与监测表或电子数据的一致性。在收集数据结束后进行整体核查与清理,包括清除重复数据、修改错误数据及疾病和药物名称不标准数据。采用独立双人双份数据录入、差异校验功能方式,将监测表数据录到“清开灵注射液安全性监测数据管理系统” 中,用于统计分析。
1.7 不良反应因果判断方法 按照中国不良反应监测中心的六级评定标准[11],将不良反应发生与清开灵注射液使用的因果关系评价分为肯定、可能、很可能、待评价、可能无关与无法评价,其中可能、很可能、肯定为病例,具体见表1。本研究采用三级不良反应判读方法,首先是一级判读,由监测者完成;其次是二级判读,由监测机构不良反应判读专家委员会完成;最后是三级判读,由行业不良反应专家委员会完成,三级判读后,确定清开灵注射液最终的不良反应/事件。

表1 现行药品不良反应因果评价表
1.8 伦理审查与国际注册 本研究已通过中国中医科学院中医临床基础医学研究所伦理委员会伦理审查,国际临床注册号NCT01764204。
1.9 数据处理
1.9.1 数据标准化及编码 参照国际通用的《疾病和有关健康问题的国际统计分类》 (ICD-10)[12],对西医诊断数据进行标准化处理;参照《中医内科学》,对中医辨证数据进行标准化处理;参照《WHO药品不良反应术语》,对病例中的不良反应名称进行标准化处理。对年龄、用药时间、用药剂量等计量数据,以及性别、给药途径等分类变量给予数据编码;对药物名称、用药原因、既往病史等变量进行记录,将其汇总分析后进行编码;对不合理用药因素进行双重编码。每个指标评分均分为5个等级,赋值0~4,分级原则结合相关文献和专家意见确定。
1.9.2 统计分析 通过R3.5.0版本统计分析软件进行编程计算。对于计数资料,采用描述方法分析其频数及百分比;对于计量资料,采用分段描述其频数和百分比的方式。
2 结果
2.1 监测完成情况及不良反应发生率
2.1.1 患者年龄、性别分布 本研究由48家国内医疗机构参加,共纳入30 842例患者,其中男性16 209例(52.55%),女性14 633例(47.45%);年龄0~98.82岁,平均41.08岁,具体分布见图1;发生不良反应92例,发生率0.3%。具体单位见表2。

图1 患者年龄分布
2.1.2 患者既往病史分布 在30 842例患者中,有既往病史的6 912例 (22.41%),排名前三位依次是高血压(3 177例)、脑梗塞(1 108例)、糖尿病(1 077例),涉及血管与淋巴管类(3 218例)、神经系统(1 502例)、心脏系统(1 310例)、代谢及营养类(1 158例)、感染及侵染类(695例)、胃肠道系统(451例),肌肉骨骼及结缔组织(407例),肿瘤(良性、恶性、性质不明,包括囊状和息肉状)(340例)、眼(291例)、呼吸系统(包括胸及纵隔)(249例)、手术及医疗操作(249例)、肝胆系统(208例)、肾脏及泌尿系统(109例)、各类损伤中毒及手术并发症(104例)、生殖系统及乳腺(87例)、内分泌系统(81例)、精神病类 (65例)、血液及淋巴系统 (51例)、皮肤及皮下组织类(49例)、耳及迷路类(33例)等。其中,既往病史中的高血压、脑梗塞、糖尿病分别涉及血管与淋巴管类、各类神经系统、代谢及营养类。
2.1.3 患者过敏史分布 在30 842例患者中,有过敏史的660例(2.14%),包括西药过敏607例、中药过敏41例、食品过敏有8例,其他4例。在西药过敏史中,主要有281例是青霉素过敏,113例磺胺类过敏,68例头孢类过敏。
2.1.4 患者不良反应史分布 在30 842例患者中,有不良反应史(即有相关具体表现症状)的230例(0.75%),包括皮疹(106例)、肝损害(103例)等。具体见表3。

表2 监测单位纳入病例分布
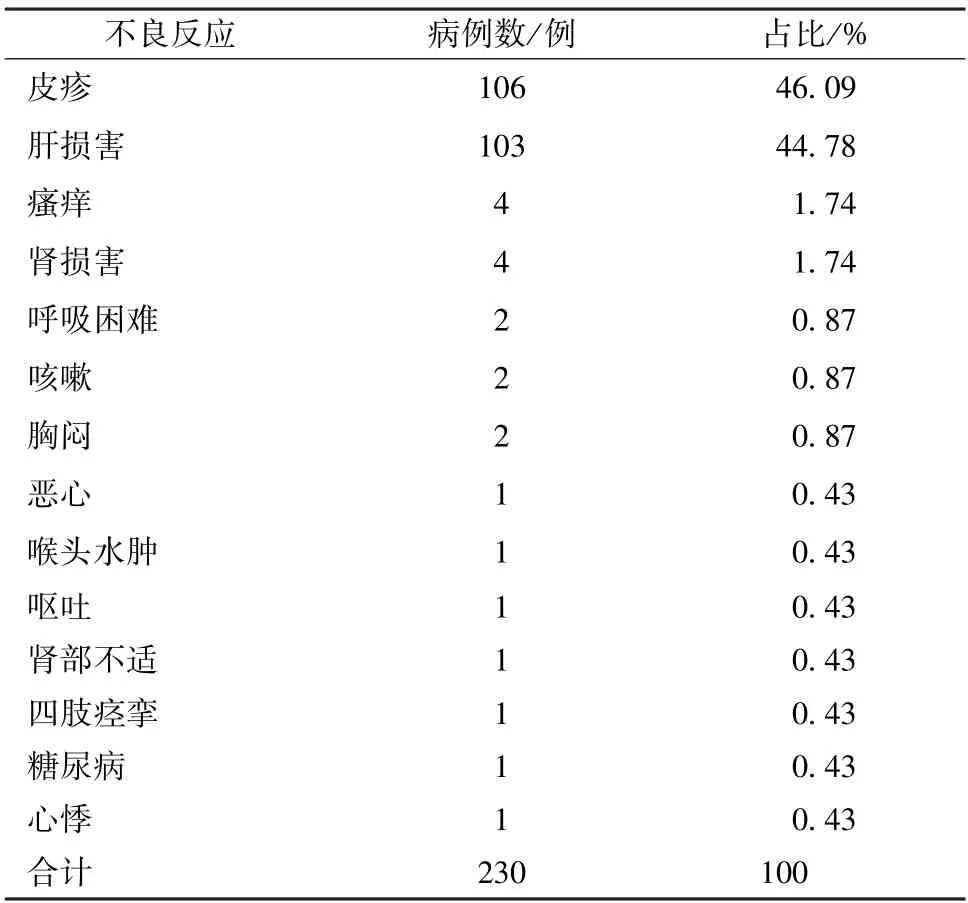
表3 患者不良反应史分布
2.2 不良反应症状、涉及系统分布 在92例不良反应病例中,有174例表现,主要为皮疹、瘙痒、恶心、胸闷、头晕等,具体见表4,所涉及系统包括皮肤及皮下组织类、全身性损害、胃肠系统等,具体见表5。
2.3 不良反应诊断分布 在92例不良反应病例中,西医诊断最多的是上呼吸道感染(30例),其次是气管炎(16例),具体见表6;中医辨证最多的是痹证(4例)、中风病(4例),其次是湿热证(3例),具体见图3。
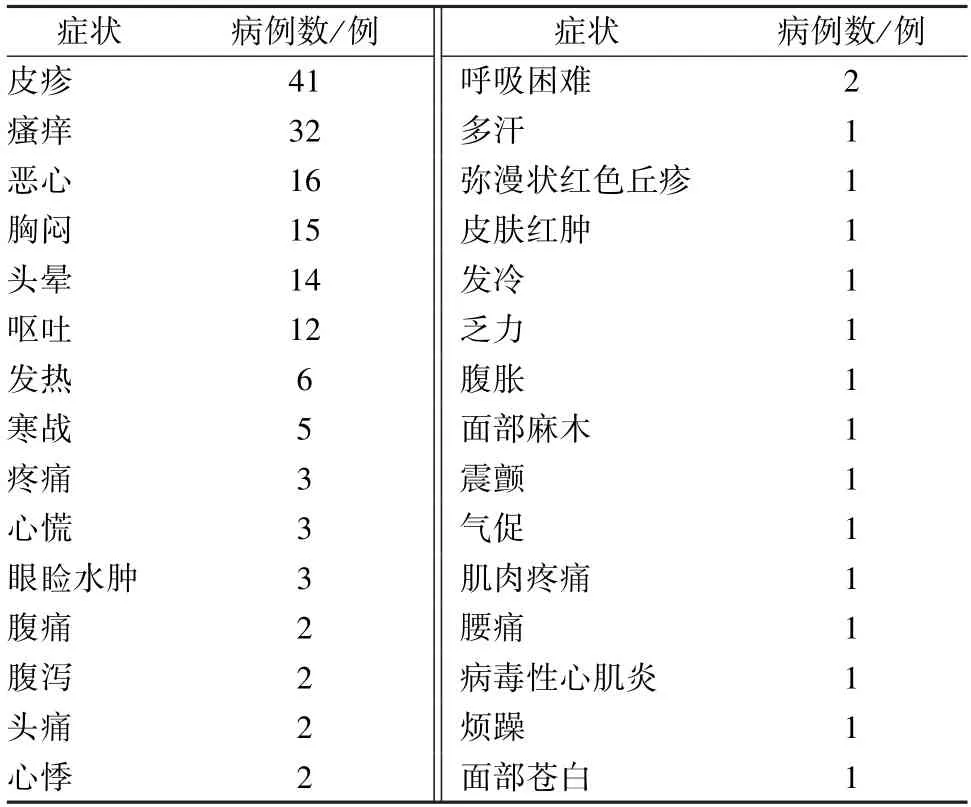
表4 不良反应症状分布
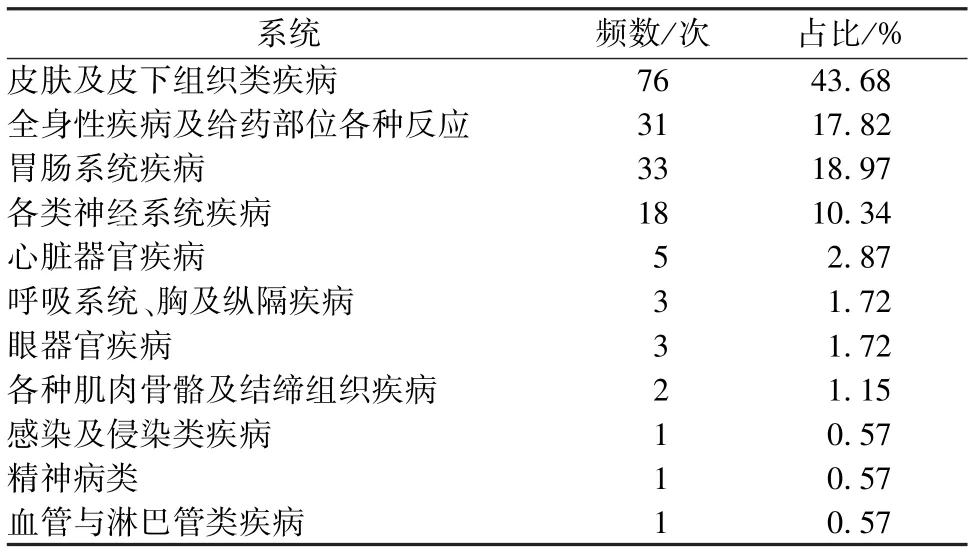
表5 不良反应涉及系统分布

表6 不良反应西医诊断分布

图3 不良反应中医辨证分布
2.4 不良反应用药特征分布 在92例不良反应病例中,给药剂量最多的为10~20 mL,具体见图4;滴注速度为20~40滴/min的有33例,40~60滴/min的有52例,其他为1例,缺失6例;溶剂为0.9% 生理盐水的有62例,10%葡萄糖的有3例,5%葡萄糖的有26例,葡萄糖氯化钠注射液的有1例;仅1例为间隔用药,间隔时间4 h。
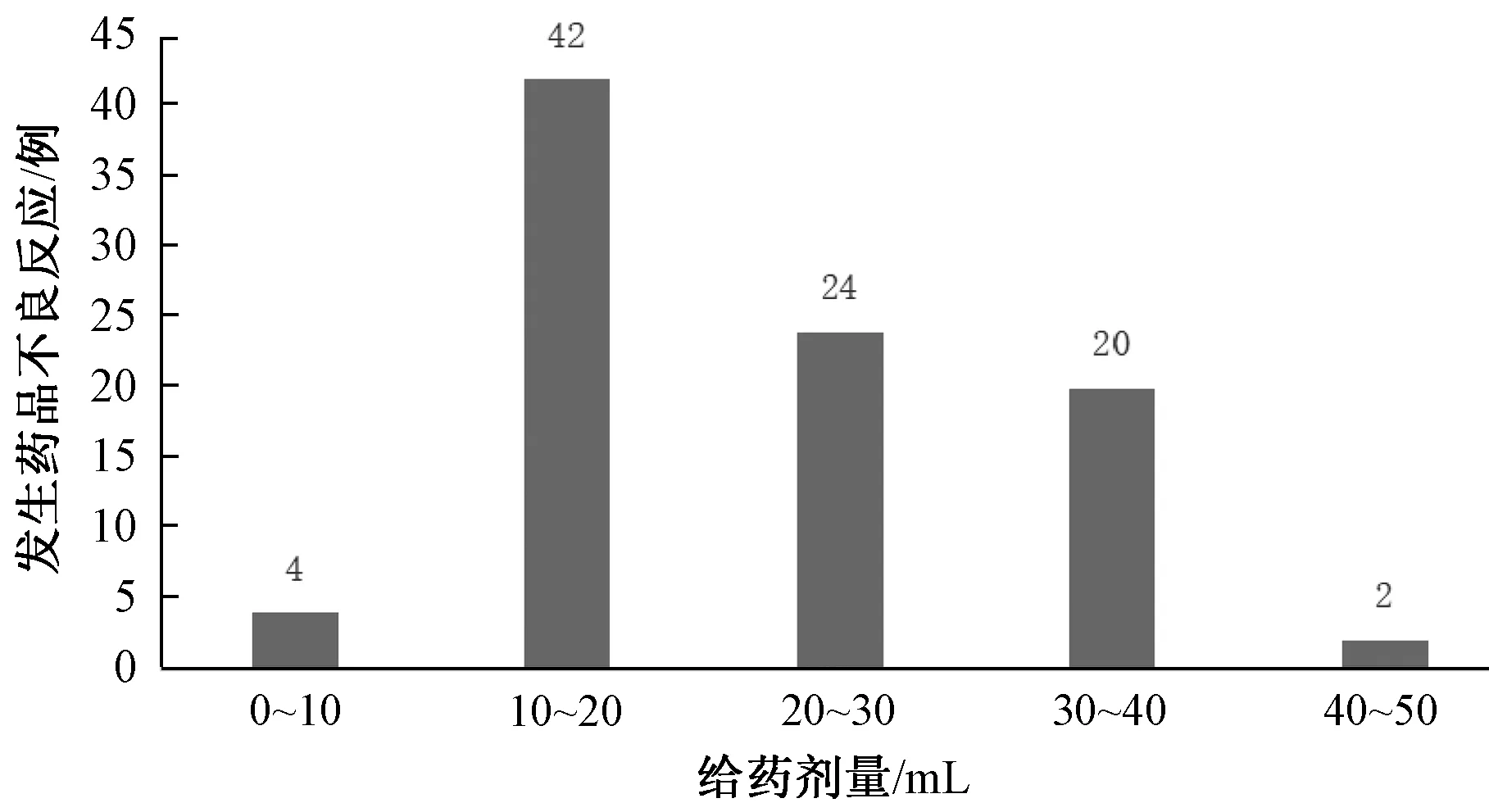
图4 不良反应给药剂量分布
2.5 不良反应合并用药分布 在92例不良反应病例中,有86例合并用药,主要与2种其他药物合并,具体见图5;合并用药频数≥5次的有肺力咳、硫糖铝片、替考拉宁、二乙酰氨乙酸乙二胺、吡拉西坦注射液、苯巴比妥钠、司帕沙星、保元丸、利奈唑胺、四磨汤口服液,具体见表7。

图5 不良反应合并用药分布
3 结语
本研究采用多中心、前瞻性注册登记式的医院集中监测,发现30 842例使用清开灵注射液的患者中男性有16 209例(52.55%),女性有14 633例(47.45%),平均年龄为41.08岁;有92例发生不良反应,发生率为0.3%,属于偶见不良反应,包括皮疹、瘙痒、恶心、胸闷、头晕、呕吐等。在发生不良反应的上述患者中,西医主要诊断为上呼吸道感染、气管炎、扁桃体炎;溶剂种类为0.9%生理盐水、10%葡萄糖、5%葡萄糖、葡萄糖氯化钠注射液;给药剂量、滴速分别以10~20 mL (42例)、40~60滴/min(52例)为主,仅1例为间隔用药;合并用药有86例,大多为肺力咳、硫糖铝片、替考拉宁、二乙酰氨乙酸乙二胺、吡拉西坦注射液。
基于此,本研究初步推测引起清开灵注射液不良反应原因可能为①该制剂中金银花所含绿原酸[13-14]及板蓝根[15]均有致敏作用,栀子水提物、醇提物及栀子苷均有肝毒性;②小鼠类过敏实验发现,该制剂发生类过敏反应与其剂量有明显相关性[16];③现已确认,该制剂不能与硫酸庆大霉素、青霉素G钾、青霉素G、肾上腺素、阿拉明、乳糖酸红霉素、多巴胺、硫酸镁注射液、山梗菜碱、硫酸美芬丁胺等药物配伍使用[1];④在临床使用过程中,存在与说明书中疾病不符、给药剂量和速度不当、溶剂选择不合理等情况。因此,临床医师在使用清开灵注射液时应注意药物配伍禁忌及不良反应发生,功能相近的2种注射液应避免联用,如必须联用,则需根据患者体质及疾病特点控制使用剂量,延长间隔时间,注意观察用药后不良反应,并作好用药监护,同时应严格按照说明书相关规定操作。但以上因素的分析仅在现有研究证据的情况下,若进一步明确不良反应影响因素,则仍需作其他试验加以验证。
另外,本研究也存在一定局限性,需在今后加以改善。①在不良反应分析方面,可能存在低估问题;②采用非随机抽样选取的医院为清开灵注射液用量较大者,可能存在一定选择性偏倚,无法代表广泛人群;③在判断不良反应因果关系、轻重程度时,由于监测人员知识结构差异而可能存在测量偏倚。

表7 不良反应合并用药分布
