不同成熟期北五味子质量初步评价
2020-12-13唐志书许洪波黄文静孙晓春解江冰刘玉兰
李 铂,唐志书*,许洪波,黄文静,王 楠,孙晓春,解江冰,刘玉兰,陆 博
(1.陕西中医药大学陕西省中药资源产业化协同创新中心,陕西咸阳 712083;2.陕西云岭生态科技有限公司,陕西西安 710000;3.柞水县科技开发中心,陕西柞水 711400)
五味子Schisandra chinensis(Turcz.)Baill.为木兰科五味子属多年生木质藤本,其干燥果实又称北五味子[1],为传统大宗药材之一,具有涩精止泻、生津敛汗等功效。北五味子主产东北三省、内蒙古、河北等地[2],果实富含五味子醇甲、五味子醇乙、五味子乙素等木脂素类[3-4]、有机酸、挥发油、多糖等多种化合物[5-6]。秦岭地区气候环境适宜、植被类型丰富,分布有华中五味子S.sphenanthera、红花五味子S.rubriflora、铁箍散S.propinquavar. sinensis等多种五味子属植物[7]。北五味子作为传统中药和保健食品的原料,随着市场需求不断增加,人工种植的北五味子面积逐渐增大,研究采收期对五味子药材产量和品质的影响具有重要的指导意义。本研究对处于不同成熟期的北五味子进行分批采收,测定果实中总酚酸、总黄酮、总多糖、木脂素类等成分含有量,综合多项指标,确定移栽于秦岭地区北五味子的最佳采收时期,以期为五味子药材规范化种植提供一定的技术指导。
1 材料
美国Waters ACQUITY H-Class超高效液相色谱仪(美国Waters公司);UV-2600紫外可见分光光度计(日本Shimadzu公司);101型电热鼓风干燥箱(北京科伟永兴仪器公司)。没食子酸(批号731C031)、福林酚购自北京索莱宝科技有限公司;芦丁(批号170221)、葡萄糖(批号160509)、五味子醇甲(批号160513)、五味子乙素(批号160521)购自陕西乐博生化有限公司;乙腈(色谱纯,美国Honeywell公司);磷酸(色谱纯,天津市科密欧化学试剂有限公司);水为超纯水,其余试药均为国产分析纯。
北五味子种植于陕西省商洛市柞水县北河村陕西云岭生态科技有限公司五味子科技示范基地内(33°49′52.8″ N,109°12′42.7″ E,海拔1 434 m),经陕西中医药大学王继涛教授鉴定为木兰科五味子属五味子Schisandra chinensis(Turcz.)Baill.。
2 方法与结果
2.1 样品采集与前处理 分别于2017年8月15日、8月30日、9月15日采收3批五味子样品,每批随机设3个重复,样品收集后洗净,50 ℃烘干。取3批已干燥的样品,粉碎并过3号筛,每个样品称0.5 g,精密称定,置于具塞锥形瓶中,加入25 mL 70%乙醇,超声提取30 min,取出放冷,补足减失质量,过滤即得。
2.2 五味子总酚酸含有量测定 采用福林酚法测定五味子中总酚酸含有量[8]。精密量取0.425 mg/mL没食子酸对照品溶液0、15、30、45、60、75、90 μL,蒸馏水补体积至100 μL,加入福林酚试剂1.5 mL,摇匀;加入7.5%Na2CO3溶液1.5 mL,30 ℃避光反应1.5 h,测定765 nm处吸光度,以没食子酸含有量为横坐标(X),以吸光值为纵坐标(Y),得回归方程为Y=0.021 3X+0.057 2 (r=0.997 5)。分别吸取“2.1” 项下待测样品100 μL,按上述测定方法,记录765 nm处吸光值,计算总酚酸含有量。结果表明,五味子果实中总酚酸含有量随采收时间的变化呈现先升后降的趋势,采收于8月30日的果实中总酚酸含有量最高为15.749 mg/g,见表1。
2.3 五味子总黄酮含有量测定 总黄酮含有量测定采用NaNO2-Al (NO3)3比色法[9]。精密量取1 mg/mL芦丁对照品溶液0、20、40、60、80、100、120 μL,70% 乙醇补体积至200 μL,依次加入30% 乙醇1.8 mL、5% NaNO20.5 mL,摇匀,静置6 min;加入10% Al (NO3)30.5 mL,摇匀,静置6 min;最终加入1 mol/L NaOH 2 mL,摇匀,静置15 min,测定510 nm处吸光值。以芦丁含有量为横坐标(X),以吸光值为纵坐标(Y),得回归方程为Y=0.002 3X+0.009 3 (r=0.996 1)。分别吸取“2.1” 项下待测样品200 μL,按相同方法测定,记录510 nm处吸光值,计算总黄酮含有量。结果表明,五味子果实中总黄酮含有量随采收时间的延长亦表现为先升后降的趋势,采收于8月30日的果实中总黄酮含有量最高为8.543 mg/g,见表1。
2.4 五味子多糖提取与含有量测定
2.4.1 五味子粗多糖制备 称取五味子样品0.250 g,置于具塞锥形瓶中,加入蒸馏水10 mL,超声20 min,滤过,重复上述提取步骤。取2次水提液,合并,加入无水乙醇,使其终浓度达到80%。4 ℃静置24 h,10 000 r/min条件下离心5 min,弃去上清,50 ℃烘干至恒定质量,得五味子粗多糖粉末。向粉末中加入25 mL蒸馏水,溶解,待用。
2.4.2 五味子多糖含有量测定 五味子多糖含有量采用苯酚-硫酸法进行测定[10]。精密量取0.1 mg/mL葡萄糖标准品溶液0、50、100、150、200、250、300 μL,蒸馏水补足体积,依次加入5%苯酚溶液1 mL、浓硫酸5 mL,摇匀,静置10 min,40 ℃水浴15 min;取出后迅速冰浴,10 min后测定490 nm处吸光值。以葡萄糖标准品浓度为横坐标(X),以490 nm处吸光值为纵坐标(Y),得回归方程为Y=0.013 8X+0.077 9 (r=0.996 0)。分别吸取“2.4.1” 项下待测样品300 μL,按上述方法测定490 nm处吸光值,计算多糖含有量。结果表明,五味子果实中多糖含有量随着五味子果实成熟度的增加逐渐降低,9月15日采收的果实相比8月30日采收的样品中多糖含有量下降60.92%,见表1。
表1 不同采收期五味子果实中3种指标含有量比较(,mg/g)
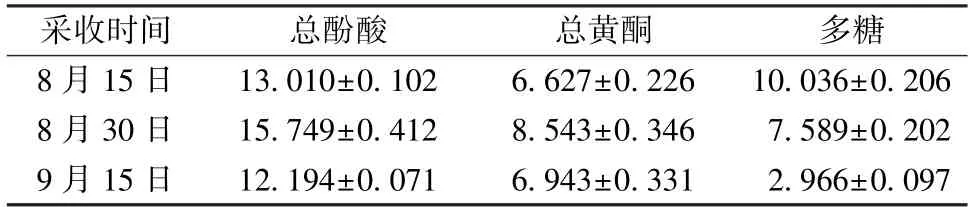
表1 不同采收期五味子果实中3种指标含有量比较(,mg/g)
2.5 2种木脂素含有量测定
2.5.1 样品处理及制备 精密称定不同采收时间五味子粉末约0.3 g,置于具塞锥形瓶中,加入甲醇25 mL,称定质量;超声提取20 min,取出放冷,再次称定质量,以甲醇补足失质量;摇匀滤过,取续滤液过0.22 μm微孔滤膜,用于UPLC分析。
2.5.2 对照品溶液制备 分别精密称定五味子醇甲和五味子乙素对照品各5.0 mg,置于10 mL量瓶中,加甲醇溶解并定容至刻度,制备成0.5 mg/mL的对照品贮备液。
2.5.3 色谱条件 ACQUITY UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7 μm);流动相0.1%磷酸(A)-乙腈(B),梯度洗脱(0~10 min,90% A,10% B;10~13 min,100% B;13~15 min,90% A,10% B);体积流量0.2 mL/min;柱温25 ℃;检测波长254 nm;进样量2 μL。色谱图见图1。

图1 各成分UPLC色谱图
分别精密吸取稀释至适宜浓度的对照品溶液0.5、1、2、3、4、5 μL,注入超高效液相色谱仪,在“2.5.3” 项条件下进样,每个体积进样3次,记录各对照品的峰面积,以峰面积为纵坐标(Y),以对照品质量为横坐标(X),进行回归,结果见表2。表明各成分在各自范围内线性关系良好。

表2 各成分线性关系
2.5.4 精密度试验 取同一批次样品粉末(9月15日采收),按“2.5.1” 项下方法制备供试品溶液,在“2.5.3”项条件下连续进样6次,每次2 μL,记录峰面积,测得五味子醇甲和五味子乙素峰面积的RSD分别为1.16%、1.28%,表明仪器精密度良好。
2.5.5 稳定性试验 精密吸取同一供试品溶液(9月15日采收),在 “2.5.3” 项条件下,分别于0、3、6、9、12、15、18、21、24 h进样2 μL,记录峰面积,测得五味子醇甲和五味子乙素峰面积的RSD分别为0.87%、1.55%,表明供试品溶液在24 h内稳定性良好。
2.5.6 重复性试验 分别精密称取同一批次样品粉末6份(9月15日采收),按“2.5.1” 项下方法制备供试品溶液,在“2.5.3” 项条件下分别进样2 μL,记录峰面积,五味子醇甲和五味子乙素含有量的RSD分别为2.08%、1.99%,表明该方法重复性较好。
2.5.7 加样回收率试验 精密称取6份含有量已知的9月15日样品粉末约0.15 g,根据样品中五味子醇甲、五味子乙素含有量的80%、100%、120%,分别精密加入对照品溶液,按 “2.5.1” 项下方法制备供试品溶液,在“2.5.3” 项条件下进样,计算加样回收率,五味子醇甲和五味子乙素平均加样回收率分别为102.86%、100.07%,RSD分别为2.28%、2.03%。
2.5.8 样品含有量测定 精密吸取“2.5.1” 项下样品溶液各2 μL,注入超高效液相色谱仪,在“2.5.3” 项条件下测定2种木脂素的含有量。结果表明,五味子醇甲和五味子乙素含有量随采收时间的变化呈现先升后降的趋势,8月30日前后含有量最高,分别达到5.540、3.020 mg/g,见表3。
表3 不同采收期样品中2种木脂素含有量比较(,mg/g)

表3 不同采收期样品中2种木脂素含有量比较(,mg/g)
3 讨论
本研究通过观测北五味子移栽于秦岭地区之后,不同成熟期果实中总酚酸、总黄酮、多糖及木脂素含有量的动态变化规律,发现采收时间对五味子药材品质相关的多个指标影响显著。总黄酮、总酚酸以8月30日前后采收的样品中含有量最高,多糖含有量随着采收期的延迟逐渐降低。
研究表明,五味子茎藤、叶和果实中均含较多酚酸和黄酮类成分[11-12],这两类成分在不同部位的积累规律为叶>茎藤>果实[13]。同时,五味子果实含有丰富的总多糖,具有较强的抗氧化能力[14]。郭志欣等[15]通过对通化市不同采收期栽培五味子多糖含有量进行比较,发现8月下旬栽培北五味子中多糖含有量最高,随着采收期的延后含有量逐渐下降。潘丕克等[16]发现辽宁地区北五味子种子与果肉中,五味子醇甲和五味子乙素的含有量在采收期呈现先升后降的趋势,在9月上旬达到最高值。本研究中,8月30日采收的五味子果实中五味子醇甲和五味子乙素含有量最高,不同采收时间五味子醇甲的含有量均高于2015年版《中国药典》 规定的最低含有量(0.40%)[1],表明不同引种栽培地区的气候条件和环境因子可能会影响五味子的最适采收期。
综合多种指标,并结合当地气候条件,初步确定移栽于秦岭地区的北五味子最佳采收时间在8月30日前后,此时五味子药材的品质为最佳。后续将对不同引种地区、不同生长期北五味子生理生化特性、木脂素生物合成途径关键基因表达水平等开展更深入的研究,构建移栽于秦岭地区北五味子的动态生长模型和有效成分动态积累模型,以期全面评价北五味子的品质形成规律,更好地为五味子规范化种植和产业发展提供技术支持。
